По своим свойствам алкены значительно отличаются от алканов. Например, для них характерны реакции присоединения и окисления. Все реакции присоединения происходят за счёт разрыва π-связи, большинство реакций окисления идут по этому же механизму.
Так, алкены присоединяют при комнатной температуре галогены: хлор, бром, менее эффективно – йод. В реакции бутена-2 с хлором образуется 2,3-дихлобутан.
H3C – CH = CH – CH3 + Cl2 → CH3 – CHCl – CHCl – CH3
В процессе реакции происходит разрыв π-связи в молекуле пропена и σ-связи в молекуле хлора с образованием двух новых σ-связей.
Кроме этого, алкены, в частности этилен, обесцвечивают раствор брома в воде. Поэтому данная реакция является качественной на присутствие двойных связей.
H2C = CH2 + Br2 → BrCH2 – CH2Br
1, 2-дибромэтан (растворитель)
Но еще в 1884 году русский ученый Львов М. Д. провёл реакцию хлорирования пропена в более жёстких условиях, при t = 400 0C. В результате получился продукт не присоединения хлора, а замещения.
H2C = CH – CH3 + Cl2 → H2C = CH – CH2Cl + HCl
Алкены вступают в реакции гидрирования – присоединения водорода. Данные реакции идут при обычной или повышенной температуре под действием катализаторов: платины, палладия, никеля и других.
H2C = CH – CH3 + H2 → H3C – CH2 – CH3
Алкены вступают в реакции присоединения воды – гидратации. Присоединение воды к алкенам идёт по правилу Марковникова, согласно которому атом водорода при присоединении воды или галогеноводородов присоединяется к наиболее гидрогенизированному атому углерода.
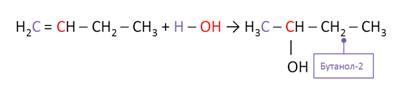
Присоединение воды происходит только в присутствии кислоты и при нагревании. (H3PO4, t, 0С) В результате присоединения воды к бутену образуется бутанол-2. Атом водорода от воды присоединился к наиболее гидрогенизированному атому углерода, то есть к тому атому, где больше атомов водорода при двойной связи, а ОН-группа присоединилась к другому атому углерода при двойной связи.
По такому же принципу идёт присоединение и галогеноводородов. Так, в реакции пропена с хлороводородом образуется 2-хлопропан.

Особым случаем реакции присоединения является реакция полимеризации.
Полимеризацией называется последовательное соединение молекул ненасыщенных соединений за счёт разрыва π-связей с образованием высокомолекулярных соединений.
Исходный алкен при этом называется мономером, а образующийся в результате продукт – полимер.
nA → (-A-)n
Полимеризацию проводят в присутствии веществ – инициаторов. Буква n обозначает степень полимеризации, которая показывает число молекул мономера, которое соединяется в процессе полимеризации. Реакция полимеризации протекает при повышенной температуре, давлении, в присутствии катализаторов.
Например, при полимеризации этилена образуется полиэтилен, при полимеризации винилхлорида – поливинилхлорид, при полимеризации тетрафторэтилена – тефлон, при полимеризации пропена – полипропилен, при полимеризации стирола – полистирол.

В реакциях окисления разрывается π-связь или С = С -связи. Алкены легко реагируют с окислителя. Если пропустить этилен через разбавленный раствор перманганата калия при низкой температуре, то фиолетовая окраска раствора исчезает. При окислении этилена перманганатом калия образуется этиленгликоль, эта реакция служит качественной реакцией на алкены. Эта реакция называется реакцией Вагнера.
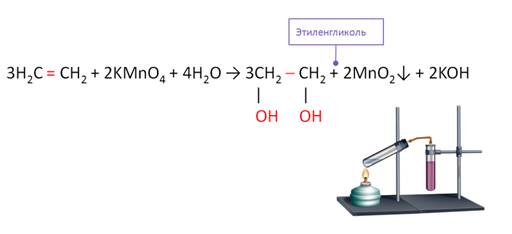
Этиленгликоль используют в качестве антифриза.
При каталитическом окислении этилена – в присутствии солей палладия и меди (PdCl2, CuCl2) – происходит образование уксусного альдегида.
2H2C = CH2 + O2 → 2CH3 – CHO
При окислении алкенов надкислотами или пероксидами водорода в щелочной среде образуются эпоксиды. Эта реакцию называют реакцией Прилежаева.

Николай Александрович Прилежаев – русский химик. Разработал синтез эпоксидов при действии на алкены органических надкислот.
При полном окислении алкенов – горении в избытке кислорода образуется углекислый газ и вода. Этилен, например, горит светящимся жёлтым пламенем.
2CH3 – CH = CH2 + 9O2 → 6CO2↑ + 6H2O
Из алкенов самым распространенным продуктом, который получают, является этилен. В промышленных масштабах его получают высокотемпературным разложением углеводородов нефти. Наибольший выход получается при пиролизе этана.

В
лаборатории этилен получают дегидратацией этанола. Реакция идёт при
температуре более >140  С,
в присутствии серной кислоты.
С,
в присутствии серной кислоты.

Алкены можно получить отщеплением галогеноводорода от галогеналканов. В зависимости от структуры исходного галогеналкана получается смесь алкенов. Так, при действии на 2-бромбутан спиртовым раствором щёлочи при нагревании получается бутен-1 и в качестве основного продута бутен-2.

Алкены можно получить и при дегидратации спиртов – отщеплении воды при нагревании с концентрированными растворами минеральных кислот. Отщепление воды и галогеналканов идёт по правилу Зайцева: при отщеплении галогеноводородов или воды от галогеналканов или спиртов атом водорода отщепляется от наименее гидрогенизированного атома углерода.
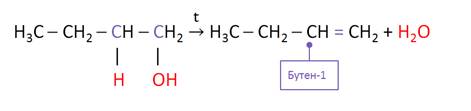
Алкены можно получить и при гидрировании алкинов. Так, при присоединении водорода к бутину-1 образуется бутен-1.

Алкены используют для получения спиртов, антифризов, лекарственных средств, полимерных материалов.
Из этилена получают полиэтилен, поливинилхлорид, этанол, уксусную кислоту, антифриз, ацетальдегид, каучуки, взрывчатые вещества, пестициды, растворители, этилен применяют для ускорения созревания плодов. Большое количество этилена перерабатывается в полиэтилентерефталат, необходимый для производства волокна лавсан.
Один из синтезируемых растениями фитогормонов, газ этилен, способствует созреванию плодов, причём он образуется, даже если плод уже сорван с ветки.
Таким образом, этилен и его гомологи могут присоединять галогены, водород, галогеноводороды, воду. Качественной реакцией на двойную связь является реакция с бромной водой и раствором перманганата калия. Для алкенов свойственны реакции полимеризации – получения высокомолекулярных соединения из низкомолекулярных. В лаборатории этилен получают дегидратацией этанола. Другие алкены в лаборатории получают отщеплением воды от спиртов, галогеноводорода от галогеналканов и гидрированием алкинов.

 Получите свидетельство
Получите свидетельство Вход
Вход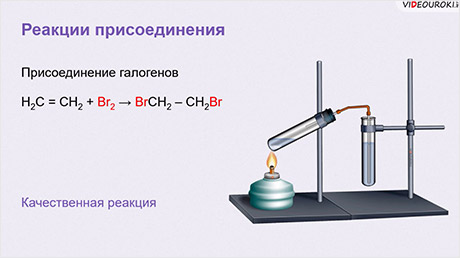



 0
0 13510
13510

