Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
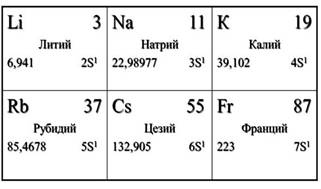
Теперь рассмотрим строение и свойства атомов элементов I A группы. Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
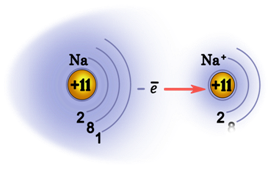
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.

Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
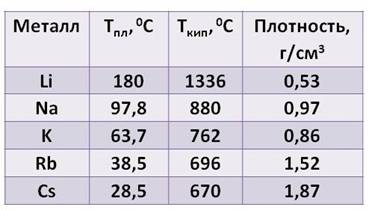
Из таблицы видно:
· плотность их увеличивается от лития к цезию
· температура плавления, в отличие от плотности, уменьшается от лития к цезию
· температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.

В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.

В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.

С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.

Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.

Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.

Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.

Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.

Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами. Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
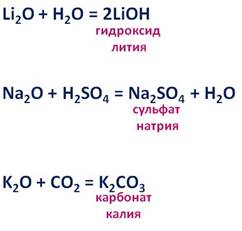
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.

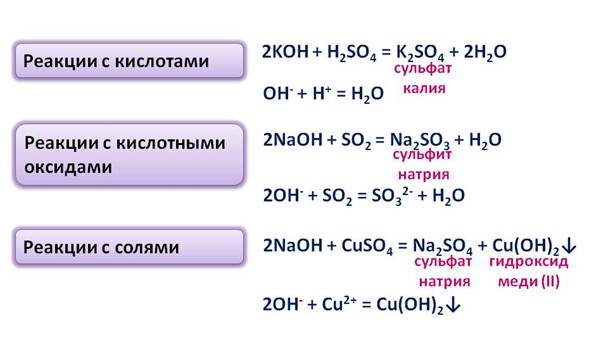
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе. Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты. Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода. В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода. В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.

Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.

Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.

Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
Рассмотрим наиболее значимые соли.
Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
Питьевую соду – NaHCO3 используют в быту и пищевой промышленности, а также в медицине.
Поташ, или карбонат калия – K2CO3 используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
Кристаллогидрат сульфата натрия, или глауберова соль –
Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.

Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия. В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны. Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги. Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г. Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.

Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
· к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
· отмиранию листьев растений
· повышению восприимчивости к грибковых и бактериальным заболеваниям
· снижению всхожести семян.
Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.

Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.

Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.

Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.

Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1. Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами . Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 15239
15239