Коррозия металлов. Сплавы
Интересно, что такое коррозия? А сплавы?
Поэт В. Шефнер писал: «Коррозия – рыжая крыса, грызёт металлический лом». А также есть народную мудрость: «Ржа ест железо».
Слово коррозия (от лат. сorrosio – разъедание) – это самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.

Каждый год из-за коррозии теряется около четверти всего произведённого в мире железа. Порча изделий из металла и потеря металлов обходится очень дорого. Затраты на ремонт или замену изделий во много раз превышают стоимость того металла, из которого они изготовлены.
Коррозия вызывает и серьёзные экологические последствия. Если происходит разрушение трубопроводов газа или нефти, то это приводит к загрязнению окружающей среды, а это негативно сказывается на здоровье людей.



Коррозию металлов и сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды).

Различают коррозию:
· химическую
· электрохимическую
При химической коррозии металл разрушается под действием окислителей – неэлектролитов, например газов (кислорода, хлора и др.) при повышенной или даже обычныой температурах.
2Fe + 3Cl2 = 2FeCl3
При электрохимической коррозии разрушение металлов происходит в растворах электролитов. Это значит, что в окружающей среде, где находится металл, должны быть вода и окислители: кислород, растворённые кислоты, соли. Так, под действием воздуха и содержащихся в нём паров воды на поверхности медных и бронзовых изделий образуется зелёная плёнка, называемая патиной.
2Cu + O2 + CO2 + H2O = (CuOH)2CO3
Но чаще всего коррозии подвергаются изделия из железа. Особенно сильно коррозирует металл во влажном воздухе и при соприкосновении с водой.
Процесс коррозии железа часто называют ржавлением. Автомобили, сельскохозяйственные машины, стальные балки, кухонная посуда – все эти изделия, будучи новыми, имеют гладкую, блестящую поверхность. Но при хранении во влажной атмосфере и при недостаточном уходе, они покрываются бурыми пятнами ржавчины, состав которой можно выразить обобщённой формулой Fe2O3 · nH2O.



При коррозии металлов и сплавов протекают окислительно-восстановительные реакции, в результате которых атомы металла, взаимодействуя с компонентами окружающей среды, окисляются, а сам окислитель восстанавливается. При этом металл из свободного состояния переходит в химические соединения – оксиды, сульфиды, гидроксиды.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Химически чистое железо почти не подвержено коррозии, а техническое железо, которое содержит различные примеси, ржавеет. Следовательно, одной из причин коррозии является наличие примесей в металле.

Возле города Дели в Индии находится железная колонна с очень маленькими пятнышками ржавчины, хотя её возраст почти тысячу семьсот лет. Это знаменитая Кутубская колонна высотой около семь м и массой шесть с половиной т. Согласно одной из гипотез, долговечность и коррозионная устойчивость колонны объясняются очень малым количеством различных примесей в железе и относительно невысокой влажностью, характерной для этой местности.

Например, если два различных металла, которые находятся в контакте между собой, опустить в водный раствор электролита (это могут быть грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, и тем самым предохранять менее активный металл от коррозии. Например, при контакте железа с медью в водной среде, железо, как более активный металл, постепенно коррозирует, переходя в воду в виде ионов железа. Таким образом, коррозия металла резко усиливается при соприкосновении его с менее активным металлом.

Образовавшиеся свободные электроны от атомов железа, перейдут к меди и на её поверхности соединяться с ионами водорода, которые образуются из компонентов водной среды (например, серной или других кислот). Этот электрохимический процесс можно представить так:
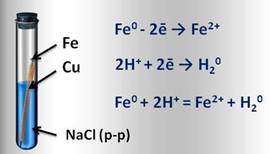
И наоборот, при контакте железа с более активным цинком, цинк разрушается и защищает железо от коррозии.
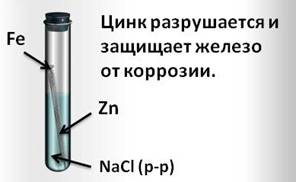
Таким образом, коррозия металла замедляется при соприкосновении его с металлом более активным, то есть находящимся в электрохимическом ряду напряжений металлов левее его.
Для борьбы с коррозией существует много способов.
· Во-первых, это нанесение защитных покрытий на поверхность металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные, поэтому их нужно обновлять.

Так, например, раз в год красят Эйфелеву башню в Париже.
В 1617 г. В Англии был выдан патент №4 на изобретение защиты доспехов – кольчуги и лат – от коррозии путём использования специального масла.

Предохраняемый металл можно покрыть и слоем другого металла: золота, серебра, хрома, никеля, олова, цинка. А также используют сплавы: бронзу, латунь и др. Таким образом, металлические изделия хромируют, никелируют, цинкуют и т.д.



Один из самых старых способов – это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью, которую в основном используют для изготовления консервной тары.
· Во-вторых, используют нержавеющие стали, содержащие специальные добавки. Например, так называемая «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.

Лёгкие нержавеющие сплавы включают алюминий и титан. Эта нержавеющая сталь довольно стойкая к коррозии из-за того, что на её поверхности образуется оксидная плёнка, которая состоит из оксидов хрома и железа. Так, обелиск «Покровителям космоса», расположенный во Всероссийском выставочном центре, облицован пластинками из титанового сплава.

· В-третьих, для защиты от коррозии вводят в среду, где находятся металлические изделия, вещества, которые значительно уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии. Ингибиторами коррозии могут быть фосфаты натрия, соли хромовой кислоты или органические соединения. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.

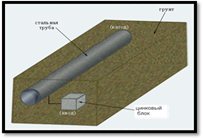
· В-четвёртых, создают контакт с более активным металлом – протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. На суше металлические конструкции, линии электропередачи и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.


Сплавы.
Окружающие нас металлические предметы редко состоят из чистых металлов. Только алюминиевые кастрюли или медная проволока имеют чистоту около 99%. В большинстве же других случаев люди имеют дело со сплавами.


В расплавленном состоянии металлы обычно смешиваются между собой, образуя однородную жидкость – расплав. Большинство металлов, например олово и свинец, золото и серебро, цинк и медь, могут смешиваться в каком угодно соотношении. При застывании этого однородного расплава получают твёрдую массу, которую называют сплавом.

Физические свойства сплавов отличаются от свойств составляющих их металлов. Например, сплав меди и цинка – латунь – значительно твёрже, чем отдельно взятые металлы, а прочность бронзы выше, чем у составляющих её меди и олова, сталь и чугун прочнее технически чистого железа. К серебру или золоту, которые в чистом виде очень мягки, для придания им твёрдости добавляют медь, хотя она в чистом виде также значительно мягче полученного сплава.



Поэтому в чистом виде металлы используют редко. Значительно чаще применяют их сплавы. Из различных металлов получены десятки тысяч различных сплавов.
Интересно, что для производства золотых изделий используют сплавы золота с медью. В зависимости от массовой доли в них золота различают пробы: 960, то есть это означает, что на 960 массовых частей золота приходится 40 массовых частей меди – это высшая проба, 920 проба – это ювелирный металл, 880 – 750 – монетный сплав, 750 – 375 – сплав для ювелирных изделий, а 360 – сплав для корпусных часов. Проба золота может быть выражена в каратах. В этом случае она показывает, сколько каратов (один карат = 0,2 г) чистого золота содержится в двадцать четыре каратах сплава. Проба при этом выражается числами 22, 18 и 14. Само слово «карат» происходит от названия зёрен субтропического дерева, которые использовали для взвешивания золота и драгоценных камней.

Существует сплав никеля с титаном, обладающий одним, почти фантастическим, свойством – своего рода памятью. Если куску проволоки из этого сплава в нагретом состоянии придать определённую форму, охладить, а потом как угодно смять или согнуть, то при повторном нагревании до некоторой минимальной температуры он снова примет ту форму, какую имел после горячей деформации.

Температура плавления большинства сплавов ниже температуры плавления наиболее легкоплавкого из металлов, образующих сплав. Например, температура плавления сплава олова и свинца, равна 180 0С, с температурами плавления чистых металлов, образующих сплав, соответственно 232 и 328 0С.

Комбинируя различные металлы в разнообразных количественных соотношениях, можно получить большое число сплавов с важными техническими свойствами:
· лёгкие
· кислотоустойчивые
· сверхтвёрдые
· коррозионно-стойкие
Так, чистая медь очень плохо поддаётся литью, из неё трудно получить отливки. И в тоже время оловянная бронза – сплав меди и олова – имеет прекрасные литейные свойства: из неё отливают художественные изделия, требующие тонкой проработки деталей. Чистый алюминий – очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди и никеля, называемый дюралюминием, в четыре раза прочнее алюминия на разрыв.


Таким образом, сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, один из которых – металл.
Компонентами сплавов могут быть и неметаллы, и различные соединения.
По состоянию компонентов сплавы могут быть:
· однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра
· неоднородными, например чугун, представляющий собой механическую смесь железа с углеродом.
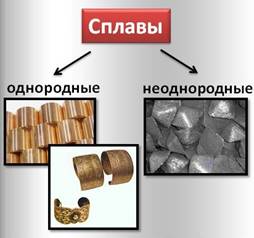
А также сплавы классифицируют по составу: медные, алюминиевые, никелевые, титановые и другие сплавы.


Названия наиболее распространённых сплавов, их состав и области применения приведены в таблице.
|
Название сплава |
Примерный состав |
Свойства |
Применение |
|
Бронза |
80-92% меди, 2% цинка, 6% олова |
Твёрдость |
Детали машин, приборы, художественные отливки |
|
Монель-металл |
65-70% никеля, 30% меди, добавки железа и марганца |
Коррозионная стойкость, устойчивость к истиранию |
Лопатки турбин, химическая, судостроительная, нефтяная, медицинская промышленность, изготовление монет |
|
Латунь |
50-60% меди, 40-50% цинка |
Коррозионная стойкость |
Машиностроение, химическая промышленность, производство бытовых товаров |
|
Мельхиор |
70-80% меди, 20-30% никеля, добавки железа и марганца |
Коррозионная стойкость, красивый внешний вид |
Медицинская техника, изготовление бытовой посуды, художественных изделий |
|
Припой |
50-70% олова, 30-50% свинца и др. |
Низкая температура плавления |
Пайка металлических изделий |
|
Дуралюмин |
80-95% алюминия, 1,3-1,5% меди, 0,5% магния, 0,5% марганца и др. |
Высокая прочность, лёгкость |
Авиастроение, детали велосипедов |
Сплавы бывают чёрные и цветные.
К чёрным сплавам относятся сплавы, где преобладает железо, а к цветным, где преобладают другие металлы. К чёрным сплавам относятся: чугун, сталь.
К цветным сплавам относятся бронза, латунь, мельхиор, дюралюминий, припой, монель-металл.
В состав сплавов могут входить не только металлы, но и неметаллы. Так, например, чугун представляет собой сплав железа с углеродом, содержание углерода в котором составляет от двух до четырех процентов по массе. Высокое содержание углерода приводит к тому, что при затвердевании чугуна часть углерода выделяется в виде графита и соединений углерода с железом. Выделяющийся графит образует в чугуне прожилки, что приводит к хрупкости чугуна. Чугун значительно твёрже железа, обычно он очень хрупкий, не куётся, а при ударе разбивается. Этот сплав применяют для изготовления различных массивных деталей методом литья, так называемый литейный чугун.



Чугун используют как сырьё при производстве другого распространённого сплава железа – стали, в которой содержится около двух процентов или меньше углерода по массе. В отличие от чугуна сталь можно ковать, штамповать, прокатывать, то есть придавать изделиям различную форму.

Для придания сталям определённых свойств в их состав вводят другие металлы, бор, кремний. Такие стали называют легированными. Например, сталь легированная вольфрамом, отличается высокой твёрдостью, поэтому она применяется для изготовления режущих инструментов. Легирование молибденом приводит к повышению её износоустойчивости, а сталь, содержащая примеси кобальта, используется для изготовления постоянных магнитов. Никель придаёт сталям высокую химическую стойкость и механическую прочность. Сплавы с высоким содержанием никеля используются для производства химической аппаратуры, сопел самолётов, космических ракет и спутников. Эти изделия устойчивы при температурах выше 1000 0С, то есть не разрушаются кислородом и горючими газами и обладают при этом прочностью лучших сталей.




Хромоникелевые стали очень пластичные, прочные, жаростойкие, кислотоупорные, устойчивые против коррозии. Их применяют в строительстве.
Например при облицовки колонн станции «Маяковская», а также при изготовлении нержавеющих предметов домашнего обихода: ножей, вилок, ложек, всевозможных медицинских инструментов.

Углеродистая сталь представляет собой сплав железа с углеродом, но в отличие от чугуна, содержание в ней углерода, а также марганца, кремния, фосфора и серы гораздо меньше.



Теперь вы знаете, что коррозия – это разрушение металлов и сплавов под действием окружающей среды. Различают химическую и электрохимическую коррозию. В результате коррозии протекает окислительно-восстановительная реакция, при которой атомы металла взаимодействуют с компонентами окружающей среды и окисляются. Коррозия металла усиливается при соприкосновении его с менее активным металлом и замедляется, если металл соприкасается с металлом более активным. Для защиты металлов от коррозии используют нанесение защитных покрытий, вводят ингибиторы коррозии, создают различные коррозионно-стойкие сплавы.
А если скомбинировать металлы в различных соотношениях друг с другом, а также с некоторыми неметаллами, то можно получить большое число сплавов. Физические свойства сплавов отличаются от свойств составляющих их металлов. Чугун и сталь – наиболее распространённые сплавы железа, то есть чёрные сплавы, а к цветным сплавам относятся бронза, латунь, мельхиор, дюралюминий, припой, монель-металл.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 15958
15958

