Бериллий, магний и щелочноземельные металлы.
Сегодня мы познакомимся с элементами II A группы. К ним относятся бериллий, магний, и щелочноземельные элементы: кальций, стронций, барий, радий.

Радий является радиоактивным элементом, в природе его содержание незначительно. Все изотопы радия радиоактивны, а cамый долгоживущий из них – радий 226, имеет период полураспада, равный 1620 лет.

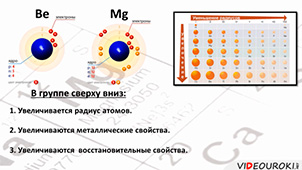
Так как это элементы II A группы, то на внешнем энергетическом уровне у них два электрона. Эти электроны сильно отдалены от ядра, поэтому их легко оторвать, они являются сильными восстановителями. Во всех соединениях они проявляют степень окисления, равную +2.
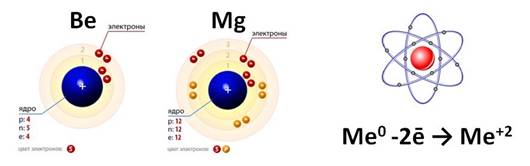
Во II A группе сверху вниз увеличивается радиус атомов, а, следовательно, металлические и восстановительные свойства.
 .
.
Распространённость магния и кальция в земной коре составляет около 1,5%. Содержание бериллия, стронция и бария не превышает 0,01%, а радиоактивный радий является продуктом распада урана и содержится в земной коре в очень малых количествах.

Вследствие высокой химической активности все элементы этой группы в природных условиях встречаются только в виде соединений.
Разберём физические свойства элементов (II) A группы. Простые вещества, образованные элементами этой группы, представляют собой типичные металлы с характерным металлическим блеском. Они представляют собой серебристо-белые металлы, а стронций имеет золотистый оттенок, хорошо проводят теплоту и электрический ток, имеют довольно высокие температуры плавления.
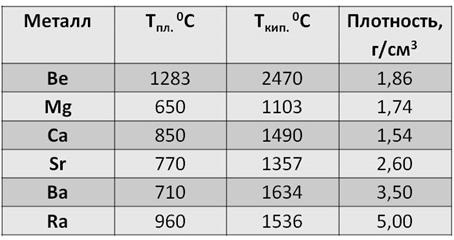
Стронций значительно твёрже бария, а барий по мягкости напоминает свинец. Из приведённой таблицы видно, что плотность металлов увеличивается сверху вниз, температуры кипения и плавления, как правило, понижаются.
Температуры плавления этих металлов гораздо выше, чем у щелочных металлов, у бериллия она превышает 1000 градусов по Цельсию, и он относится к тугоплавким металлам.
Плотность всех металлов этой группы не превышает 5 г/см3, и поэтому они относятся к лёгким.
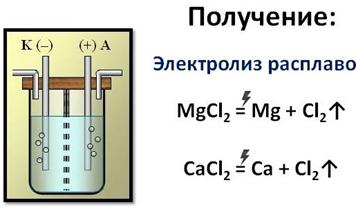
Получают магний и кальций электролизом расплавленных хлоридов.
Что касается металлов II A группы, то они также как и щелочные металлы обладают высокой химической активностью.
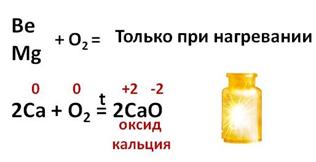
При комнатной температуре к кислороду устойчивы только бериллий и магний, благодаря оксидной плёнке на поверхности. При высокой температуре окисление бериллия и магния кислородом протекает очень интенсивно. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе эти металлы энергично сгорают с образованием оксидов. В реакции кальция с кислородом образуется оксид кальция, кальций повышает свою степень окисления до +2, а кислород понижает степень окисления до -2.
В результате сжигания магния выделяется большое количество света и теплоты, раньше эту реакцию применяли при фотографировании объектов в тёмных помещениях.
В рекцию с азотом при комнатной температуре втупает только радий, остальные металлы реагируют с азотом при нагревании с образованием нитридов. Так, в реакции бария с азотом образуется нитрид бария, барий повышает свою степень окисления до +2, а азот понижает до -3.

В реакцию взаимодействия с галогенами элементы II A группы вступают только при нагревании, при этом образуются соответствующие галогениды. В реакции кальция с хлором образуется хлорид кальция, в реакции бария с бромом образуется бромид бария. Металлы повышают свою степень окисления до +2, а галогены понижают свою степень окисления до -1.

В реакцию с серой металлы вступают тоже только при нагревании с образованием сульфидов. В реакции магния с серой образуется сульфид магния, магний повышает свою степень окисления до +2, а сера понижает степень окисления до -2.

Элементы II A группы реагируют с водородом только при высокой температуре, при этом образуются гидриды. В реакции кальция с водородом образуется гидрид кальция, где степень окисления водорода -1, а у кальция – +2.

С водой же практически не взаимодействует только бериллий, из-за защитной плёнки на его поверхности, магний реагирует с водой медленно, остальные металлы бурно реагируют с водой при обычных условиях. В реакции кальция с водой образуется гидроксид кальция и выделяется водород, в реакции бария с водой образуется гидроксид бария и водород, в реакции стронция с водой образуется гидроксид стронция и водород.
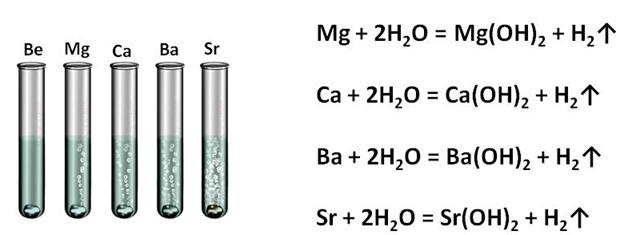
Все металлы II A группы легко растворяются в растворах кислот (серной, хлороводородной, фосфорной и т.д.) с образованием соответствующих солей и водорода. Магний практически нерастворим в плавиковой кислоте из-за малой растворимости его фторида, а бериллий реагирует с азотной кислотой только при нагревании. Остальные металлы активно взаимодействуют с кислотами. В результате взаимодействия кальция с серной кислотой образуется сульфат кальция и водород, в результате взаимодействия магния с соляной кислотой образуется хлорид магния и водород.
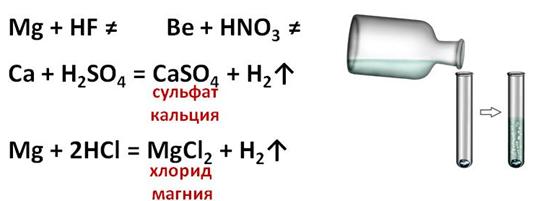
Бериллий, как вы помните, является амфотэрным элементом, поэтому он легко растворяется в водных растворах щелочей. В реакции бериллия с раствором гидроксида натрия образуется комплексная соль –тэтрагидроксобериллат натрия.

Подобно алюминию, магний и кальций способны восстанавливать редкие металлы – ниобий, тантал, молибдэн, вольфрам, титан – из их оксидов. Такие способы получения металлов называют магниетермией и кальциетермией. Магний чаще используют для получения титана, а кальций – для получения ванадия.

Кроме этого, магний можно использовать для вытеснения менее активного металла из раствора соли. Например, в реакции магния с раствором сульфата железа два магний вытесняет железо, как менее активный металл.

В природе щелочноземельные металлы находятся только в виде соединений из-за своей химической активности.
Рассмотрим их оксиды. Их оксиды имеют состав МеО и гидроксиды состава Ме(ОН)2. Основный характер оксидов и гидроксидов увеличивается в этой группе сверху вниз. Т. е. изменяется от амфотэрных, как у оксида бериллия и гидроксида бериллия до основных, как у оксида радия и гидроксида радия.
Амфотерные BeO и Be(OH)2 → основные RaO и Ra(OH)2.
Гидроксиды бериллия и магния нерастворимы в воде, а гидроксиды щелочноземельных металлов и радия являются щелочами.
Оксиды элементов II A представляю собой твёрдые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Оксид магния почти не вступает в реакцию с водой, а оксиды щелочноземельных металлов и радия реагируют с водой, образуя гидроксиды. Например, в результате взаимодействия оксида бария с водой образуется гидроксид бария, а в реакции оксида кальция с водой – гидроксид кальция.

Оксиды щелочноземельных металлов и магния получают обжигом карбонатов: в результате разложения карбоната кальция образуется оксид кальция и оксид углерода четыре, при разложении карбоната магния образуется оксид магния и также оксид углерода (IV).

В технике оксид кальция называют негашёной известью, а оксид магния – жжёной магнэзией (её применяют для изготовления огнеупорных тиглей, труб, кирпичей, он входит в состав зубных порошков). Оба этих оксида используют в производстве строительных материалов. Они представляют собой твёрдые тугоплавкие вещества белого цвета.

Оксиды элементов II A группы легко растворяются в кислотах, а оксид и бериллия, и в растворах щелочей. Например, в реакции оксида магния с соляной кислотой образуется хлорид магния и вода, а оксид бериллия реагирует и с соляной кислотой с образованием соли – хлорида бериллия, и с раствором гидроксида натрия с образованием комплексной соли – тэтрагидроксобериллата натрия.

Гидроксиды щелочноземельных металлов являются щелочами. Их растворимость воде увеличивается в ряду от гидроксида кальция до гидроксида бария. Эти гидроксиды получают взаимодействием соответствующего оксида с водой. Гидроксид кальция получают по реакции оксида кальция с водой, гидроксид стронция по реакции оксида стронция с водой, а гидроксид бария по реакции оксида бария с водой.

Реакция взаимодействия оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся при этом гидроксид кальция – гашёной известью. Тестообразную смесь гашёной извести с песком и водой называют известковым раствором и используют для скрепления кирпичей при кладке стен.
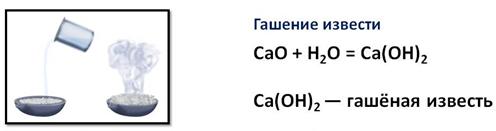
Поглощая из воздуха углекислый газ, гидроксид кальция превращается в карбонат. Происходит постепенное затвердевание (схватывание) смеси.

Прозрачный раствор гидроксида кальция называют известковой водой, а белую взвесь его в воде – известковым молоком.
Гашёную известь используют в строительстве, а известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.

Проведём небольшой эксперимент. Получим гидроксид кальция и исследуем его свойства. Для этого поместим в стаканчик немного оксида кальция, а затем добавим воду и размешаем содержимое стаканчика. У нас получился раствор гидроксида кальция.

Дадим отстояться немного этому мутному раствору, а потом отфильтруем содержимое стаканчика. У нас получился раствор, который гораздо прозрачнее предыдущего.

Разделим его на две пробирки. В первую пробирку будим продувать выдыхаемый воздух, который содержит углекислый газ. В результате у нас раствор мутнеет. Раствор стал мутный, вследствие образования нерастворимой соли – карбоната кальция.
А к раствору во второй пробирке добавим несколько капель фенолфталеина. Раствор окрашивается слегка в малиновый цвет, однако, окраска не такая насыщенная, как в растворах щелочей. Следовательно, раствор гидроксида кальция является малорастворимым основанием.
Гидроксиды элементов II A группы реагируют с кислотами, а гидроксид бериллия – ещё и с основаниями. Гидроксид бария в реакции с соляной кислотой образует соль – хлорид бария и воду. А гидроксид бериллия реагирует с кислотами и с основаниями. В реакции с серной кислотой образуется соль – сульфат бериллия и вода, а в результате реакции гидроксида бериллия с раствором гидроксида натрия образуется комплексная соль – тэтрагидроксобериллат натрия.

Таким образом, соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами.
Соли их представляют собой белые кристаллические вещества, большинство из них растворимы в воде. Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов элементов главной подгруппы II группы уменьшается от сульфата бериллия к сульфату бария. Карбонаты этих металлов малорастворимы или нерастворимы в воде. Сульфиды щелочноземельных металлов, после предварительного освещения начинают светиться различными цветами. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов часов и других изделий.



Рассмотрим наиболее значимые соли.
CaCO3 – карбонат кальция – одно из самых распространённых соединений. Это соединение содержат такие минералы, как мел, мрамор, известняк.




Мрамор – основной материал для скульпторов, архитекторов. Из этого материала изготовлены стены индийского мавзолея Тадж-Махала, облицованы многие станции московского метро, созданы многие скульптуры, такие как скульптура царя Иоанна Грозного.



Без известняка не обходится ни одно строительство. Он и сам является прекрасным строительным материалом, кроме этого он используется как сырьё для получения других материалов: цемента, гашёной и негашёной извести, стекла и т.д.
Природный мел представляет собой остатки раковин древних животных. Мел используют при производстве школьных мелков, зубной пасты, бумаги, резины и побелки.
Карбонат магния – MgCO3 – необходим в производстве стекла, цемента, кирпича, в металлургии.



Сульфат кальция – CaSO4 – встречается в природе в виде минерала гипса. Его используют в строительстве, в медицине для наложения фиксирующих гипсовых поязок, получения слепков, но здесь используют полуводный гипс – алебастр, он при взаимодействии с водой образует двуводный гипс.
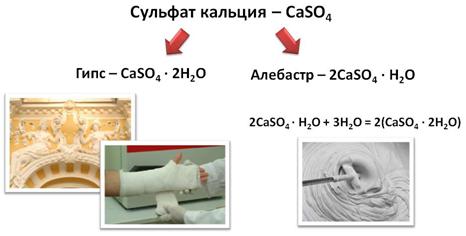
Кристаллогидрат сульфата магния, горькая, или английская соль используется в медицине в качестве слабительного средства. Содержится в морской воде и придаёт ей горький вкус.


Сульфат бария – BaSO4– нерастворимая в воде соль и способная задерживать рентгеновкие лучи, поэтому её используют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта.


Фосфат кальция – Ca3(PO4)2– входит в сотав фофоритов и апатитов, в состав костей и зубов. В организме человека содержится около одного килограмма кальция в виде фосфата кальция.



Вообще, кальций играет большую роль для всех живых организмов, потому что из него построен костный скелет. А также играеь существенную роль в процессах жизнедеятельности: ионы кальция необходимы для работы сердца, участвуют в процессах свёртывания крови.
На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях, который необходим и для работы нервной системы.
Человек должен получать в день 1,5 г кальция. Наибольшее количество кальция содержится в сыре, твороге, петрушке, салате.

Ещё одним важным биоэлементом является магний, который участвует в обмене веществ. Он содержится в печени, костях, крови, нерной ткани и мозге. В организме человека содержится около 40 г магния. Магний входит в сотав хлорофилла, поэтому участвует в процессе фотосинтэза.

Соли щелочноземельных металлов окрашивают пламя в яркие цвета, поэтому их используют как добавки в фейерверки. Кальций окрашивает пламя в кирпично-красный цвет, стронций – в малиновый, барий – в светло-жёлтый.


Магний был получен в 1808 г. Дэви из белой магнэзии – минерала, который нашли вблизи греческого города Магнэзия.

Но полученный таким образом металл был загрязнён примесями, а чистый магний был получен в 1829 г. Бюсси.

Кальций впервые был получен в 1808 г. Дэви. Название было дано от латинского слова кальс, что означает «известь, мягкий камень».

Таким образом, элементы II A группы имеют на внешнем энергетическом уровне два электрона, они являются восстановителями, в соединениях они проявляют степень окисления, равную +2, в группе сверху вниз увеличиваются радиусы атомов, а следовательно восстановительные и металлические свойства. Они обладают высокой химической активностью, поэтому встречаются в природе в виде соединений. Для них характерны такие физические свойства, как металличексий блеск, тепло -и электропроводность, они лёгкие, температуры плавления у них выше, чем у щелочых металлов. Щелочноземельные металлы реагируют с неметаллами, водой, кислотами. Наиболее распространённые их соединения – оксиды, гидроксиды и соли. Оксид бериллия и его гидроксид обладает амфотэрными свойствами, оксид и гидроксид магния – слабыми основными свойствами, у остальных оксидов и гидроксидов ярко выражены основные свойства. Соли этих элементов играют большое значение, такие как карбонат кальция, сульфат магния, фосфат кальция, сульфат бария и другие.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 22605
22605

