Предельные углеводороды – алканы, при обычных условиях достаточно инертны. Для них свойственны реакции замещения атомов водорода и реакции расщепления. Эти реакции требуют жёстких условий: нагревания, действия света, наличия катализаторов. Поэтому алканы ещё называют парафинами, что означает мало сродства.
Для алканов характерны реакции окисления. При полном окислении, например, метана образуется углекислый газ, вода и выделяется большое количество теплоты.
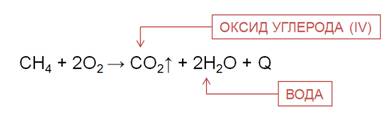
По этой причине метан в составе природного газа используют в качестве топлива в домах, на электростанциях, горючего для машин.
Смеси метана с кислородом (1 : 2 по объёму или воздухом 1 : 10) опасны и приводят к взрывам.
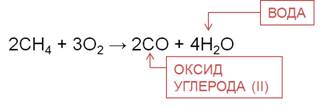
При частичном окислении, например, при недостатке кислорода, образуется оксид углерода (II) и вода.
При частичном окислении бутана в присутствии катализаторов образуется уксусная кислота.
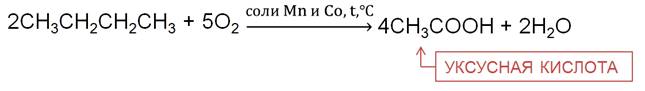
Для алканов свойственны реакции замещения (галогенирования). Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов.
С фтором реакция идёт со взрывом, с йодом алканы не взаимодействуют, а с хлором и бромом в присутствии инициаторов.
В реакции метана с хлором на свету на первой стадии образуется хлорметан. Хлорметан представляет собой газ, легко сжижается, он применяется в холодильных установках.
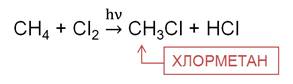
На второй стадии образуется дихлорметан. Это растворитель, его используют для склеивания пластика.
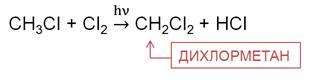
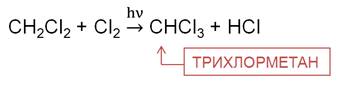
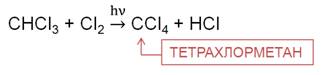
На третьей стадии хлорирования метана образуется трихлорметан. Трихлорметан – бесцветная летучая жидкость с эфирным запахом, используется при производстве фреонового хладагента, в качестве растворителя в фармакологии, для производства красителей и пестицидов.
На четвёртой стадии образуется тетрахлорметан, который применяют как растворитель, а также для получения фреонов, как экстрагент в медицине, тетрахлорметан применялся как наполнитель для переносных огнетушителей в советской бронетехнике.
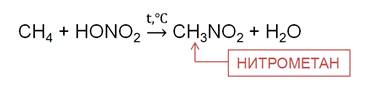
При нагревании алканов до 140 0C с разбавленной (10 %) HNO3 под давлением идёт реакция нитрирования, то есть замещения атома водорода нитрогруппой. Эту реакцию называют ещё реакцией М. Н. Коновалова. В результате реакции метана с азотной кислотой образуется нитрометан.
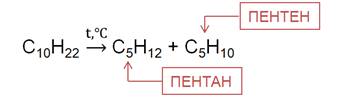
При температуре более 500 0C в присутствии катализаторов алканы подвергаются расщеплению, то есть крекингу. Это приводит к образованию смеси алкенов и алканов.
При
температуре 1000  осуществляется
пиролиз, при этом разрываются все связи.
осуществляется
пиролиз, при этом разрываются все связи.
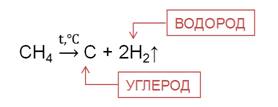
Таким образом, получают технический углерод – пигмент для изготовления типографической краски и наполнителя резины для автомобильных шин.
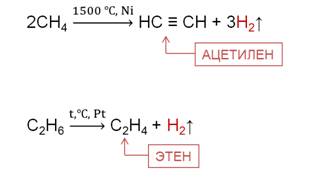
При повышенных температурах алканы образуют, главным образом, непредельные углеводороды. Например, в реакции дегидрирования метана при температуре 1500 0C образуется ацетилен и водород, в реакции дегидрирования этана образуется этен и водород.
Под влиянием катализаторов и при температуре углеводороды нормального строения подвергаются изомеризации с образование углеводородов разветвлённого строения. Так, в присутствии катализатора хлорида алюминия происходит изомеризация бутана с образованием изобутана.
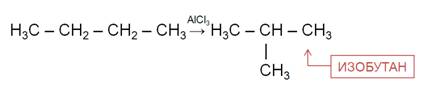
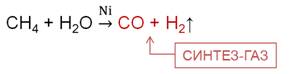
При конверсии метана образуется синтез-газ, который представляет собой смесь угарного газа с водородом.
Рассмотрим получение алканов.
В промышленности насыщенные углеводороды – алканы получают при переработке нефти.
В лаборатории алканы можно получить различными способами. Например, из солей карбоновых кислот при нагревании с твёрдыми щелочами.
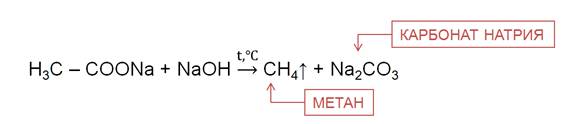
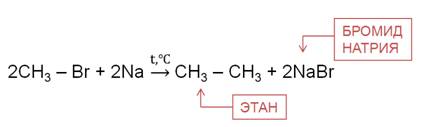
Реакция Вюрца используется для увеличения углеводородной цепи.
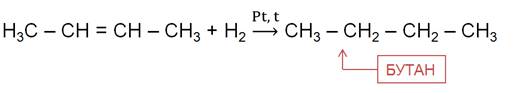
Алканы также можно получить гидрированием ненасыщенных углеводородов.
Алканы имеют широкое применение. Бутан используется для получения бутадиена-1,3, необходимого в производстве синтетического каучука. Метан используется для получения синтез-газа, метанола, ацетилена, как топливо, горючее для двигателей внутреннего сгорания, для получения растворителей.
Таким образом, при облучении светом или при высоких температурах алканы вступают в реакции окисления и замещения. Алканы в промышленности получают из нефти, а в лаборатории реакциями гидрирования ненасыщенных углеводородов, нагреванием солей карбоновых кислот со щелочами, реакцией Вюрца.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 13800
13800