
Основы термодинамики

Внутренняя энергия
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией.
U = Ek + Ep
Кинетическая энергия частиц определяется скоростью, а значит - температурой тела.
Потенциальная - расстоянием между частицами, а значит - объемом.
Следовательно: U=U(T,V) - внутренняя энергия зависит от объема и температуры.

Способы изменения внутренней энергии
Теплопередача
Совершение работы
А
Q
Виды теплопередачи :
- Работа газа - А ꞌ
- Работа внешних сил - А
- теплопроводность
- конвекция
- излучение
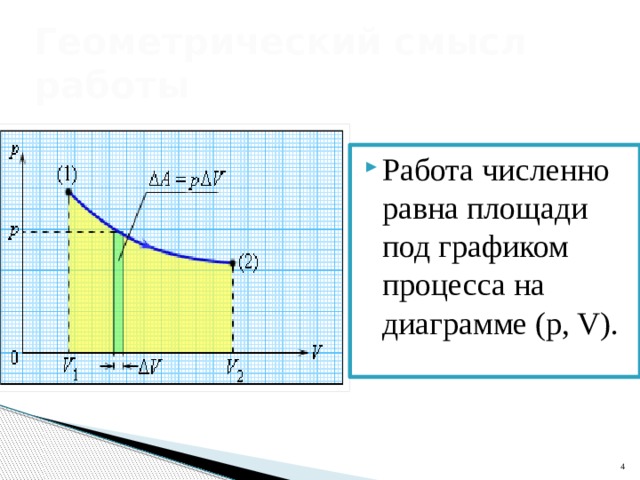
Геометрический смысл работы
- Работа численно равна площади под графиком процесса на диаграмме (p, V).

Количество теплоты

Количество теплоты
- Q = cm(t 0 2 - t 0 1 ) – нагревание (охлаждение)
- Q= m - плавление (кристаллизация)
- Q = rm - парообразование (конденсация)

Первый закон термодинамики
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы

Первый закон термодинамики
Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом
А = - А
 0. Если газ охлаждается, то ΔU" width="640"
0. Если газ охлаждается, то ΔU" width="640"
Применение 1 закона термодинамики к изопроцессам
Изохорный процесс (v=const)
т.к. ΔV=0, то A= 0, значит первый закон термодинамики выглядит так:
Δ U=Q
Газ увеличивает свою внутреннюю энергию за счет теплоты, полученной из внешней среды.
Если газ нагревается, то ΔU 0.
Если газ охлаждается, то ΔU
 0), то А´0. Если газ отдаёт тепло (Q " width="640"
0), то А´0. Если газ отдаёт тепло (Q " width="640"
Применение 1 закона термодинамики к изопроцессам
Изотермический процесс (T=const) т.к. T=const, то ΔU = 0, значит первый закон термодинамики выглядит так:
Q = А´
Если газ получает тепло (Q0), то А´0.
Если газ отдаёт тепло (Q
 0, U0, газ совершает работу, тепло поглощается. Первый закон термодинамики выглядит так : Q = ΔU + А´ " width="640"
0, U0, газ совершает работу, тепло поглощается. Первый закон термодинамики выглядит так : Q = ΔU + А´ " width="640"
Применение 1 закона термодинамики к изопроцессам
Изобарный процесс (р = const)
При изобарном нагревании T0, U0, газ совершает работу, тепло поглощается.
Первый закон термодинамики выглядит так :
Q = ΔU + А´
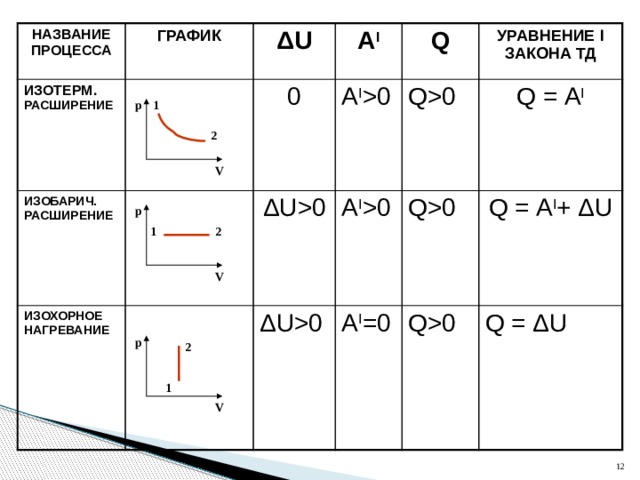 0 А I 0 УРАВНЕНИЕ I ЗАКОНА ТД Q 0 А I 0 ΔU0 Q 0 Q = А I А I =0 Q 0 Q = А I + ΔU Q = ΔU р 1 2 V р 1 2 V р 2 1 V " width="640"
0 А I 0 УРАВНЕНИЕ I ЗАКОНА ТД Q 0 А I 0 ΔU0 Q 0 Q = А I А I =0 Q 0 Q = А I + ΔU Q = ΔU р 1 2 V р 1 2 V р 2 1 V " width="640"
НАЗВАНИЕ ПРОЦЕССА
ГРАФИК
ИЗОТЕРМ. РАСШИРЕНИЕ
ИЗОБАРИЧ. РАСШИРЕНИЕ
ΔU
A I
ИЗОХОРНОЕ НАГРЕВАНИЕ
0
Q
ΔU0
А I 0
УРАВНЕНИЕ I ЗАКОНА ТД
Q 0
А I 0
ΔU0
Q 0
Q = А I
А I =0
Q 0
Q = А I + ΔU
Q = ΔU
р
1
2
V
р
1
2
V
р
2
1
V
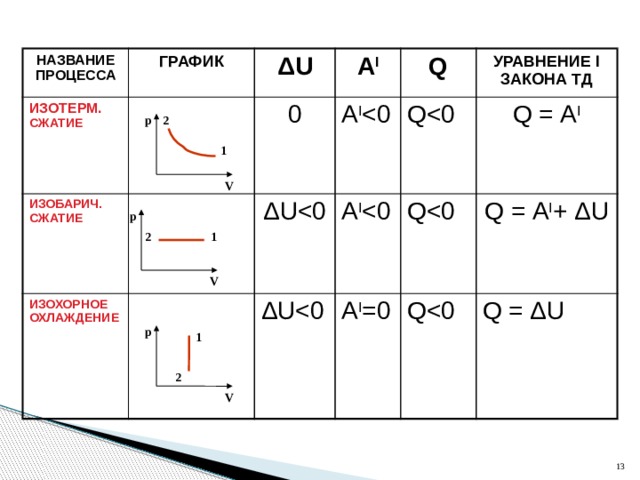
НАЗВАНИЕ ПРОЦЕССА
ГРАФИК
ИЗОТЕРМ. СЖАТИЕ
ΔU
ИЗОБАРИЧ. СЖАТИЕ
0
ИЗОХОРНОЕ ОХЛАЖДЕНИЕ
A I
ΔU
Q
А I
ΔU
А I
Q
УРАВНЕНИЕ I ЗАКОНА ТД
А I =0
Q
Q = А I
Q
Q = А I + ΔU
Q = ΔU
р
2
1
V
р
2
1
V
р
1
2
V
12
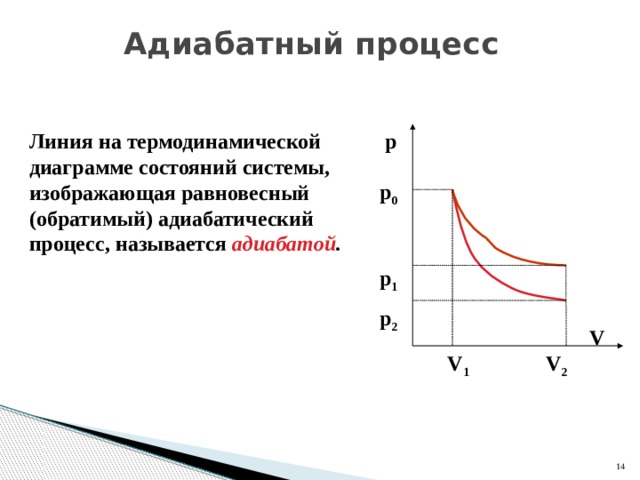
Адиабатный процесс
Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой .
р
р 0
р 1
р 2
V
V 1 V 2
13

Решение задач
- Идеальный газ получил количество теплоты, равное 300 Дж, и совершил работу, равную 100 Дж. Как изменилась внутренняя энергия газа?
- Идеальный газ совершил работу, равную 300 Дж. При этом внутренняя энергия уменьшилась на 300 Дж. Каково значение количества теплоты в этом процессе?
- Идеальный газ совершил работу, равную 600 Дж. При этом его внутренняя энергия увеличилась на 250 Дж. Какое количество теплоты получил газ?

Тепловые двигатели
Тепловые двигатели – это устройства, превращающие внутреннюю энергию топлива в механическую энергию.
14

1
- Паровая машина
- Паровая машина
2
- Паровая турбина
- Паровая турбина
3
- Газовая турбина
- Газовая турбина
4
- Двигатель внутреннего сгорания. Двигатель Дизеля
- Двигатель внутреннего сгорания. Двигатель Дизеля
5
- Реактивный двигатель
- Реактивный двигатель
Виды тепловых двигателей:
14

Домашнее задание
- Выучить определения, формулы по теме
«1 закон термодинамики»;
- Решить задачу:
Идеальный газ получил количество теплоты, равное 540 Дж, и совершил работу,
равную 220 Дж. Как изменилась внутренняя энергия газа?
17

 Получите свидетельство
Получите свидетельство Вход
Вход












 Законы термодинамики. Внутренняя энергия (734.65 KB)
Законы термодинамики. Внутренняя энергия (734.65 KB)
 0
0 691
691 13
13 Нравится
0
Нравится
0



