Водород, его общая характеристика, нахождение в природе, получение, физико-химические свойства и применение.
Цели:
-
Познакомить учащихся с распространенностью, получением и физическими свойствами водорода на основе логического взаимодействия;
-
Учить моделированию понятий и действий;
-
Продолжить формирование умений по составлению уравнений химических реакций, расстановке коэффициентов в уравнениях химических реакциях;
-
Развивать практические умения и навыки в ходе выполнения лабораторных опытов;
-
Учиться заботиться о своем здоровье. Соблюдая правила техники безопасности;
-
Способствовать развитию у школьников интереса к химической науке, к исследовательской деятельности.
Оборудование: прибор для восстановления меди водородом из оксида меди (ll), прибор для получения водорода.
Ход урока.
-
Организационный момент.
-
Изучение нового материала.
-Историческая справка: Водород(в переводе с латыни – «рождающий воду» )открыл в первой половине XVIв. Немецкий врач и естествоиспытатель Парацельс. В 1776г. Английский ученый Г.Кавендиш исследовал его свойства.
-Общая характеристика:
-
Изотопные состояния водорода (Протий. Дейтерий. Тритий)
-
Двойственное положение в ПСХЭ (сходство свойств со щелочными металлами и галогенами)
-
Простое вещество (Н-Н, Н2, Н:Н)
- Нахождение в природе:
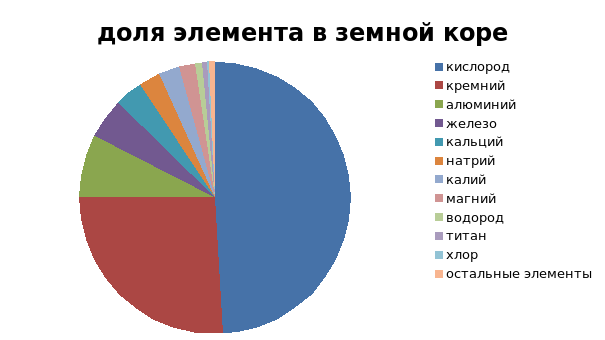
- Получение водорода (лабораторная работа)
Получение водорода взаимодействием цинка и соляной кислоты.
В пробирку опустим 2-3 гранулы цинка и прильем (осторожно!) 3-4 см3 соляной кислоты. На поверхности гранул появляются пузырьки бесцветного газа – это и есть водород.
Zn+2HCl→ZnCl2+H2↑
Физические свойства
Водород является очень легким химическим веществом. По крайней мере, ученые утверждают, что на данный момент, нет легче вещества, чем водород. Его масса в 14,4 раза легче за воздух, плотность составляет 0,0899 г/л при 0°С. При температурах в -259,1°С водород способен плавится – это очень критическая температура, которая не характерна для преобразования большинства химических соединений из одного состояния в другое. Только такой элемент, как гелий, превышает физические свойства водорода в этом плане. Сжижение водорода затруднительно, так как его критическая температура равна (-240°С). Водород – наиболее теплопродный газ из всех, известных человечеству.
Химические свойства водорода
-
Взаимодействие с галогенами. При обычной температуре водород реагирует лишь со фтором:
H2 + F2 = 2HF.
С хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.
-
Взаимодействие с кислородом. При нормальных условиях водород не реагирует с кислородом, при 400 °С реагирует с кислородом, а при 600 °С – с воздухом, при поджигании реакция протекает со взрывом:
2H2 + O2 = 2H2O.
Водород горит в кислороде с выделением большого количества тепла. Температура водородно-кислородного пламени 2800 °С.
-
Взаимодействие с серой. При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S.
-
Взаимодействие с азотом. При нагревании водород обратимо реагирует с азотом, причем при высоком давлении и в присутствии катализатора:
3H2 + N2 = 2NH3.
-
Взаимодействие с оксидом азота (II). Важное значение имеет взаимодействие водорода с оксидом азота (II), используемое в очистительных системах при производстве азотной кислоты:
2NO + 2H2 = N2 + 2H2O.
-
Взаимодействие с оксидами металлов. Водород – хороший восстановитель, он восстанавливает многие металлы из их оксидов:
CuO + H2 = Cu + H2O.
-
Сильным восстановителем является атомарный водород. Он образуется из молекулярного в электрическом разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения , образующийся при восстановлении металла кислотой.
-
Взаимодействие с активными металлами. Водород является окислителем, присоединяет электрон и превращается в гидрид-ион, который заряжен отрицательно.
При высокой температуре водород соединяется с щелочными и щелочно-земельными металлам и образуя белые кристаллические вещества – гидриды металлов:
2Na + H2 = 2NaH;
Ca + H2 = CaH2.
Применение
Водород находит широкое практическое применение. Основные области его промышленного использования известны всем. Более половины водорода идет на переработку нефти. Четверть производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Например, самая мощная ракета «Энергия» использует более 2000 тонн топлива, большую часть которого составляют жидкий водород и кислород.
Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам, необходимые в производстве нитей накаливания электролампочек. Водород также находит применение в производстве маргарина из растительных масел.
Реакцию горения водорода в кислороде применяют и для сварочных работ. Температура водородно-кислородного пламени достигает 3000 °C. Если же использовать специальные горелки, то можно повысить температуру пламени до 4000 °C. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
3. Закрепление.
"Кроссворд"
Работайте в парах.
Ключевым словом является название ближайшей к Земле звезды, на которой преобладает химический элемент водород. Каждое предложенное химическое явление подтвердите соответствующими уравнениями химических реакций.
-
Сложные вещества, при взаимодействии которых с водородом получают металлы.
-
Вещество, которое образуется при горении водорода в кислороде.
-
Кислоты, состоящие из атомов водорода и другого химического элемента.
-
Кислота, которая легко разлагается на оксид углерода (IV) и воду.
-
Металл, непосредственно взаимодействующий с водородом.
-
Кислота, по уровню производства которой можно судить о мощности химической промышленности страны.
4. Домашнее задание.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Водород, его общая характеристика, нахождение в природе, получение, физико-химические свойства и применение. (37.8 KB)
Водород, его общая характеристика, нахождение в природе, получение, физико-химические свойства и применение. (37.8 KB)
 0
0 283
283 3
3 Нравится
0
Нравится
0


