Открытый урок по химии в 11 «Б» классе.
Тема урока: Фенолы.
Образовательные задачи:
изучить состав, строение, свойства фенола и его соединений
на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства
познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы
рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Развивающие задачи:
совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения
продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении химического эксперимента
Воспитательные задачи:
продолжить формирование химической картины мира через химическую картину природы (познаваемость, управление химическими процессами)
расширить представление учащихся о влиянии фенолсодержащих промышленных отходов и строительных материалов на окружающую среду и здоровье человека
рассмотреть биологическую роль фенола и его соединений на организм человека (положительную и отрицательную)
Тип урока: урок - изучения новых знаний.
Методы обучения:
словесный, наглядный, практический (демонстрационный химический эксперимент)
Средства обучения: Компьютер, интерактивная доска, презентация «Фенолы», мультимедиа: «Взаимодействие фенола с гидроксидом натрия», «Взаимодействие фенола с бромной водой», «Взаимодействие фенола с натрием», «Качественная реакция на фенолы»
План урока
1.Организационный момент. Постановка учебных целей.
2.Актуализация знаний
3.Изучение новых знаний
4. Первичное закрепление изученного материала.
5. Рефлексия.
6. Домашнее задание.
Ход урока.
1.Организационный момент.
2. Актуализация знаний.
Какие вещества относят к спиртам?
Какие спирты называются ароматическими?
Как вы думаете, будут ли отличаться химические свойства у соединений, в одном из которых группа -ОН связана непосредственно с бензольным ядром, а в другом через атом углерода?
(Да, согласно одного из положений теории Бутлерова, которое гласит, что свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в молекуле, но и от взаимного влияния атомов и групп атомов друг на друга).Сегодня нам предстоит познакомиться с новым классом- фенолы и на их примере ещё раз рассмотреть данное положение теории А.М.Бутлерова о взаимном влиянии атомов друг на друга.
3. Изучение нового материала.
А) Определение фенолов.
Соединения, в которых ароматический радикал фенил С6Н5- непосредственно связан с гидроксильной группой, называются фенолами.
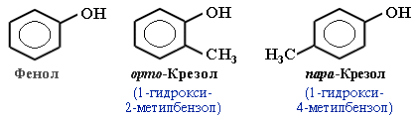
Б) Классификация и изомерия фенолов.
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
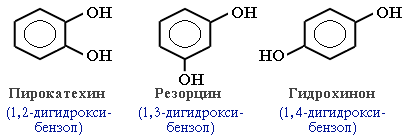
Как видно из приведенных примеров, фенолам свойственна изомерия положения гидроксигруппы.
В) Физические свойства фенола.
Фенол – Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол). У фенола довольно низкие температуры плавления (+40,9) и кипения (+182).
Растворимость фенола в воде ограничена. В холодной воде он мало растворим, но уже при 70˚С растворяется в любых отношениях.
Г) Химические свойства фенола
Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензольного ядра.
а) Рассмотрим реакции фенола по ОН-группе:
2C6H5OH+2Na=2C6H5ONa+H2
(демонстрируется мультимедиа: взаимодействие фенола с натрием)
Влияние бензольного кольца на гидроксогруппу обуславливает большую подвижность её водородного атома, поэтому фенол, в отличие от спиртов, реагирует со щелочами, т.е. обладает свойствами слабых кислот:
2C6H5OH+2NaOH=2C6H5ONa+H2O
Фенол – слабая кислота (карболовая).
(демонстрируется мультимедиа: взаимодействие фенола с гидроксидом натрия)
б) Реакции фенола по бензольному кольцу:
Гидроксильная группа придает атомам водорода бензольного кольца большую подвижность в положениях 2,4,6.
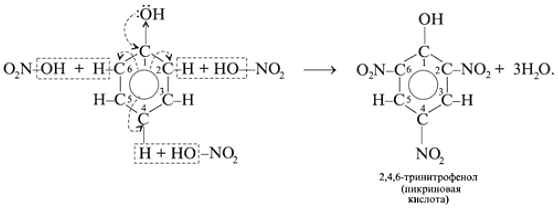
Взаимодействие с азотной кислотой:
Взаимодействие с бромной водой:
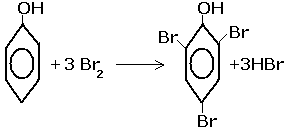
В результате образуется белый осадок 2,4,6-трибромфенола
(демонстрируется мультимедиа: взаимодействие фенола с бромной водой)
Итак, какой вывод о взаимном влиянии атомов в молекуле фенола можно сделать?
Фенильная группа C6 H5 – и гидроксильная группа –ОН взаимно влияют друг на друга.
в) Качественная реакция на фенолы
C6H5OH + FeCl3 — фиолетовое окрашивание
(демонстрируется мультимедиа: качественная реакция на фенол)
Д) Получение фенола
изучите самостоятельно (используя текст учебника)
Е) Физиологическое действие фенола и его применение
(заслушивается сообщение учащегося по теме)
Биологическая роль соединений фенола
| Положительная | Отрицательная (токсическое действие)
|
| лекарственные препараты (пурген, парацетамол) антисептики (3-5 % раствор – карболовая кислота) эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе; карвакрол и тимол в чабреце; эвгенол в гвоздике, базилике) Флавоноиды (способствуют удалению радиоактивных элементов из организма) | фенолформальдегидные смолы пестициды, гербициды, инсектициды загрязнение вод фенольными отходами Фенол весьма ядовит. При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
|
Ж) Применение фенола
(заслушивается сообщение учащегося по теме)
мировое потребление фенола имеет следующую структуру:
44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
остальные 14 % расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор
1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. В животноводстве: дезинфекция животных растворами фенола и его производных.
Первичное закрепление знаний.
Химический диктант.
Если утверждение правильное, то ставьте плюс, если неправильное, то минус.
| 1.Фенолы – это производные спиртов, в молекулах которых есть гидроксильная группа |
- |
| 2.Из фенолов получают фенопласты | + |
| 3.Фенол является тугоплавким веществом | - |
| 4.Формула фенола – С6Н5NH2 | - |
| 5.Фенол при доступе воздуха розовеет | + |
| 6.При взаимодействии фенола со щелочами, получаются феноляты | + |
| 7.Фенол – газообразное вещество, с резким запахом | - |
| 8.Фенол является нефтепродуктом | - |
| 9.Фенол является сильной кислотой | - |
| 10.В химических свойствах фенол проявляет двоякую природу | + |
| 11.Фенол называют карболовой кислотой | + |
| 12.Из фенолов можно получить лекарства и фотореактивы | + |
| 13.Фенол получают только из каменноугольной смолы | - |
| 14.Из фенола получают пикриновую кислоту | + |
| 15.Радикал С 6Н5 называется этилом | - |
| 16.Все фенолы имеют бензольное ядро | + |
| 17.При взамодействии фенола с хлорным железом, появляется синее окрашивание | + |
| 18.Фенол не является антисептиком | - |
| 19.При взаимодействии с бромом, образуется трибромфенол | + |
| 20.Растворимость фенола в воде хорошая | - |
Проверка химического диктанта (взаимопроверка)
Рефлексия. Подведение итогов урока.
Домашнее задание §3.5, упр11 с.181.
Сильным учащимся для подготовки к ЕНТ:
Задача 1. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40%-го раствора гидроксида калия (плотность 1,4 г/мл). При обработке этой смеси натрием выделилось 6,72 л газа (н.у.). Определите массовые доли компонентов в исходной смеси.
Ответ. В смеси 40,7% спирта и 59,3% фенола.
7

 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок по теме "Фенолы" (97.12 KB)
Урок по теме "Фенолы" (97.12 KB)
 0
0 1363
1363 75
75 Нравится
0
Нравится
0


