МИНИСТЕРСТВО ОБРАЗОВАНИЯ И МОЛОДЕЖНОЙ ПОЛИТИКИ СТАВРОПОЛЬСКОГО КРАЯ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КУРСАВСКИЙ РЕГИОНАЛЬНЫЙ КОЛЛЕДЖ «ИНТЕГРАЛ»
Методическая разработка урока по теме:
«Скорость химических реакций. Факторы, влияющие на скорость химической реакции»
Разработчик: О. Е. Клочкова, преподаватель химии
с. Курсавка
Тема урока: «Скорость химических реакций. Факторы, влияющие на скорость химической реакции»
Цель урока
обучающая: сформировать понятия «скорость химических реакций», вывести формулы для вычисления скорости гомогенных и гетерогенных реакций, рассмотреть от каких факторов зависит скорость химических реакций;
развивающая: учить обрабатывать и анализировать экспериментальные данные; уметь выяснять взаимосвязь между скоростью химических реакций и внешними факторами;
воспитательная: продолжить развитие коммуникативных умений в ходе парной и коллективной работы; акцентировать внимание учащихся на важности знаний о скорости химической реакции протекающих в быту (коррозия металла, прокисание молока, гниение и др.)
Средства обучения: мультимедийный проектор, компьютер, слайды по основным вопросам урока, таблицы на столах, протоколы лабораторной работы, лабораторное оборудование и реактивы;
Методы обучения: репродуктивный, исследовательский, частично поисковый;
Форма организации занятий: беседа, практическая работа, самостоятельная работа, тестирование;
Форма организации работы учащихся: фронтальная, индивидуальная, групповая, коллективная.
Продолжительность: 80 минут.
Пояснительная записка.
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, - например при охлаждении, - медленно; при этом различие в скорости одной и той же реакции может быть очень большим.
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
Методические рекомендации к проведению урока.
Уроки-практикумы, помимо решения своей специальной задачи - усиления практической направленности обучения, должны быть не только тесным образом связаны с изученным материалом, но и способствовать прочному, неформальному его усвоению.
Основной формой их проведения являются практические и лабораторные работы, на которых учащиеся самостоятельно упражняются в практическом применении усвоенных теоретических знаний и умений.
Главное их различие состоит в том, что на лабораторных работах доминирующей составляющей является процесс конструктивных умений учащихся. Следует отметить, что учебный эксперимент как метод самостоятельного приобретения знаний учащимися, хотя и имеет сходство с научным экспериментом, вместе с тем отличается от него постановкой цели, уже достигнутой наукой, но неизвестной учащимися.
Различают установочные, иллюстративные, тренировочные, исследовательские, творческие и обобщающие уроки-практикумы. Основным же способом организации деятельности учащихся на практикуме является групповая форма работы.
Средством управления учебной деятельностью учащихся при проведении практикума служит инструкция, которая по определенным правилам последовательно определяет действия ученика.
Структура практикума может изменяться в зависимости от содержания работы, подготовки учащихся и наличия оборудования.
План проведения урока
1. Организационный момент
Взаимное приветствие, проверка отсутствующих, обеспечение эмоционального рабочего настроя учащихся.
2. Основная часть урока
Тема урока «Скорость химических реакций. Факторы, влияющие на скорость химической реакции». (Слайд 1, 2).
Обсудим следующие вопросы (фронтально, слайд 3):
В чем разница между химическими и физическими явлениями?
Что называют химической реакцией?
Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
Как определяют скорость механического движения? Какова единица измерения этой скорости?
Как определяют скорость химической реакции?
Какие условия необходимо создать, чтобы началась химическая реакция?
Рассмотрим два примера (эксперимент проводит учитель).
На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO4. Что мы наблюдаем?
На примерах учащиеся судят о скорости реакций и делают соответствующие выводы. Запись на доске проделанных реакций (двое учащихся).
В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций (два ученика записывают на доске уравнения):
1) CuSO4 + 2КOH = Cu(OH)2 + К2SO4 ; Cu2+ + 2OH- = Cu(OH)2
2) Fe + CuSO4 = FeSO4 + Cu ; Fe0 + Cu2+ = Fe2++ Cu0
Какой вывод по проведённым реакциям мы можем сделать? Почему одна реакция идёт мгновенно, другая медленно? Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
По результатам демонстрированного эксперимента учащиеся делают вывод:
реакция 1 – гомогенная, а реакция 2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
(Слайд 4)
| Скорость реакции определяется изменением количества вещества в единицу времени |
| В единице V (для гомогенной) | На единице поверхности соприкосновения веществ S (для гетерогенной) |
|
 гомоген = гомоген =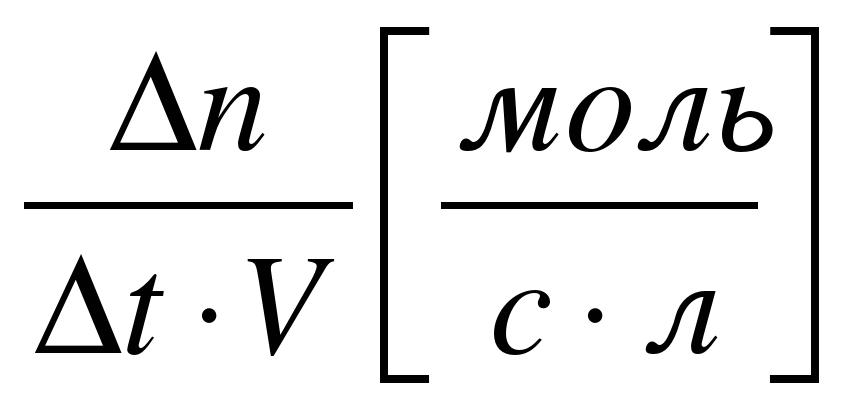
|
 гетерог = гетерог =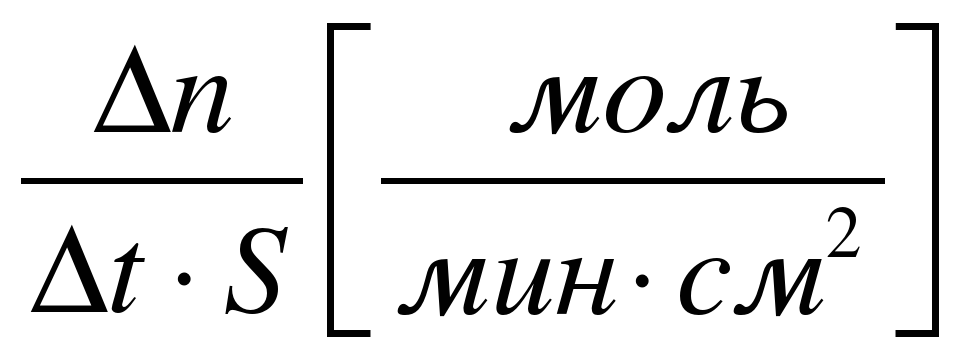
|
| 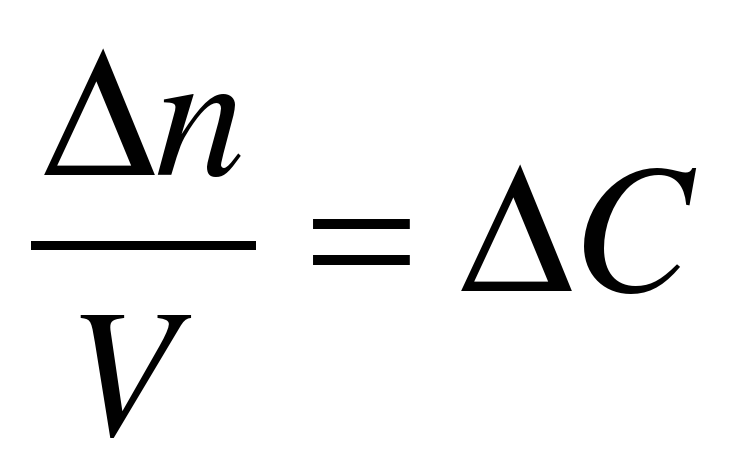 - изменение молярной концентрации; - изменение молярной концентрации; 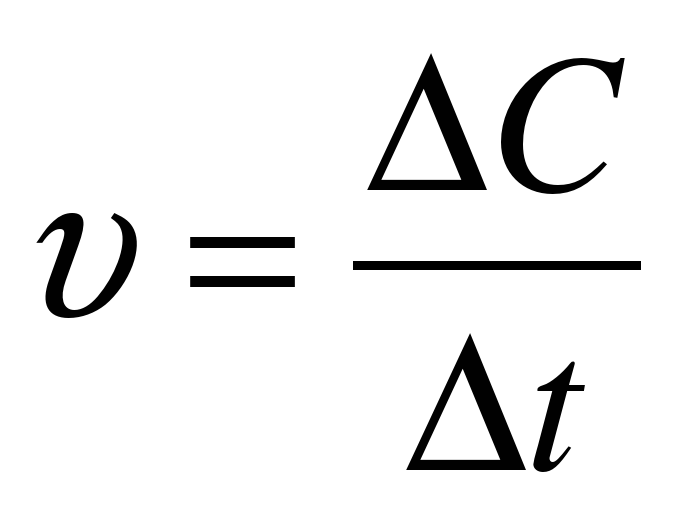
|  n - изменение количества вещества (моль); n - изменение количества вещества (моль);  t– интервал времени (с, мин) t– интервал времени (с, мин) |
Очевидно, что при таком определении величина скорости реакции не зависит от объёма в гомогенной системе.
Активные действия учащихся с объектом изучения. Занесение таблицы в тетрадь.
Из этого следуют два важных момента (слайд 5):
По приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания);
Рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н2 +О2 = 2Н2О: υ (по Н2) = 2 υ (по О2) = υ (по Н2О)
3. Проведение лабораторной работы в ходе повторения и изучения нового материала, поэтапно (
приложение 1).
Нам известно, что на скорость химической реакции влияют разные факторы. Какие?
(слайд 6):
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Влияние всех перечисленных факторов на скорость реакции можно объяснить, используя простую теорию – теорию столкновений (слайд 7). Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Отсюда можно сделать выводы:
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Осмысливание понятия и запись определения в тетрадь.
Таким образом, на пути всех частиц, вступающих в реакцию, имеется некоторый энергетический барьер, равный энергии активации. Если он маленький, то находится много частиц, которые успешно его преодолевают. При большом энергетическом барьере необходима дополнительная энергия для его преодоления, иногда достаточно хорошего «толчка». Я зажигаю спиртовку – я сообщаю дополнительную энергию Еа, необходимую для преодоления энергетического барьера в реакции взаимодействия молекул спирта с молекулами кислорода.
Рассмотрим факторы, которые влияют на скорость реакции.
1. Природа реагирующих веществ (слайд 8). Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Рассмотрим таблицу (приложение 2, на столах), зависимости скорости реакции от природы реагирующих веществ.
Проводим опыт 1 из лабораторной работы (приложение 1), оформляем результаты в отчёте.
2. Температура (слайд 9). Учащиеся знают, что в большинстве случаев при повышении t скорость реакции увеличивается.
Учитель просит объяснить эту закономерность на основе теории столкновений.
Два предположения:
- частицы реагирующих веществ начинают интенсивнее двигаться и чаще сталкиваться;
- удачных, эффективных соударений становится больше, так как увеличивается доля «активных» частиц (энергия которых достаточна для преодоления энергетического барьера).
Учитель отмечает, что учащиеся рассуждают правильно, но всё-таки большее значение имеет второй фактор, так как расчёты показывают, что при увеличении температуры на каждые 100С общее число столкновений увеличивается только на 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%)!
Последнее заключение на основе экспериментальных исследований сделал в прошлом веке голландский физикохимик Я. Вант-Гофф (первый нобелевский лауреат по химии).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 100С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
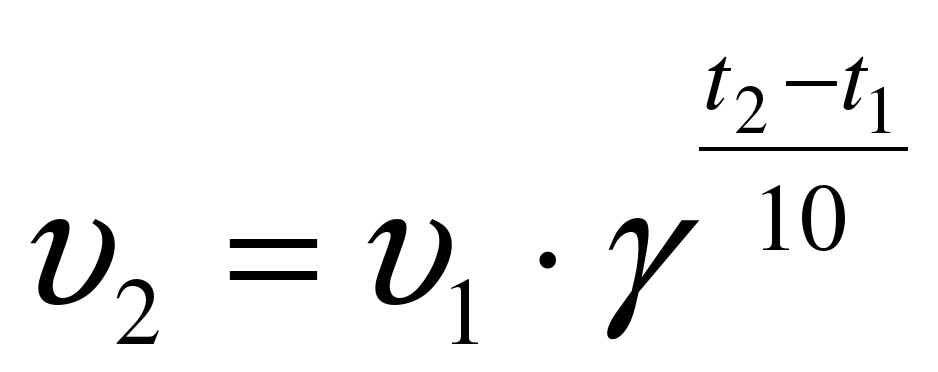 , где
, где 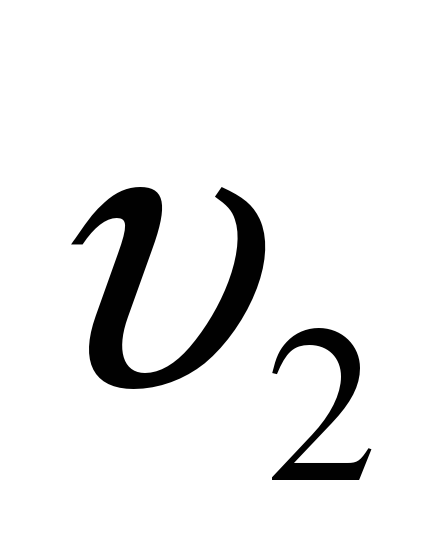 –скорость реакции при температуре t2,
–скорость реакции при температуре t2, 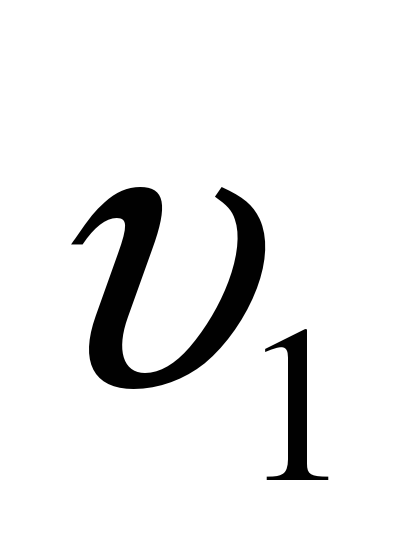 – скорость реакции при температуре t1,
– скорость реакции при температуре t1, 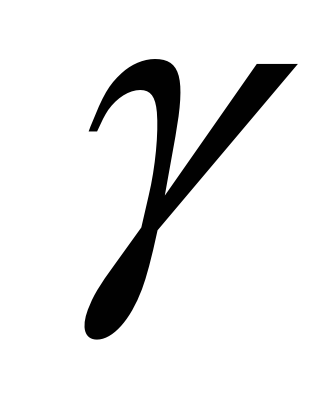 – температурный коэффициент.
– температурный коэффициент.
Решим задачу с использованием правила Вант – Гоффа.
Проведение опыта № 2 из практической работы.
Концентрации реагирующих веществ (слайд 10).
Известно, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. Дайте этому объяснение.
Ответ. Непременным условием химического взаимодействия является столкновение частиц исходных веществ, чем больше концентрация, тем больше число столкновений, а среди них и эффективных соударений.
Уточняем. Термин «концентрация» обычно используется по отношению к растворам, но его можно применить и к газам. В этом случае о концентрации судят по давлению газов.
Проведение опыта 3 из практической работы. Выводы.
На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют законом действующих масс (слайд 11).
По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле: v1= k1CACB, а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v2= k2CACB2. В этих формулах: CA и CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции. Эти формулы также называют кинетическими уравнениями.
Константа скорости реакции, конечно, зависит от температуры, ведь чем больше температура, тем больше скорость реакции при тех же самых концентрациях реагирующих веществ. Закон действующих масс учитывает лишь концентрации газообразных или растворённых веществ и не учитывает концентрации твёрдых веществ (так как они считаются постоянными).
4. Действие катализаторов (слайд 12).
1.Что такое катализатор и каталитические реакции?
2. Приведите примеры известных вам каталитических реакций из органической и неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?
Ответы.
Вещества, влияющие на скорость реакции, но сами при этом не расходующиеся называются катализаторами.
Реакции, протекающие в присутствии катализаторов, называют каталитическими.
В большинстве случаев действие катализаторов объясняется тем, что они снижают энергию активации. В присутствии катализаторов реакция проходит через промежуточные стадии, причем эти стадии энергетически более доступны.
Реагенты и катализатор могут находиться в одном агрегатном состоянии, тогда говорят, что речь идет о гомогенном катализе. Например, ферментно-каталитические реакции в клетках организма проходят в водном растворе. Напротив, во многих важных промышленных процессах используется гетерогенный катализ, при котором реагенты и катализатор находятся в разных агрегатных состояниях. Обычно это смесь жидкости или газов, реагирующих в присутствии твердого катализатора.
Демонстрация коллекции катализаторов (активированный уголь, железо, медь, оксид марганца IV, оксид хрома III, хлорид алюминия, сульфат меди II, вода, дрожжи и др.)
Уточняем третье задание. Катализатор доставляет реагирующим частицам необходимую энергию для эффективных соударений. Но в этом случае тепловые эффекты катализируемой реакции и той же реакции без участия катализатора отличались бы, но они одинаковые. Катализатор снижает необходимую для реакции энергию активации, предоставляя реагентам альтернативный путь разрушения и образования связей. Тогда большая часть молекул реагирующих веществ сможет преодолеть энергетический барьер и образовать продукты - реакция пойдет быстрее.
Существуют катализаторы - ферменты. Об их эффективности можно судить на основании таблицы (слайд 20).
| Катализатор | Еа кДж/моль | Относительная скорость реакции при 300 К |
| Без катализатора | 70 | 1 |
| Pt (гетерогенный катализ) | 45 | 2104 |
| Ионы Fe2+ (гомогенный катализ) | 42 | 8104 |
| Фермент каталаза | 7 | 9×1010 |
Учащиеся проводят эксперимент по действию катализатора на скорость химической реакции, оформляют протокол, делают выводы.
Каталитические явления широко распространены в природе: дыхание, усвоение питательных веществ клетками, синтез белков и др.- это процессы, регулируемые биологическими катализаторами - ферментами. Каталитические процессы - основа жизни в той форме, которая существует на земле.
Кроме катализаторов ускоряющих реакции, есть другие вещества противоположного действия. Это ингибиторы, они реагируют с активными частицами с образованием малоактивных соединений, а потому замедляют протекание реакций. И такие вещества тоже нужны, чтобы предотвращать нежелательные процессы.
5.Поверхность соприкосновения реагирующих веществ (слайд 21).
- В каком случае следует обсуждать этот фактор, влияющий на скорость реакции?
Предположительный ответ. Этот фактор, очевидно, связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций:
С(т)+О2(г)=СО2; Zn(т)+2HCI(ж) ZnCI2+H2
Вспоминаем формулу для вычисления средней скорости гетерогенной реакции:
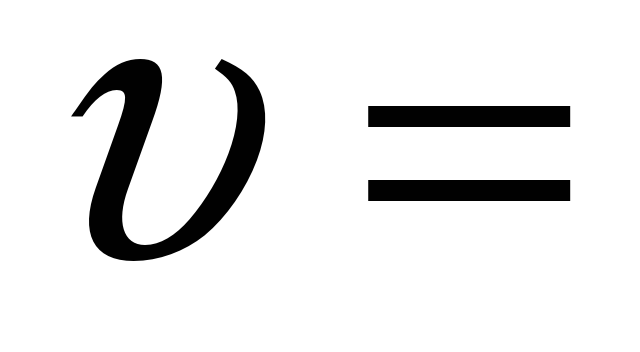
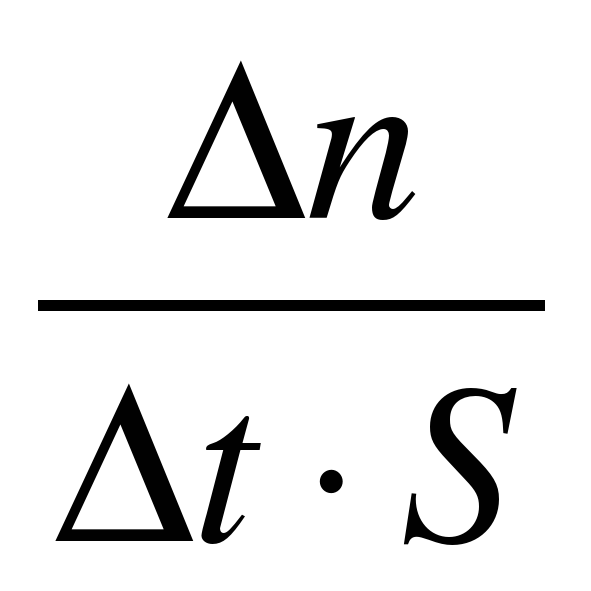
При таком определении величина скорости гетерогенной реакции не зависит от площади этой поверхности, т.е. степени измельчения. Такая формула удобна в научных целях при изучении скорости реакции.
Проведение лабораторного опыта № 5 обсуждение наблюдений, выводы.
Есть и другие причины, способствующие изменению скорости реакций в гетерогенных процессах (помимо площади соприкосновения реагентов):
большая реакционная способность частиц на поверхности образующихся при измельчении кристаллов;
подвод реагентов и отвод продуктов из зоны реакции (свинец практически не взаимодействует с серной кислотой, так как этому мешает продукт реакции – нерастворимый сульфат свинца II, костёр горит интенсивнее, если есть ветерок).
4. Подведение итогов лабораторной работы
Приводим рабочие места в порядок и продолжим урок.
Обсудим выводы, к которым вы пришли, наблюдая за протеканием реакций.
(В протокол работы заложена цель выполнения каждого пункта, поэтому формулировка выводов не вызывает затруднений)
Учащиеся четко формулируют выводы.
5. Контроль и самопроверка знаний.
Цель: проверить качество усвоения учебного материала.
Для закрепления рассмотренного материала решим расчетные задачи.
Задача 1. (слайд).
Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
б) концентрацию вещества В через 20 мин.
Задача 2 (слайд):
Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10 до 500С; б) при понижении температуры от 100 – 00 С. Температурный коэффициент реакции равен 3.
Задание 3. Составьте кинетические уравнения для следующих реакций:
А) H2+I2=2HI; Б) 2 Fe + 3CI2= 2 FeCI3.
Задание 4.
Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA 2CB, если А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию обоих веществ увеличить в 2 раза.
Все основные выводы (слайд), которые были сделаны на уроке.
6. Подведение итогов занятия, выставление и комментирование оценок за работу на уроке. 7. Домашнее задание.
Составить обобщающую таблицу. (Приложение 3).


 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок химии по теме "Скорость химической реакции" (0.1 MB)
Урок химии по теме "Скорость химической реакции" (0.1 MB)
 1
1 1163
1163 108
108 Нравится
0
Нравится
0


