Автор работы: Мищик Татьяна Евгеньевна, учитель первой
квалификационной категории, МБОУ «Октябрьская
средняя общеобразовательная школа» Томского
района
Урок закрепление по теме:
«Скорость химических реакций» Решение задач
Цель урока: закрепить знания по теме, проверить степень усвоения
материала;
развивать интерес к предмету, логическое мышление при
решение задач и рассуждение, умение работать коллективно,
реализуя межпредметные связи курсов математике и химии;
нравственные качества обучающихся, аккуратность в
записях, воспитывать потребность в познавательной
деятельности.
Тип урока: закрепление изученного материала
Методы: проблемный урок
Форма работы: самостоятельная, индивидуальная.
Ход урока
Организационный момент
Вступительное слово учителя
Девиз нашего урока таков: Химик требуется не такой, который только
из одного чтения книг понял сию науку, но
который собственным искусством в ней
прилежно упражнялся.
Эти слова девиза нашего урока принадлежат великому русскому ученому, химику, фамилию которого вам предстоит разгадать, решив правильно задачи и ответить на основные вопросы по теме «Скорость химических реакций».
Фамилию ученого нам с вами нужно разгадать и раскрыть эти буквы, которые вы видите на доске.












Актуализация знаний
а) Фронтальный опрос. Повторение основных понятий (устно)
Что изучает химическая кинетика?
Что такое скорость химических реакций?
В каких единицах измеряется скорость реакций?
От каких факторов зависит скорость химических реакций?
Что понимают под природой вещества7
Как скорость химических реакций зависит от концентрации реагирующих веществ?
Какое уравнение называется кинетическим?
Концентрации, каких веществ, входит в кинетическое уравнение?
Почему скорость химических реакций возрастает с увеличением концентрации реагирующих веществ?
Как изменяется скорость химических реакций с увеличением температуры?
Почему увеличение температуры способствует увеличению скорости реакции?
Что называется катализатором?
Что такое каталитический яд?
Какая зависимость между скоростью химической реакции и временем ее протекания?
б) Для решения задач по теме необходимо вспомнить формулы (формулы записываются на доске учениками)
1) υ=-+ �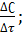 � 2) �
� 2) � � = �
� = �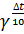 � 3) �
� 3) �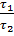 � = �
� = � �.
�.
в) обучающимся предлагается решать самостоятельную работу по карточкам. В карточках предложены задачи различной сложности. (Приложение 1)
В классе выбираются два обучающихся – консультанты, в помощь тем, кто самостоятельно затрудняется в выполнении заданий.
Так же на столе расположены – бонусные задачи для тех учащихся, которые решат задачи первыми. (Приложение 2)
После решения задач, отгаданные буквы фамилии ученого открываются учащимися.
М
В
Л о м о н о с о в








Итог урока:
Учитель: Нам с вами удалось разгадать фамилию великого русского ученого – Михаила Васильевич Ломоносов.
Рефлексия урока: В конце урока обучающимся предлагается закончить
предложения:
было непросто ….
я добился ……
у меня получилось…….
хотелось бы………..
я попробую ……
Домашнее задание: подготовить сообщение о жизни и деятельности великого русского ученого М.В. Ломоносова.
Приложение 1.
Задачи
1.Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз?
(ответ: на 30° , буква В)
2.В результате реакции между оксидом азота (II) и кислородом в течении 16 с в сосуде объемом 3 л образовалось 27,6 г оксида азота (IV). Вычислить среднюю скорость реакции.
2NO + � � → 2 N�
� → 2 N� �
�
(ответ 0,0125 моль/л с, буква – Н)
3.Как измениться скорость химической реакции
CO® + 2 � �(r) = C�
�(r) = C� �OH (ж)
�OH (ж)
при понижении концентрации исходных веществ в 4 раза?
(ответ: скорость химической реакции уменьшается в 64 раза, буква С)
4.Чему равен температурный коэффициент реакции, если при повышении температуры на 50°, а ее скорость увеличивается в 32 раза?
(ответ: ɤ = 2, буква М)
5. В сосуде емкостью 2 л смешали по 2 моль газов A и B. Через 25 с в сосуде осталось 0,5 моль не прореагировавшего газа A. Вычислить среднюю скорость реакции.
(ответ: υ = 0,03 моль/ л с, буква М)
Во сколько раз изменится скорость реакции, уравнение которой
2S � � + �
� + � � 2S�
� 2S� �, при повышении давления в системе в 3 раза7
�, при повышении давления в системе в 3 раза7
(ответ: υ увеличится в 27 раз, буква О)
6. При 30° реакция протекает за 5 мин 45 с. За какое время будет протекать эта реакция при повышения температуры до 50°С, если температурный коэффициент равен 3?
(ответ: 38,3 с, буква В)
7. Реакция протекает по уравнению С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при
2NO+ � � 2 N�
� 2 N� �
�
Начальные концентрации реагирующих веществ были
CNO = 0,8 моль/л, C� � = 0,6 моль/л. Как изменится скорость реакции, если концентрацию �
� = 0,6 моль/л. Как изменится скорость реакции, если концентрацию � � увеличить до 0,9 моль/ л, а концентрацию оксида азота (NO) увеличить до 1,2 моль/л.
� увеличить до 0,9 моль/ л, а концентрацию оксида азота (NO) увеличить до 1,2 моль/л.
(ответ: скорость химической реакции возрастает примерно в 3,4 раза, буква О)
8. В начальный момент протекания реакции � � + 3�
� + 3� �2N�
�2N� �
�
концентрации были равны: C� �= 1,5 моль/л, C�
�= 1,5 моль/л, C� � = 2,5 моль/л, CN�
� = 2,5 моль/л, CN� �= 0. Какова концентрации азота т водорода при концентрации аммиака 0,5 моль/л?
�= 0. Какова концентрации азота т водорода при концентрации аммиака 0,5 моль/л?
(ответ: � �= 1,25 моль/л, �
�= 1,25 моль/л, � � = 2,75 моль/л, буква О)
� = 2,75 моль/л, буква О)
9. В реактор объемом 3 л поместили 8 моль водорода и 6 моль брома (� �). Через 3 мин осталось 1,2 моль не прореагировавшего брома. Вычислить среднюю скорость реакции.
�). Через 3 мин осталось 1,2 моль не прореагировавшего брома. Вычислить среднюю скорость реакции.
� � + �
� + � �→ 2HBr
�→ 2HBr
� � скорость приблизительно будет 0,009 моль/ лс, буква О)
� скорость приблизительно будет 0,009 моль/ лс, буква О)
10. При 20°С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 0° С? Температурный коэффициент скорости реакции равен 2.
(ответ: � � = 8 мин, буква Л)
� = 8 мин, буква Л)
Приложение 2
Бонусные задачи
1.При увеличении температуры на 60°С скорость реакции возрастает в 64 раза. Чему равен температурный коэффициент скорости?
2.Растворение образца цинка в соляной кислоте при 20°С заканчивается через 27 мин, а при температуре 40°С такой же образец металла растворяется за 3 мин. За какое время растворится при 60°С?
3.В течение одинакового промежутка времени в одной реакции образовалось 21,9 г хлороводорода (HCl), а в другой 53,9 г серной кислоты. Определите, какая из реакций протекала с большей скоростью, учитывая, что они проводились в сосудах одинакового объема?
4.Определите, как изменится скорость химической реакции
� � (тв) + 3CO® = 2Fe 9тв) + 3 C �
� (тв) + 3CO® = 2Fe 9тв) + 3 C � � (г) при повышении концентрации исходных веществ в 5 раз?
� (г) при повышении концентрации исходных веществ в 5 раз?
5.В сосуде объемом 2 л смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А+ В = С. Через 20 с в системе образовался газ С количеством вещества 2 моль. Найти среднюю скорость реакции. Какие количества вещества не прореагировавших газов А и В остались в системе?
Литература:
1. Н.Е. Кузьменко, В.В. Еременко 2400 задач для школьников и поступающих в вузы, М: Дрофа, 1999 г., с. 560.
2. Л.М. Романцева, З. Л.Лещинская, В.А. Суханова Сборник задач и упражнений по общей химии, М: Высшая школа, 1991 г., с. 147

 Получите свидетельство
Получите свидетельство Вход
Вход
















 Скорость химических реакций (0.3 MB)
Скорость химических реакций (0.3 MB)
 0
0 1085
1085 36
36 Нравится
0
Нравится
0





