Министерство образования Республики Башкортостан
Государственное автономное образовательное учреждение
среднего профессионального образования
Башкирский архитектурно-строительный колледж


Методическая разработка урока
Окислительно-восстановительные реакции
2013
Содержание
|
| Введение Методическая карта занятия | 3 4 | | Технологическая схема занятия | 6 | | Сценарий урока | 7 | | Литература | 14 | | Приложения | 15 |
|
|
Введение
Изменения, которые происходят в современном обществе, требуют корректировки методических и технологических аспектов образования. Задачей преподавателя является формирование у студентов способности к творческому мышлению, самостоятельности в принятии решений, инициативности, формирование способности добывать и применять знания. Этим обусловлено использование методов и технологий на основе проектно-исследовательской деятельности студентов.
Под проектом понимается самостоятельная, творческая, завершенная работа, выполненная студентом или группой студентов под руководством или при консультации преподавателя. Непременным условием проектной деятельности является:
 четкое представление о конечном продукте деятельности (задачи, цели проекта)
четкое представление о конечном продукте деятельности (задачи, цели проекта)
 выделение основных этапов проектирования (выявление и исследование проблемы, обобщение)
выделение основных этапов проектирования (выявление и исследование проблемы, обобщение)
 реализация проекта (оформление, защита, анализ проекта)
реализация проекта (оформление, защита, анализ проекта)
Проектное обучение не является прямым и здесь важны не только результаты, но и еще в большей степени сам процесс.
Тема «Окислительно-восстановительные реакции» достаточно многогранна. При изучении материала по данной теме есть возможность создания проблемных ситуаций.
Методическая карта урока
Предмет Химия
Тема урока Окислительно-восстановительные реакции
Преподаватель Н.А. Уразметова
Тип урока Освоение нового материала
Организация деятельности на уроке:
групповая
самостоятельная
практическая
Цели урока:
Образовательные:
Развивающие:
развитие конструктивно-технических умений творчески подходить к решению задач, анализировать условия, делать обобщения;
развитие умений демонстрации опытов, пользования реактивами и приборами;
развитие умений работы в коллективе;
развитие речи и культуры публичного выступления.
Воспитательные:
воспитание диалектико-материалистического мировоззрения;
воспитание коллективизма, формирование чувства ответственности;
воспитание стремления к творчеству.
Методы обучения:
проблемно-поисковый
проектный
исследовательский
Обеспечение урока:
информационные листы занятия
реактивы и приборы для демонстрации опытов
мультимедийное сопровождение
Межпредметные связи:
биология (фотосинтез, дыхание)
физика (энергия светового потока)
строительные дисциплины (примеры окислительно-восстановительных реакций в строительстве)
философия (закон единства и борьбы противоположностей)
экология (влияние кислотности среды на живые организмы, автотрофные организмы)
Приемы повышения внимания и интереса студентов к изучаемой теме
создание проблемной ситуации
демонстрация опытов
выполнение и защита исследовательского проекта
построение опорной схемы занятия
мультимедийное сопровождение
Самостоятельная работа студентов на уроке:
решение проблемных вопросов
запись основных понятий
ответы на поставленные вопросы
выполнение исследовательского проекта
защита исследовательского проекта
Содержание и последовательность излагаемых учебных вопросов
| Организационный момент | 1 |
| Этап 1 Ориентировочно-мотивационный | 4 1 3 |
| Этап 2 Усвоение новых знаний | 13 5 3
5 |
| Этап 3 Операционно-исполнительский выполнение исследовательской работы защита исследовательской работы оценка исследовательской работы | 23 6 15 3 |
| Этап 4 Рефлексивно-оценочный | 3 2 |
| | 1 |
Технологическая схема урока Тема Межпредметные связи
 Окислительно-восстановительные реакции | 
| Биология, физика, строительные дисциплины, философия, экология |
Тип урока
|  Усвоение нового материала Усвоение нового материала
|
Формы организации познавательной деятельности
| групповая, практическая, самостоятельная |

Цели
| Образовательные: |
| Развивающие: развитие конструктивно-технических умений творчески подходить к решению задач, анализировать условия, делать обобщения;  развитие умений демонстрации опытов, пользования реактивами и приборами; развитие умений работы в коллективе; развитие речи и культуры публичного выступления.
|
| Воспитательные: воспитание диалектико-материалистического мировоззрения; воспитание коллективизма, формирование чувства ответственности; воспитание стремления к творчеству. |
Методы
|   проблемно-поисковый проблемно-поисковый
|
|  проектный |
| исследовательский |
Оборудование, наглядные пособия, раздаточный материал
Знания, умения
| Уметь | 
| Знать |
Сценарий урока
Видеофрагмент
Преподаватель: Они сошлись, Волна и камень,
Стихи и проза, лёд и пламень…
Писал А.С. Пушкин о Ленском и Онегине. А в жизни - Да и Нет, Миг и Вечность, молодость – старость, мудрость – глупость. Это противоположности из которых состоит наш мир. Мы обычно считаем, что на определённый вопрос есть один верный ответ. Но почему - один? Иногда решением уравнений в математике могут быть два противоположных числа (например, 10 и -10). Противоположности являются верными ответами к одному вопросу! Может быть и в жизни есть пары верных ответов? А мы выбираем один.
?

С какими противоположностями Вы сталкивались в жизни?
Студенты: добро и зло
белое и черное
плюс и минус, четное нечетное
притяжение и отталкивание

наследственность и изменчивость
?
А есть ли противоположности в химии?
Студенты: катион и анион,
кислоты и основания,
металлы и неметаллы
Преподаватель: Сегодня мы с Вами поговорим о противоположных химических процессах – окисление и восстановление, которые объединяются окислительно-восстановительными реакциями. А заодно попытаемся разобраться зачем нужны противоположности в нашей жизни. Тема нашего урока «Окислительно-восстановительные реакции». Цель: Доказать на примере окислительно-восстановительных процессов необходимость существования закона единства и борьбы противоположностей. А начнем мы еще с одной химической противоположности – металлы и неметаллы. 

Чем они отличаются?
Студенты: строением атома, количеством электронов на внешнем уровне и т.д.

Почему металлы отдают электроны, а неметаллы принимают?
Студенты: у металлов на внешнем уровне 1, 2, 3 электрона и им проще отдать электроны, чтобы иметь завершенный слой. У неметаллов электронов много и им проще принять электроны, чтобы завершить слой. 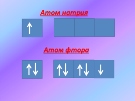
Преподаватель: Все в этом мире стремится к совершенству, к гармонии и атомы химических элементов не являются исключением. К совершенству они стремятся с помощью двух противоположных процессов: приобретения или отдачи электронов.
Какая величина показывает смещение электронов?
Студенты: степень окисления – это условный заряд, который показывает смещение электронов.
Преподаватель: А теперь попробуем выяснить, что происходит со степенью окисления во время реакций. Исследуем реакцию разложение дихромата аммония
(NH4)2Cr2O7 =N2 ↑+Cr2O3+4H2O
Перед вами уравнения проведенных реакций. Теперь давайте определим степени окисления всех элементов, участвующих в реакциях.
(N-3 H4+1 )2Cr2+6 O7-2 =N20 ↑+Cr2+3 O3-2 +4H2+1 O-2
Что происходит со степенью окисления атомов?
Студенты: атомы меняют степень окисления.
Преподаватель: именно такие реакции называют окислительно-восстановительными. Теперь вспомним, как расставить коэффициенты методом электронного баланса.
Студенты расставляют коэффициенты
(N-3H4+1 )2 Cr2+6 O7-2 =N20 ↑+Cr2+3 O3-2 +4H2+1 O-2

 N-3 -3ē → N0 1 восстановитель, окисление
N-3 -3ē → N0 1 восстановитель, окисление
3
Cr+6 +3ē → Cr+3 1 окислитель, восстановление
Преподаватель: Если вы потеряли что-либо, какое настроение – грустное, кислое – окисление. А когда вы нашли пропажу, настроение восстановилось – восстановление. Тот, кто помог восстановить настроение, - восстановитель. А теперь посмотрим как могут проходить окислительно-восстановительные реакции.
Опыт: насыпают в форме конуса горку из оранжевого порошка дихромата аммония и поджигают горящей спичкой ее верхушку. Происходит медленное сгорание вещества наподобие извержения вулкана с выбрасываем в из верхней части снопа искр и пепла. После окончания опыта на месте небольшой оранжевой кучки дихромата аммония образуется большая рыхлая масса темно-зеленого оксида хрома.

Что вам напоминает этот опыт?
Студенты: Вулкан
Преподаватель: Конечно, это не настоящий вулкан, но при извержении настоящих вулканов тоже происходят овр
Вулкан видео
Преподаватель: Извержение вулкана это очень впечатляющее зрелище. Наблюдать за ним и интересно и в то же время страшно. Стихия природы! Но не все природные процессы таковы. Посмотрите на стол. А рядом стоит подсказка.
На столе стоит волшебный чемоданчик с чудо-веществом – вытяжкой хлорофилла. Рядом находится комнатное растение.
А кто знает что стоит в этом чудо-ящике?
Студенты: Хлорофилл

Как Вы думаете, почему на нашем сегодняшнем занятии мы вспомнили о хлорофилле?
Студенты: хлорофилл участвует в окислительно-восстановительной реакции
Преподаватель: Чарльз Дарвин говорил, что хлорофилл представляет собой «одно из интереснейших веществ на земной поверхности», так как благодаря ему возможен синтез органических веществ из неорганических.
Видео фотосинтез
Преподаватель: Итак, важнейший для всего живого процесс фотосинтеза – является окислительно-восстановительной реакцией. А восстановителем выступает чудо-вещество – хлорофилл.

Как вы думаете, почему растения зеленого цвета?
Студенты: потому что хлорофилл зеленого цвета
Преподаватель: Сам хлорофилл зеленого цвета, но растения выглядят зелеными не потому. Дело в том, что во время фотосинтеза пигменты хлорофилла поглощают свет только синего и красного спектров, так как наибольшим количеством фотонов обладает свет красного спектра, а фотоны синего спектра - самые богатые полезной энергией. Фотоны же зеленого спектра не выделяются ни количеством, ни качеством поэтому природа и решила не использовать их, чтобы не тратить силы зря. И зеленый цвет отражается, вот поэтому мы и видим растения зелеными.
Сделаем вывод - окисление всегда сопровождается восстановлением и наоборот, то есть окислительно – восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. Благодаря этим двум процессам на нашей планете существует жизнь.
Преподаватель: У нас есть 3 исследовательские группы. У каждой группы будет своя цель. Цель 1 группы выявить причины возгорания обычных спичек. Цель 2 группы выявить влияние среды на протекание окислительно-восстановительных реакций. Цель 3 группы выяснить значение окислительно-восстановительных реакций в строительстве
Работа по группам, затем каждая группа представляет результаты своего исследования
1 группа
В состав намазки спичечного коробка входят:
красный фосфор и сульфид сурьмы это горючие вещества и восстановители;
оксиды свинца и железа – это красящие пигменты;
костный клей – связующие вещества;
измельчённое стекло и мел – для увеличения силы трения.
В состав спичечной головки входят следующие компоненты:
бертолетова соль КСlO3 – окислитель;
сера – горючее вещество;
оксиды свинца и железа – пигменты;
костный клей – связующее вещество;
порошкообразное стекло – увеличение силы трения.
Отличие в составах в том, что в составе намазки – восстановители, а в составе спичечной головки – окислители.
Трение инициирует взаимодействие окислителей и восстановителей, сопровождаемое вспышкой.
Рассмотрим подробнее эти превращения.
Под действием тепла, возникшего при трении поверхностей, красный фосфор превращается в белый, который воспламеняется при t=50С, он зажигает головку спички.
(В темноте мы часто видим белые полосы на спичечном коробке)
Сера при t=200C превращается в жидкое состояние и начинает взаимодействовать с бертолетовой солью:
2KClO 3 + 3S 2KCl + 3SO2
Cl +5 +6e = Cl-1| 6 2 окислитель
12
S0 - 4e = S+4 | 4 3 восстановитель
При t = 370 - 400С разлагается бертолетова соль с выделением кислорода
2KClO3 2KCl + 3O2
Cl +5 +6e = Cl-1| 6 1 окислитель
6
О-2 -2 e = О0 | 2 3 восстановитель
При t = 441С сера закипает и воспламеняется
S + O2 SO2
S0 - 4e = S+4 | 4 1 восстановитель
4
О0 +2 e = О-2 | 2 2 окислитель
С горящей головки огонь перебрасывается на спичечную соломку. Основной компонент древесины – целлюлоза (С6Н5О11)n, уравнение запишем в упрощённом виде:
С + О2 СО2
В основе процессов возгорания спичек, как и в основе всех процессов горения лежат окислительно-восстановительные реакции.
Человек давно уже знаком с чудодейственными свойствами огня. Огонь рассеял мрак ночи и согрел своим теплом человека, дал возможность готовить вкусную пищу. Бесформенные куски глины благодаря огню превращаются в прочные обожженные кирпичи, а из похожей на камень руды выплавляется блестящий и звонкий металл. Но не надо забывать, что огонь может быть опасен. С огнем шутки плохи, необходимо соблюдать правила противопожарной безопасности!
Преподаватель: Спасибо за интересный рассказ, а теперь ребята Ваши вопросы.
Вопрос 1: Спичечная соломка тонкая и она должна сгореть быстро, но горит медленно. Почему так происходит?
Ответ: Спичечная соломка пропитывается особым составом, который не позволяет быстро сгорать. В состав входят соли фосфора, а у основания головки спичка пропитывается парафином, чтобы огонь более плавно перешел на дерево. Кроме того, эта же пропитка позволяет сохранить спичке форму и после сгорания.
Вопрос 2: Из какого дерева изготавливают спичечные соломки?
Ответ: Спичечную соломку готовят чаще всего из осины, реже из липы. Древесина этих деревьев более удобна для пропиток.
Преподаватель: Вот такие превращения произошли, а мы всего лишь чиркнули спичкой. Надеюсь, что теперь беря в руки обыкновенную спичку, Вы будете относиться к ней с большим почтением, чем до сих пор. И все это благодаря окислительно-восстановительным реакциям. Огонь тоже представляет собой борьбу двух противоположностей. С одной стороны, огонь - это друг, который помогает человеку, с другой стороны – это злейший враг, который может уничтожить все. Так что будьте осторожны с огнем!
2 группа
Мы провели реакцию взаимодействия перманганата калия с сульфидом натрия в различных средах: кислой, нейтральной и щелочной. Получились следующие результаты:
кислая среда: 5Na2SO3 +2KMnO4+ 3H2SO4(разб)= 5 Na2SO4 + 2MnSO4 +3H2O+K2SO4
S+4 - 2e = S+6 | 2 5 восстановитель
10
Mn+7 +5 e = Mn+2 | 5 2 окислитель
нейтральная среда: 3Na2SO3 + 2KMnO4 + 3H2O = 3Na2SO4 + 2MnO2+ 2KOH
S+4 - 2e = S+6 | 2 3 восстановитель
6
Mn+7 +3 e = Mn+4 | 3 2 окислитель
щелочная среда: Na2SO3 + 2KMnO4+ 2KOH = Na2SO4 + 2K2MnO4 + H2O
S+4 - 2e = S+6 | 2 1 восстановитель
2
Mn+7 +1 e = Mn+6 | 1 2 окислитель
Водные растворы, содержащие ионы MnO4, окрашены в фиолетовый цвет; содержащие ионы MnO42 – в зеленый; содержащие ионы Mn2+ – практически бесцветны; а осадок MnO2 – бурого цвета.
Мы сделали вывод: в зависимости от среды, в которой протекает реакция, перманганат калия восстанавливается до разных продуктов:
в кислой среде – до солей марганца (II),
в нейтральной – до оксида марганца (IV) MnO2,
в щелочной – до манганат-иона MnO42–:
Поэтому чтобы окислительно- восстановительные реакции протекали в нужном нам направлении, необходимо создавать соответствующую среду раствора. В нашем организме протекает множество окислительно-восстановительных реакций. Все биологические катализаторы – ферменты, работают при определенных рН. У здорового человека кровь имеет нейтральную среду рН = 7,36, желудочный сок – сильнокислую - рН = 1,7; кишечный сок – щелочную рН = 8.
Если значение рН в крови – 7,2 – значит, в организме произошли серьезные нарушения, при рН = 7,1 – появились необратимые изменения, приводящие к смерти, поэтому важно в организме иметь соответствующую среду.
Преподаватель: Спасибо за Ваш анализ. Теперь, ребята, Ваши вопросы.
Вопрос 1: В рекламе говорят рН нейтральный – 5,5. Так ли это?
Ответ: В нейтральной среде рН = 7, а не как говорят в рекламе. 5,5 – это слабо кислая среда. 
Вопрос 2: Почему в желудке такая кислая среда?
Ответ: В желудке содержится соляная кислота, которая обезвреживает микробы, попадающие с пищей.
Мы с Вами обнаружили, что в химии существует еще одна противоположность – кислая и щелочная среды. А между ними золотая середина – нейтральная среда. Для нормального протекания химических реакций где-то необходима одна среда, а где-то другая.
3 группа
Химия и строительство, две обширные и древние области деятельности человека, в течение многих веков развиваются в тесном контакте.
Окислительно-восстановительные реакции применяются при производстве некоторых строительных материалов. Например, производство кальцинированного гипса
В строительстве еще с древних времен применяются металлы и их сплавы. Многие металлы и сплавы подвергаются коррозии, т.е. разрушаются под действием окружающей среды. Коррозия наносит прямой ущерб, ежегодно от неё теряется около 1/3 произведённого за год во всём мире металла, но и косвенно разрушает конструкции, на которые был затрачен труд (машины, крыши, памятники архитектуры, мосты…)
Проведем опыты:
1-й стакан – заполнили обыкновенной водопроводной водой и опустили в него гвоздь.
2-й стакан - заполнили водопроводной водой с поваренной солью и опустили в него гвоздь.
1-й стакан – железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как вода слабый электролит. В данном случае мы наблюдаем химическую коррозию.
4Fe+3O2+6Н2О→4 Fe(ОН)3
Fe0 -3 e- →Fe+3| 4 4 восстановитель
12
2О0+4e- → 2О-2| 6 3 окислитель
2-й стакан - скорость коррозии очень велика, образовалось много ржавчины. Следовательно, хлорид натрия – это сильно коррозионная среда для железа, особенно в случае контакта с менее активным металлом – медью.
Так природа предусмотрела, что металлы, которых больше всего на Земле, окисляются самопроизвольно под действием окружающей среды, т. е. в природе они содержатся в связанном виде. Человек специально восстанавливает их для своих нужд. А уж если он получает их, то и сохранять должен. Помогает сохранять и защищает от коррозии знание окислительно-восстановительных реакций.
Уже полтора тысячелетия стоит на одной из площадей Дели железная колонна высотой 8 метров, диаметром 65 см, весом 6.5 тонн. И, несмотря на жаркий климат Индии, на ней нет ни единого ржавого пятнышка. Чем это можно объяснить? Она состоит из метеоритного железа. Кроме того, на столб постоянно залезают йоги, а тела их смазаны специальными маслами. Получается, что эти масла смазывают колонну и тем самым предотвращают действие кислорода на металл.
Один из наиболее распространенных способов защиты металлов от коррозии — нанесение на их поверхность защитных пленок: лака, краски, эмали. В производстве широко используют химическое нанесение металлических покрытий на изделия.
В повседневной жизни человек чаще всего встречается с покрытием железа цинком или оловом. Листовое железо, покрытое цинком, - оцинкованная жесть – используется для изготовления кровли.
Преподаватель: Спасибо молодцы, а теперь Ваши вопросы
Вопрос 1: Иногда разрушается бетон. Можно ли это назвать коррозией?
Ответ: Не всегда. Но в некоторых случаях протекает биокоррозия, когда окислительно-восстановительная реакция протекает под влиянием различных грибков.
Вопрос 2: Где еще при производстве строительных материалов возможны окислительно-восстановительные процессы??
Ответ: В строительстве очень широко используются металлы. При получении происходят окислительно-восстановительные реакции. Металлы восстанавливают с помощью углерода, водорода и других восстановителей
Преподаватель: Значит и в строительстве без окислительно-восстановительных реакций не обойтись. Можно с уверенностью сказать, что характерная особенность строительства - это быстрое освоение и продуктивное использование всего нового, что появлялось в химической науке. Но с другой стороны – некоторые окислительно-восстановительные реакции разрушают строительные конструкции. Опять две противоположности.
Весь окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают реакции, и в основном окислительно – восстановительные. Сделаем выводы по нашей теме
Студенты формулируют основные положения окислительно-восстановительных реакций
Преподаватель: А теперь давайте ответим на наш вопрос: зачем нужны противоположности в нашей жизни.
Студенты: для борьбы,
чтобы все двигалось и развивалось
Преподаватель: Мы живем и не задумываемся, что вокруг нас протекает множество химических реакций, без которых наша жизнь невозможна. Вокруг нас постоянно все движется. Все существующее постоянно переходит из одного состояния в другое, все течет и меняется, нет ничего неподвижного: окисленное восстанавливается, восстановленное окисляется, холодное нагревается, горячее остывает. В народе говорят: «Нет ХУДА без ДОБРА». В науке этот закон сформулирован как «Закон единства и борьбы противоположностей». Именно этот закон является внутренним источником движения и развития. Гераклит Эфесский говорил: «Чем больше противоположности расходятся, тем более они сходятся для борьбы, и из этой борьбы возникает «прекраснейшая гармония». Можно добавить гармония жизни, гармония красоты, гармония совершенства.
И с непонятной быстротою,
Кружась, несётся шар земной;
Проходят быстрой чередою
Сиянье дня и мрак ночной;
Бушует море на просторе,
У твёрдых скал шумит прибой,
Но в беге сфер земля и море
Проходят вечно предо мной.
Звуча в гармонии вселенной
И в хоре сфер гремя, как гром,
Златое солнце неизменно
Течёт предписанным путём.
Видеофрагмент
Приложение 1
Задание-исследование №1
Цель: выявить причины возгорания спичек
Задачи: 1. Изучить и проанализировать состав спичечной головки и намазки коробка
2. Выявить, что может произойти при трении спичечной головки и намазки коробка
Материалы для работы: спички и спичечный коробок.
Этапы исследования
1 этап: анализ составов спичечной головки и намазки коробка
В состав намазки спичечного коробка входят:
красный фосфор и сульфид сурьмы это горючие вещества и восстановители;
оксиды свинца и железа – это красящие пигменты;
костный клей – связующие вещества;
измельчённое стекло и мел – для увеличения силы трения.
В состав спичечной головки входят следующие компоненты:
бертолетова соль КСlO3;
сера – горючее вещество;
оксиды свинца и железа – пигменты;
костный клей – связующее вещество;
порошкообразное стекло – увеличение силы трения.
Красный фосфор и сульфид сурьмы - это горючие вещества и восстановители. Бертолетова соль КСlO3 является окислителем. Отличие в составах в том, что в составе намазки – восстановители, а в составе спичечной головки – окислители.
2 этап: исследование возможных реакций
Трение инициирует взаимодействие окислителей и восстановителей, сопровождаемое вспышкой:
Под действием тепла, возникшего при трении поверхностей, красный фосфор превращается в белый, который воспламеняется при t=50С, он зажигает головку спички. В темноте можно увидеть белые полосы на спичечном коробке.
Сера при t=200C превращается в жидкое состояние и начинает взаимодействовать с бертолетовой солью:
2KClO 3 + 3S 2KCl + 3SO2
Cl +5 +6e = Cl-1| 6 2 окислитель
12
S0 - 4e = S+4 | 4 3 восстановитель
Далее бертолетова соль может разлагаться с выделением кислорода
2KClO3 2KCl + 3O2
Cl +5 +6e = Cl-1| 6 1 окислитель
6
О-2 -2 e = О0 | 2 3 восстановитель
При t = 441С сера закипает и воспламеняется
S + O2 SO2
S0 - 4e = S+4 | 4 1 восстановитель
4
О0 +2 e = О-2 | 2 2 окислитель
С горящей головки огонь перебрасывается на деревянную палочку спички. Самовоспламенение древесины происходит при температуре выше 300°C. Основной компонент древесины – целлюлоза (С6Н5О11)n, уравнение запишем в упрощённом виде:
С + О2 СО2
С0 - 4e = С+4 | 4 1 восстановитель
4
О0 +2 e = О-2 | 2 2 окислитель
3 этап: формулировка выводов
В основе процессов возгорания спичек, как и в основе всех процессов горения лежат окислительно-восстановительные реакции.
Человек давно уже знаком с чудодейственными свойствами огня. Огонь рассеял мрак ночи и согрел своим теплом человека, дал возможность готовить вкусную пищу. Бесформенные куски глины благодаря огню превращаются в прочные обожженные кирпичи, а из похожей на камень руды выплавляется блестящий и звонкий металл. Но не надо забывать, что огонь может быть опасен. С огнем шутки плохи, необходимо соблюдать правила противопожарной безопасности!
Приложение 2
Задание-исследование №2
Цель: выявить влияние среды на протекание окислительно-восстановительных реакций
Задачи: 1. Провести экспериментальные исследования
2. Составить уравнения реакций и расставить коэффициенты методом электронного баланса
3. Выявить зависимость продуктов реакций от среды раствора.
Материалы для работы: штатив с пробирками, растворы перманганата калия, сульфида
натрия, гидроксида натрия, серной кислоты.
Этапы исследования
1 этап: экспериментальные исследования
Опыт 1. Поместите в пробирку 5-6 капель перманганата калия. Добавьте 2-3 капли серной кислоты, а затем сульфит натрия до обесцвечивания раствора. Отметьте, изменение окраски раствора.
Опыт 2. Поместите в пробирку 5-6 капель перманганата калия. Добавьте столько же сульфита натрия. Отметьте, образование осадка?
Опыт 3. Поместите в пробирку 2-3 капли гидроксида натрия. Добавьте 5-6 капель сульфита натрия, а затем перманганат калия.
2 этап: анализ реакций
кислотная среда: 5Na2SO3 +2KMnO4+ 3H2SO4(разб)= 5 Na2SO4 + 2MnSO4 +3H2O+K2SO4
S+4 - 2e = S+6 | 2 5 восстановитель
10
Mn+7 +5 e = Mn+2 | 5 2 окислитель
нейтральная среда: 3Na2SO3 + 2KMnO4 + 3H2O = 3Na2SO4 + 2MnO2+ 2KOH
S+4 - 2e = S+6 | 2 3 восстановитель
6
Mn+7 +3 e = Mn+4 | 3 2 окислитель
щелочная среда: Na2SO3 + 2KMnO4+ 2KOH = Na2SO4 + 2K2MnO4 + H2O
S+4 - 2e = S+6 | 2 1 восстановитель
2
Mn+7 +1 e = Mn+6 | 1 2 окислитель
Водные растворы, содержащие ионы MnO4, окрашены в фиолетовый цвет; содержащие ионы MnO42 – в зеленый; содержащие ионы Mn2+ – практически бесцветны; а осадок MnO2 – бурого цвета.
3 этап: формулировка выводов
Во всех реакциях сера является восстановителем, а марганец окислителем. В зависимости от среды, в которой протекает реакция, перманганат калия восстанавливается до разных продуктов:
в кислой среде – до солей марганца (II),
в нейтральной – до оксида марганца (IV) MnO2,
в щелочной – до манганат-иона MnO42–:
Значит продукты окислительно- восстановительных реакций зависят от среды раствора. Поэтому чтобы окислительно- восстановительные реакции протекали в нужном нам направлении, необходимо создавать соответствующую среду раствора. В нашем организме протекает множество окислительно-восстановительных реакций. Все биологические катализаторы – ферменты, работают при определенных рН. У здорового человека кровь имеет нейтральную среду рН = 7,36, желудочный сок – сильнокислую - рН = 1,7; кишечный сок – щелочную рН = 8.
Если значение рН в крови – 7,2 – значит, в организме произошли серьезные нарушения, при рН = 7,1 – появились необратимые изменения, приводящие к смерти, поэтому важно в организме иметь соответствующую среду.
Приложение 3
Задание-исследование №3
Цель: выяснить значение окислительно-восстановительных реакций в строительстве
Задачи: 1. Определить, где в строительстве мы сталкиваемся с окислительно-
восстановительными реакциями.
2. Выявить сущность процессов коррозии металлических конструкций
Материалы для работы: штатив с пробирками, железные гвозди, вода, медная проволока, хлорид натрия .
Этапы исследования
1 этап: определение областей строительства
Химия и строительство, две обширные и древние области деятельности человека, в течение многих веков развиваются в тесном контакте.
Окислительно-восстановительные реакции применяются при производстве некоторых строительных материалов. Например, производство кальцинированного гипса
S+6 +2 e-→ S+4 | 2 1 окислитель
2
С0 –2 e-→ С+2 | 2 1 восстановитель
В строительстве еще с древних времен применяются металлы и их сплавы. Многие металлы и сплавы подвергаются коррозии, т.е. разрушаются под действием окружающей среды. Коррозия наносит прямой ущерб, ежегодно от неё теряется около 1/3 произведённого за год во всём мире металла, но и косвенно разрушает конструкции, на которые был затрачен труд (машины, крыши, памятники архитектуры, мосты…)
2 этап: экспериментальные исследования
1-й стакан – заполнили обыкновенной водопроводной водой и опустили в него гвоздь.
2-й стакан - заполнили водопроводной водой с поваренной солью и опустили в него гвоздь.
1-й стакан – железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как вода слабый электролит. В данном случае мы наблюдаем химическую коррозию.
4Fe+3O2+6Н2О→4 Fe(ОН)3
Fe0 -3 e- →Fe+3| 4 4 восстановитель
12
2О0+4e- → 2О-2| 6 3 окислитель
2-й стакан - скорость коррозии очень велика, образовалось много ржавчины. Следовательно, хлорид натрия – это сильно коррозионная среда для железа, особенно в случае контакта с менее активным металлом – медью.
3 этап: формулировка выводов
Так природа предусмотрела, что металлы, которых больше всего на Земле, окисляются самопроизвольно под действием окружающей среды, т. е. в природе они содержатся в связанном виде. Человек специально восстанавливает их для своих нужд. А уж если он получает их, то и сохранять должен. Помогает сохранять и защищает от коррозии знание окислительно-восстановительных реакций.
Уже полтора тысячелетия стоит на одной из площадей Дели железная колонна высотой 8 метров, диаметром 65 см, весом 6.5 тонн. И, несмотря на жаркий климат Индии, на ней нет ни единого ржавого пятнышка. Чем это можно объяснить? Она состоит из метеоритного железа. Кроме того, на столб постоянно залезают йоги, а тела их смазаны специальными маслами. Получается, что эти масла смазывают колонну и тем самым предотвращают действие кислорода на металл.
Один из наиболее распространенных способов защиты металлов от коррозии — нанесение на их поверхность защитных пленок: лака, краски, эмали. В производстве широко используют химическое нанесение металлических покрытий на изделия.
В повседневной жизни человек чаще всего встречается с покрытием железа цинком или оловом. Листовое железо, покрытое цинком, - оцинкованная жесть – используется для изготовления кровли.
23

 Получите свидетельство
Получите свидетельство Вход
Вход






 Цели
Цели 


 мультимедийное сопровождение
мультимедийное сопровождение 















 Урок химии "Окислительно-восстановительные реакции" (0.77 MB)
Урок химии "Окислительно-восстановительные реакции" (0.77 MB)
 0
0 1620
1620 136
136 Нравится
0
Нравится
0








