Аннотация: Урок химии по теме «Окислительно-восстановительные реакции» предназначен для учащихся 8-х классов. На уроке раскрываются основные понятия об окислительно-восстановительных реакциях: степень окисления, окислитель, восстановитель, окисление, восстановление: формируется умение составлять записи ОВР методом электронного баланса.
Урок химии в 8-м классе по теме
«Окислительно-восстановительные реакции»
ЦЕЛЬ УРОКА: формировать систему знаний об окислительно-восстановительных реакциях, научить составлять записи ОВР методом электронного баланса.
ЗАДАЧИ УРОКА:
Обучающие: рассмотреть сущность окислительно-восстановительных процессов, научить применять «степени окисления» для определения процессов окисления и восстановления; научить учащихся уравнивать записи окислительно-восстановительной реакции методом электронного баланса.
Развивающие: Совершенствовать умения высказывать суждение о типе химической реакции, анализируя степень окисления атомов в веществах; делать выводы, работать с алгоритмами, формировать интерес к предмету.
Воспитывающие: формировать потребность в познавательной деятельности и ценностное отношение к знаниям; анализировать ответы товарищей, прогнозировать результат работы, оценивать свою работу; воспитать культуру общения через работу в парах «ученик – ученик», «учитель – ученик».
Тип урока: Урок изучения нового материала.
Методы, используемые на уроке: Объяснительно-иллюстративный.
Понятия, вводимые на уроке: окислительно-восстановительные реакции; окислитель; восстановитель; процесс окисления; процесс восстановления.
Используемое оборудование и реактивы: таблица растворимости, периодическая система Д. И. Менделеева, соляная кислота, серная кислота, цинк в гранулах, магниевая стружка, раствор сульфата меди, железный гвоздь.
Форма работы: индивидуальная, фронтальная.
Время урока: (90 минут, 2 урока).
Ход урока
I. Организационный момент
II. Повторение пройденного материала
УЧИТЕЛЬ: Ребята, давайте вспомним с вами ранее изученный материал о степени окисления, который будет необходим нам на уроке.
Устный фронтальный опрос:
Что такое электроотрицательность?
Что такое степень окисления?
Может ли степень окисления элемента быть равной нулю? В каких случаях?
Какую степень окисления чаще всего проявляет кислород в соединениях?
Вспомните исключения.
УЧАЩИЕСЯ: Для того, чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:
Степень окисления кислорода почти всегда равна -2.
Степень окисления водорода почти всегда равна +1.
Степень окисления металлов всегда положительна и в максимальном значении почти всегда равна номеру группы.
Степень окисления свободных атомов и атомов в простых веществах всегда равна 0.
Суммарная степень окисления атомов всех элементов в соединении равна 0.
УЧИТЕЛЬ предлагает ученикам для закрепления сформулированных правил посчитать - найти степень окисления элементов в простых веществах и соединениях:
S , Н2, H3PO4, NaHSO3, HNO3, Cu(NO2)2, NO2 , Ва, Al.
Например: Какая будет степень окисления серы в серной кислоте?
В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0.
H2+1SxO4-2
(+1) * 2 +X*1 + (-2) . 4 = 0
X = + 6
H2+1S+6O4-2
III. Изучение нового материала
УЧИТЕЛЬ: Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Это признак – изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
По этому признаку различают реакции
Химические реакции


Реакции, протекающие с изменением реакции, протекающие без изменения степени окисления элементов степени окисления элементов
Например, в реакции
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2
 AgNO3 + HCl AgCl + HNO3 (у доски пишет учащийся)
AgNO3 + HCl AgCl + HNO3 (у доски пишет учащийся)
Степени окисления атомов химических элементов после реакции не изменились. А вот в другой реакции – взаимодействие соляной кислоты с цинком
+1 -1 0 +2 -1 0
 2HCl + Zn ZnCl2 + H2 (у доски пишет учащийся)
2HCl + Zn ZnCl2 + H2 (у доски пишет учащийся)
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк – с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону
+1 0
 2H + 2e H2
2H + 2e H2
а каждый атом цинка – отдал два электрона
0 +2
 Zn - 2е Zn
Zn - 2е Zn
УЧИТЕЛЬ: Какие типы химических реакций вы знаете?
УАЩИЕСЯ: К ОВР относятся все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
УЧИТЕЛЬ: Дать определение ОВР.
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно – восстановительными реакциями.
УЧИТЕЛЬ: Ребята, определите устно, какая из предложенных реакций окислительно-восстановительной не является:
1) 2Na + Cl2 = 2NaCl
2) NaСL + AgNO3= NaNO3+AgCl↓
3) Zn + 2HCl = ZnCl2 + H2
4) S+O2=SO2
УЧАЩИЕСЯ: выполняют задание
УЧИТЕЛЬ: В качестве примеров ОВР продемонстрируем следующий опыт.
 H2SO4 + Mg MgSO4 + H2
H2SO4 + Mg MgSO4 + H2
Обозначим степень окисления всех элементов в формулах веществ – реагентов и продуктов этой реакции:
Как видно из уравнения реакции, атомы двух элементов магния и водорода, изменили свои степени окисления.
Что с ними произошло?
Магний из нейтрального атома превратился в условный ион в степени окисления +2, то есть отдал 2е:
 Mg 0 – 2е Mg +2
Mg 0 – 2е Mg +2
Запишите в свой конспект:
Элементы или вещества, отдающие электроны называются восстановителями; в ходе реакции они окисляются.
Условный ион Н в степени окисления +1 превратился в нейтральный атом, то есть каждый атом водорода получил по одному электрону.
 2Н+1 +2е Н2
2Н+1 +2е Н2
Элементы или вещества, принимающие электроны, называются окислителями; в ходе реакции они восстанавливаются.
 Эти процессы можно представить в виде схемы:
Эти процессы можно представить в виде схемы:

![]()

 Соляная кислота + магний сульфат магния + водород
Соляная кислота + магний сульфат магния + водород
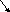

CuSO4 + Fe (железный гвоздь) = Fe SO4 + Cu (красивый красный гвоздь)
 Fe 0 – 2е Fe +2
Fe 0 – 2е Fe +2
 Cu+2 +2е Cu0
Cu+2 +2е Cu0
Процесс отдачи электронов называется окислением, а принятия – восстановлением.
В процессе окисления степень окисления повышается, в процессе восстановления – понижается.
Эти процессы неразрывно связаны между собой.
УЧИТЕЛЬ: Давайте выполним задание по вышеописанному образцу.
Задание: Для окислительно – восстановительных реакций укажите окислитель и восстановитель, процессы окисления и восстановления, составьте электронные уравнения:
1) BaO + SO2 =BaSO3
2) CuCl2 + Fe = FeCl2 + Cu
3) Li + O2 = Li2O3
4) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
II часть урока (2-ой урок)
Метод электронного баланса как способ составления уравнений ОВР
Далее рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. В основе метода электронного баланса лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
После объяснения учащиеся под руководством учителя составляют уравнения ОВР по планам, которые составил учитель к этому уроку .
Памятки находятся у каждого ученика на парте.
УЧИТЕЛЬ: Среди изученных нами реакций к окислительно – восстановительным реакциям относятся:
Взаимодействие металлов с неметаллами
2Mg + O2 =2MgO
![]()


![]() Восстановитель Mg0 -2e Mg+2 2 окисление
Восстановитель Mg0 -2e Mg+2 2 окисление
 Окислитель O2 +4e 2O-2 1 восстановление
Окислитель O2 +4e 2O-2 1 восстановление
2. Взаимодействие металлов с кислотой.
H2SO4 + Mg =MgSO4+H2


![]()
 Восстановитель Mg0 -2e Mg+2 2 окисление
Восстановитель Mg0 -2e Mg+2 2 окисление
 Окислитель 2O-2 +4e O20 1 восстановление
Окислитель 2O-2 +4e O20 1 восстановление
3. Взаимодействие металлов с солью.
CuSO4 + Mg =MgSO4+Cu


![]()
 Восстановитель Mg0 -2e Mg+2 2 окисление
Восстановитель Mg0 -2e Mg+2 2 окисление
 Окислитель Cu+2 +2e Cu0 1 восстановление
Окислитель Cu+2 +2e Cu0 1 восстановление
Диктуется реакция, один учащийся самостоятельно составляет схему реакции у доски:
H2 + O2 → H2O
Определим, атомы каких элементов изменяют степень окисления.
( H2° + O2° → H2O2).
Составим электронные уравнения процессов окисления и восстановления.
(H2° -2e → 2H+ – процесс окисления,
O2° +4e → 2O-² - процесс восстановления,
Н2 – восстановитель, О2 - окислитель)
Подберём общее делимое для отданных и принятых е и коэффициенты для электронных уравнений.
(∙2| Н2°-2е → 2Н+ - процесс окисления, элемент – восстановитель;
∙1| O2° +4e → 2O-² - процесс восстановления, элемент – окислитель).
Перенесём эти коэффициенты в уравнение ОВР и подберём коэффициенты перед формулами других веществ.
2H2 + O2 → 2H2O.
IV. Закрепление изученного материала
Упражнения для закрепления материала:
Какая схема превращения азота соответствует данному уравнению реакции
4NH3 +5O 2 → 4NO + 6H2O
1) N+3 → N+2 3) N+3 → N-3
2) N-3 → N-2 4) N-3 → N+2
2) Установите соответствие между изменением степени окисления атома серы и схемой превращения вещества. Запишите цифры без пробелов и запятых.
СХЕМА ПРЕВРАЩЕНИЙ
A) H2S + O2 → SO2 + H2O
Б) H2SO4 + Na → Na2SO4 + H2S + H2O
В) SO2 + Br2 + H2O → H2SO4 + HBr
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) Э+4 → Э+6
2) Э+6 → Э-2
3) Э+6 → Э+4
4) Э-2 → Э+6
5) Э-2 → Э+4 ответ (521)
3)Установите соответствие между схемой превращения и изменением степени окисления окислителя в ней.
СХЕМА ПРЕВРАЩЕНИЙ
A) Cl2 + K2MnO4 → KMnO4 + KCl
Б) NH4Cl + KNO3 → KCl + N2O + H2O
В) HI + FeCl3 → FeCl2 + HCl + I2
ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) Э+6 → Э+7
2) Э+5 → Э+1
3) Э+3 → Э+2
4) Э0 → Э-1
5) Э-1 → Э0 ответ (423)
V. Заключительное слово учителя
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов: окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. Весь окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции, в основном окислительно-восстановительные.
VI. Рефлексия.
VIII. Домашнее задание: § 43, упр.1, 3, 7 стр.234-235.
Используемая литература:
1.Габриелян О.С. «Химия. 8 класс: учеб. для общеобразоват. учреждений. –М. : Дрофа, 2010.
Окислительно – восстановительные реакции. Хомченко Г.П., Севастьянова К.И. - Из-во Просвещение, 1985.
Электронный учебник: http://www.alhimikov.net/elektronbuch/Page-28.html
Ресурсы интернет:
http://www.chem.msu.su/rus/school/zhukov/18.html
http://cor.edu.27.ru/dlrstore/0000002e-1000-4ddd-97d5-460046642032/2109440o2.pdf
http://e-ypok.ru/ege_chemistries_c1
ПАМЯТКА ДЛЯ УЧАЩИХСЯ
Приложение №1
Важнейшие восстановители и окислители
| Восстановители | Окислители |
| Металлы, Н2, уголь, СО – оксид углерода (II) H2S, SO2, H2SO3 и её соли HJ, HBr, HCl SnCl2 ,FeSO4 ,MnSO4, Cr2(SO4)3 HNO2-азотистая кислота NH3 –аммиак NO- оксид азота (II) Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе
| Галогены KMnO4, K2MnO4, MnO2, K2Cr2O7, K2CrO4 HNO3-азотная кислота H2O2 – пероксид водорода О3 – озон, О2 H2SO4( конц.), H2SеO4 CuO, Ag2O, PbO2 Ионы благородных металлов (Ag+, Au3+ ) FeCl3 Гипохлориты, хлораты и перхлораты «Царская водка» Анод при электролизе |
Приложение №2
Алгоритм составления химических уравнений методом электронного баланса:
1.Составить схему реакции.
2.Определить степени окисления элементов в реагентах и продуктах реакции.
Помните!
номеру группы этих металлов (для I-III группы).
соединениях обычно равна - 2, кроме H2O2 -1 и ОF2.
соединениях обычно равна +1, кроме МеH (гидриды).
элементов в соединениях равна 0.
3.Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
4.Подчеркнуть элементы, степени окисления которых изменяются.
5.Составить электронные уравнения процессов окисления и восстановления.
6.Определить, какой элемент окисляется (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается) в процессе реакции.
7.В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
8.Определить восстановитель и окислитель.
9.Сбалансировать число электронов между окислителем и восстановителем.
10.Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
11.Записать коэффициент перед формулой вещества, определяющего среду раствора.
12.Проверить уравнение реакции.
Приложение 3
Самостоятельная работа для проверки знаний
Вариант 1
1. Проставьте степень окисления элементов в соединениях, формулы которых IBr, TeCl4, SeFe, NF3, CS2.
2. В следующих схемах реакций укажите степень окисления каждого элемента и расставьте коэффициенты методом электронного баланса:
1) F2 + Хе → XeF6 3) Na + Br2 → NaBr
2) S + H2 → H2S 4) N2 + Mg → Mg3N2
Вариант 2
1.Проставьте степень окисления элементов в соединениях: H2SО4, HCN, HNО2, РС13
2. Допишите уравнения реакций окисления-восстановления:
1) CI2 + Fe → 2) F2 + I2 → 3) Ca + С → 4) С + H2 →
Укажите степени окисления элементов в полученных продуктах.
Вариант 3
1. Проставьте степень окисления в соединениях, формулы которых XeF4, CC14, РС1б, SnS2.
2. Напишите уравнения реакций: а) растворения магния в растворе серной кислоты; б) взаимодействия раствора бромида натрия с хлором. Какой элемент окисляется и какой восстанавливается?
Вариант 4
1. Составьте формулы следующих соединений: а) нитрида лития (соединения лития с азотом); б) сульфида алюминия (соединения алюминия с серой); в) фторида фосфора, в которых электроположительный элемент проявляет максимальную степень окисления.
2. Напишите уравнения реакций: а) иодида магния с бромом; б) растворения магния в растворе бромоводородной кислоты. Укажите, что в каждом случае является окислителем и что — восстановителем.
Вариант 5
1.Составьте формулы следующих соединений: а) фтора с ксеноном; б) бериллия с углеродом, в которых электроположительный элемент проявляет максимальную степень окисления.
2. Расставьте коэффициенты методом электронного баланса в следующих схемах:
1) KI + Cu(NО3)2 → CuI + I2 + KNО3
2) MnS + HNО3 (конц.) → MnSО4 + NО2 + H2О
Вариант 6
1. Проставьте степени окисления каждого элемента в соединениях, формулы которых Na2SО3, КСЮ3, NaCIO, Na2CrО4, NН4СlO4, BaMnО4.
2. Напишите уравнения реакций: а) иодида лития с хлором; б) лития с соляной кислотой. Проставьте степени окисления всех элементов и коэффициенты по методу электронного баланса.
Вариант 7
1. Вычислите степени окисления марганца, хрома и азота в соединениях, формулы которых КMnO4, Na2Cr2О7, NH4NО3.
2. Проставьте степени окисления каждого элемента и расставьте коэффициенты, используя метод электронного баланса в следующих схемах:
1) Fe + FeВr3 → FeBr2
2) H2SО3 + I2 + H2О → H2SО4 + HI
Вариант 8
1. Какова степень окисления углерода в оксиде углерода (IV) и изменяется ли она при взаимодействии углекислого газа с водой с образованием угольной кислоты?
2. Расставьте коэффициенты методом электронного баланса в следующих схемах:
1) NH3 + SO2 → N2 + S + H2О
2) H2S + H2О2 → H2SО4 + H2О


 Получите свидетельство
Получите свидетельство Вход
Вход





 AgNO3 + HCl AgCl + HNO3 (у доски пишет учащийся)
AgNO3 + HCl AgCl + HNO3 (у доски пишет учащийся) H2SO4 + Mg MgSO4 + H2
H2SO4 + Mg MgSO4 + H2 2Н+1 +2е Н2
2Н+1 +2е Н2 Эти процессы можно представить в виде схемы:
Эти процессы можно представить в виде схемы:

 Соляная кислота + магний сульфат магния + водород
Соляная кислота + магний сульфат магния + водород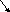













 Урок химии на тему "Окислительно-восстановительные реакции" (92.94 КB)
Урок химии на тему "Окислительно-восстановительные реакции" (92.94 КB)
 1
1 736
736 20
20 Нравится
0
Нравится
0


