
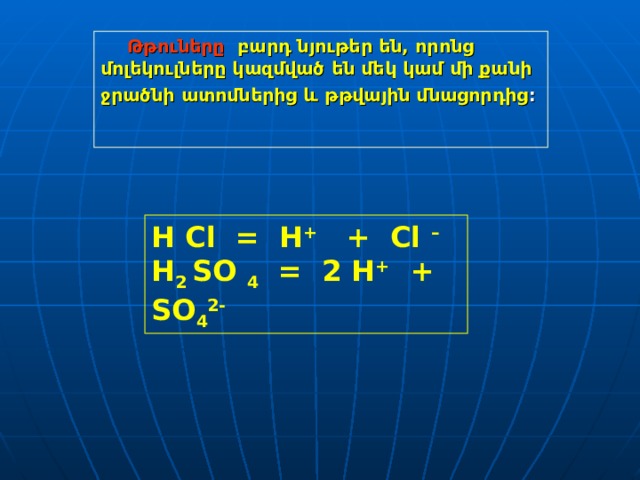
Թթուները բարդ նյութեր են, որոնց մոլեկուլները կազմված են մեկ կամ մի քանի
ջրածնի ատոմներից և թթվային մնացորդից :
H Cl = H + + Cl –
H 2 SO 4 = 2 H + + SO 4 2-
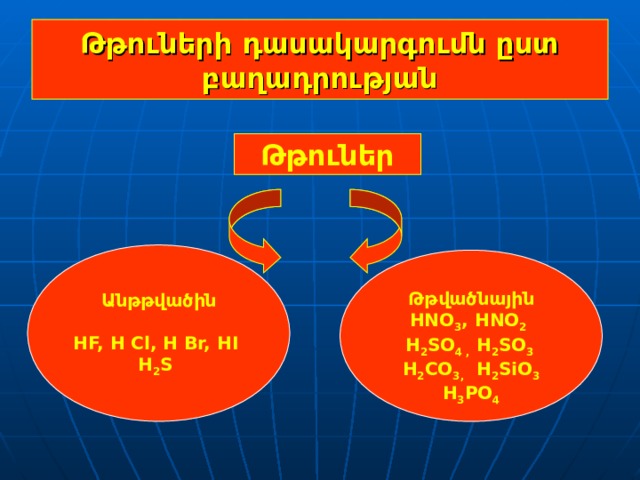
Թթուների դասակարգումն ըստ բաղադրության
Թթուներ
Անթթվածին
HF, H Cl , H Br, HI
H 2 S
Թթվածնային
HNO 3 , HNO 2
H 2 SO 4 , H 2 SO 3
H 2 CO 3 , H 2 SiO 3
H 3 PO 4

Թթուների դասակարգումը ըստ հիմնայնության
ԹԹՈՒՆԵՐ
Միահիմն
Երկհիմն
HNO3 ազոտական
H2SO4 ծծմբական
Եռահիմն
H3PO4 ֆոսֆորական
HF ֆտորաջրածնային
H2SO3 ծծմբային
HCl քլորաջրածնային
H2S ծծմբաջրածնային
HBr բրոմաջրածնային
H2CO3 ածխաթթու
HI յոդաջրածնային
H2SiO3 սիլիկաթթու
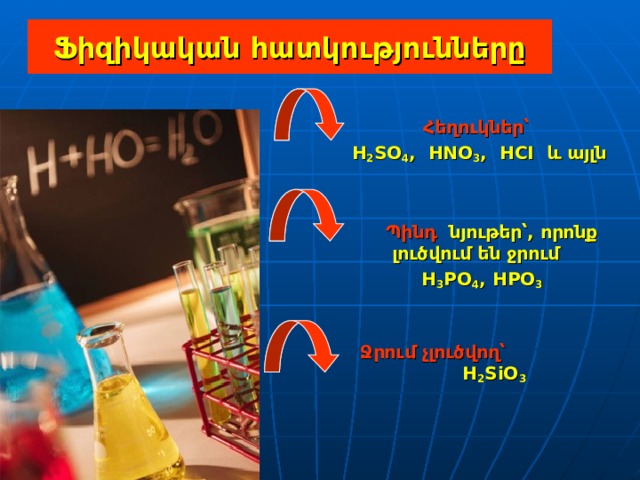
Ֆիզիկական հատկությունները
Հեղուկներ՝
H 2 SO 4 , HNO 3 , HCI և այլն
Պինդ նյութեր՝ , որոնք լուծվում են ջրում
H 3 PO 4 , HPO 3
Ջրում չլուծվող՝ H 2 SiO 3
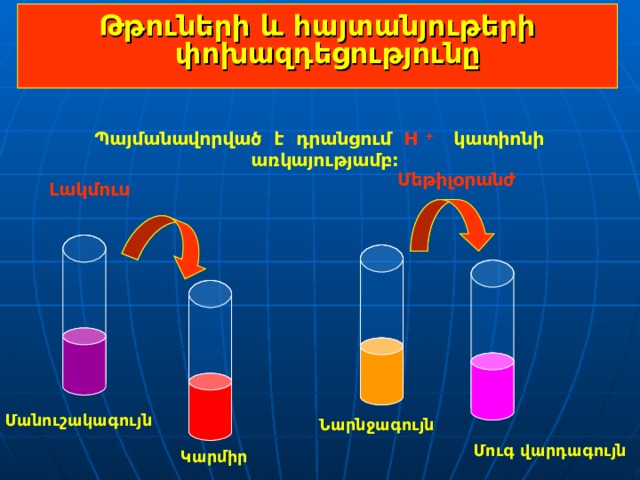
Թթուների և հայտանյութերի փոխազդեցությունը
Պայմանավորված է դրանցում Н + կատիոնի առկայությամբ:
Մեթիլօրանժ
Լակմուս
Մանուշակագույն
Նարնջագույն
Մուգ վարդագույն
Կարմիր

Թթուների և մետաղների փոխազդեցությունը
Մետաղ + թթու = աղ + ջրածին
H 2
Zn + 2 HCI = ZnCI 2 + H 2
Zn +2H + + 2Cl - = Zn 2+ + 2Cl - + H 2
Zn + 2H + = Zn 2+ + H 2
Թթուների լուծույթների հետ փոխազդում են այն մետաղները,որոնք.
- Մ ետաղների համեմատական ակտիվության շարքում ջրածնից
առաջ (ձախ) են տեղադրված,
- Փոխազդելով թթուների հետ՝հիմնականում առաջանում են
լուծելի աղեր:
Zn
HCl
7
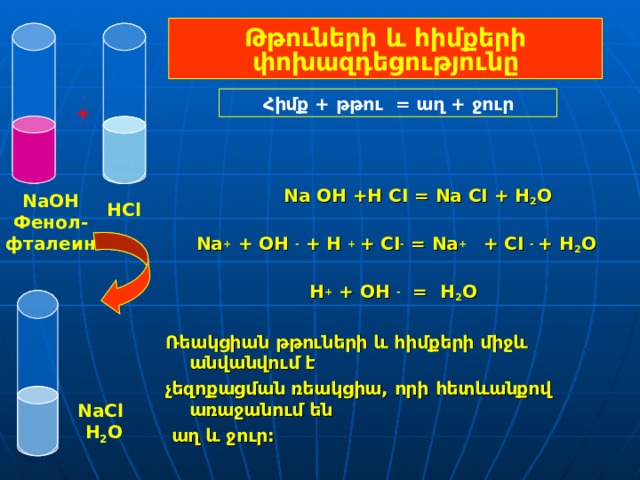
Թթուների և հիմքերի փոխազդեցությունը
Հիմք + թթու = աղ + ջուր
+
Na OH +H CI = Na CI + H 2 O
Na + + OH - + H + + CI - = Na + + CI - + H 2 O
Н + + OH - = H 2 O
Ռեակցիան թթուների և հիմքերի միջև անվանվում է
չեզոքացման ռեակցիա, որի հետևանքով առաջանում են
աղ և ջուր :
NaOH
Фенол-
фталеин
HCl
NaCl
H 2 O

Թթուների և հիմնային օքսիդների փոխազդեցությունը
Հիմնային օքսիդ + թթու = աղ + ջուր
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 2H + + SO 4 2- = Cu 2+ + SO 4 2- + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
Cu O
H 2 SO 4
Cu SO 4
H 2 O
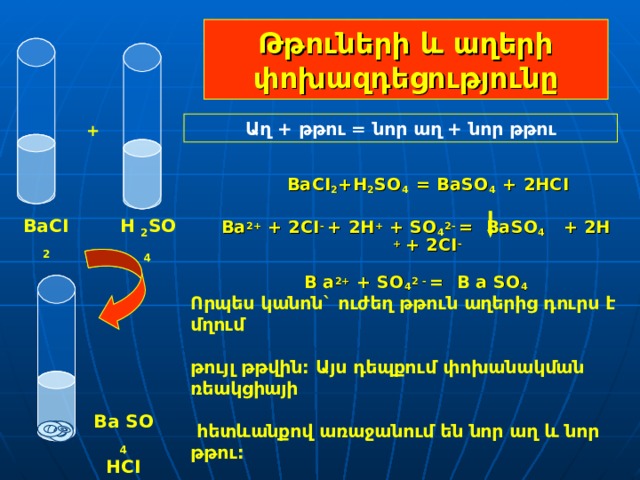
Թթուների և աղերի փոխազդեցությունը
Աղ + թթու = նոր աղ + նոր թթու
+
BaCI 2 +H 2 SO 4 = BaSO 4 + 2HCI
Ba 2+ + 2 CI - + 2Н + + S О 4 2- = BaSO 4 + 2H + + 2 CI -
B a 2+ + S О 4 2 - = B a S О 4
H 2 SO 4
BaCI 2
Որպես կանոն` ուժեղ թթուն աղերից դուրս է մղում
թույլ թթվին: Այս դեպքում փոխանակման ռեակցիայի
հետևանքով առաջանում են նոր աղ և նոր թթու:
Ba SO 4
HCI

Թթուների քայքայումը
Թթուների քայքայումից սովորաբար առաջանում են ջուր և այդ թթվին համապատասխանող անհիդրիդը:
H 2 CO 3 = H 2 O + CO 2
H 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
CO2
H 2 CO 3

Թթուների ստացման եղանակները
Թթվային օքսիդների և ջրի փոխազդեցությունից՝
P 2 O 5 + 3H 2 O = 2H 3 PO 4
SO 3 + H 2 O = …
SO 2 + H 2 O = …
С O 2 + H 2 O = …
ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունից.
H 2 + CI 2 = 2HCI
H 2 + S = …
H 2 + I 2 = …
ավելի ուժեղ թթվի ու համապատասխան աղի փոխազդեցությունից .
2NaCI + H 2 SO 4 = Na 2 SO 4 + 2HCI
К CI + H 2 SO 4 = …


 Получите свидетельство
Получите свидетельство Вход
Вход












 ԹթուներԻ քիմիական և ֆիզիկական հատկությունները (942.5 KB)
ԹթուներԻ քիմիական և ֆիզիկական հատկությունները (942.5 KB)
 0
0 150
150 0
0 Нравится
0
Нравится
0


