Департамент образования города Москвы
Государственное бюджетное общеобразовательное учреждение города Москвы школа № 924
Исследовательская работа
«Биофлавоноиды»
Выполнили:
Семенова Софья,
обучающаяся 8 Г класса
Руководитель: Екимова Людмила Павловна учитель химии и биологии
Москва, 2024 г.
ОГЛАВЛЕНИЕ
|
| Введение | 2 |
| I. | Литературный обзор. | 3 |
| 1. | Понятие индикатор. | 3 |
| 2. | Кислотно-основное титрование и индикаторы. | 3 |
| 3. | Основные типы индикаторов. | 5 |
| 3.1 | Окислительно-восстановительные индикаторы | 5 |
| 3.2 | Кислотно-основные индикаторы | 6 |
| 3.3 | Осадкообразующие (адсорбционные) индикаторы | 6 |
| 4. | Типы соединений, содержащиеся в различных растениях, которые можно использовать в качестве индикаторов |
|
| II. | Параметры процесса | 13 |
| 1. | Требования предъявляются к индикаторам, применяемым в кислотно-основном титровании. Ценность индикатора | 13 |
| 2. | Объект исследования: | 13 |
| 3. | Предмет исследования: | 14 |
| 4. | Титрование раствора уксусной кислоты, в присутствии индикаторов | 20 |
| 5. | Калибрование растительных индикаторов. | 25 |
| 6. | Эффективность технологической схемы. | 26 |
|
| Литература |
|
Введение
Царство растений поражает многообразием красок. Цветовая палитра разнообразна и определяется химическим составом клеточного содержимого каждого растения, в состав которого входят пигменты - биофлавоноиды. Пигменты - красящие вещества, придающие цвет растениям. Растительные пигменты – это крупные органические молекулы, имеющие группировки, ответственные за поглощение света. Пигменты находятся чаще в тех или иных структурных образованиях клетки, реже — в жидкостях организма в растворённом состоянии. Так, хлорофилл сосредоточен в хлоропластах, каротиноиды — в хромо - и хлоропластах, гемоглобин — в эритроцитах, флавоноиды — в клеточном соке растений.
Цель: Изучить понятие об индикаторах;
• Ознакомиться с их открытием и выполняемыми функциями;
• Научиться выделять индикаторы из природных объектов;
• Исследовать действие природных индикаторов в различных средах;
Методы исследования: эксперимент, наблюдение, сравнение, анализ.
Гипотеза
Если растения изменяют цвет в различных средах, то их можно использовать в качестве индикаторов
Задачи
Приготовить растворы индикаторов, которые бы указывали на присутствие кислоты или основания.
Исследовать среды растворов растительными индикаторам.
Объект исследования: каркаде, черная смородина, свекла, краснокочанная капуста.
Предмет исследования: изучение индикаторов растительного происхождения на основе антоцианов.
Литературный обзор.
Понятие индикатор.
Слово индикатор происходит от латинского «indicare», что означает «показывать», «обнаруживать». В аналитической химии данный термин употребляется в довольно четко определенном смысле. При титровании необходимо располагать таким средством, которое указывало бы, что к титруемому веществу добавлено эквивалентное количество титранта. Такое указание можно получить различными путями:
это может быть явление, происходящее в конце самого процесса титрования и наблюдаемое визуально;
это может быть какое-либо другое изменение в титруемой системе, которое можно обнаружить при помощи физических методов измерения;
это может быть изменение, происходящее с каким-либо посторонним веществом в точке эквивалентности, обнаруживаемое органами чувств.
Индикатором в данном случае называется постороннее вещество. Индикаторы можно применять не только для становления конечной точки титрования, но и для количественного (в колориметрии), и качественного анализов. [1, 143]
Все виды титрования основываются на донорно-акцепторных процессах, в которых донорами или акцепторами могут быть как электроны, так и другие частицы, в частности, протон H+. В зависимости от природы обмениваемых при титровании частиц требуются индикаторы различного типа. Сам индикатор часто (хотя и не всегда) представляет собой донорно-акцепторную систему для той же частицы. Поскольку особо важным процессом является протонный обмен, кислотно-основное титрование почти всегда рассматривается как отдельный класс, поэтому кислотно-основные индикаторы также составляют отдельную группу индикаторов. В тех случаях, когда используют термин «индикатор», не давая никакого дополнительного пояснения, всегда имеется в виду кислотно-основной индикатор. Однако существуют и другие типы индикаторов: окислительно-восстановительные индикаторы («редокс»-индикаторы) для тех процессов, в которых происходит обмен электронов, ряд других индикаторов для донорно-акцепторных процессов, в которых обменивающимися частицами являются частицы, отличные от протонов и электронов. [1, 146]
Кислотно-основное титрование и индикаторы.
Кислотно-основное титрование относится к титриметрическим методам анализа, где в качестве аналитической реакции используются реакции нейтрализации. В отличие от окислительно-восстановительных реакций в реакциях нейтрализации не происходит переноса электронов между участниками реакции, а происходит только обмен ионами между реагентами. Поэтому реакции нейтрализации иногда называют реакциями ионного обмена.
Поскольку в процессе кислотно-основного титрования измеряется количество кислоты (концентрация Н+-ионов) иногда этот метод называется протолитометрия (измерение количества протонов). Другие названия метода – ацидиметрия (от англ. acide – кислота), алкалиметрия (от англ. aikaline – щелочь). Всё это одно и то же, т. е. речь идёт об измерении [H+] или [OH-], которые принято выражать как рН и рОН (см. гл. II).
В методах кислотно-основного титрования основной является реакция передачи протона от титранта к титруемому веществу или от титруемого вещества к титранту. Реакции кислотно-основного взаимодействия характеризуются высокой скоростью и протекают строго стехиометрически. В качестве рабочих растворов используют растворы сильных кислот (HCl, H2SO4 и т. д.) концентрации от 0,05 до 1,0 моль/л или сильных оснований (NaOH, KOH, Ba(OH)2 и т. д.) той же концентрации.
рН индикаторы. Наибольшее распространение в практике водного титриметрического анализа получили цветные индикаторы, окраска которых зависит от рН раствора. Первым индикатором, использованным для этой цели, был лакмус, который получали из растительного сырья.
В конце XIX в. практике титриметрического анализа стали применять синтетические индикаторы: сначала фенолфталеин, а затем азокрасители и другие соединения. Использование синтетических индикаторов позволило существенно повысить точность титриметрических методов анализа, так как растительные экстракты, представляющие собой смесь различных природных веществ имели ограниченную устойчивость и не всегда давали воспроизводимые результаты. Из растительных экстрактов до настоящего времени сохранили определённое значение лишь лакмус и куркума.
Изменение цвета индикатора с изменением рН раствора общеизвестно: метиловый оранжевый в килой среде имеет красную окраску, а в щелочной – жёлтую.
По химической природе кислотно-основные индикаторы являются слабыми органическими кислотами или основаниями, частично диссоциирующими в растворе:
| HInd = H+ + Ind- | (4.1) |
По теории ионных окрасок Оствальда недиссоциированные молекулы индикатора HInd и аниона Ind- имеют разную окраску. Изменение цвета индикатора при изменении рН эта теория связывает со сдвигом равновесия диссоциации (4.1). С увеличением концентрации ионов водорода равновесие (4.1) сдвигается влево и раствор приобретает окраску HInd, при уменьшении кислотности возрастает концентрация Ind- и окраска раствора изменяется. Если одна из форм индикатора (HInd или Ind-) бесцветна, индикатор называют одноцветным в отличие от двухцветных, у которых окрашены обе формы. У одноцветных индикаторов (например, фенолфталеина) при изменении рН происходит обесцвечивание раствора или появление окраски.
Глаз человека способен установить появление окрашенных частиц, если их содержание будет примерно в 10 раз или более превышать концентрацию других окрашенных частиц в растворе. Это означает применительно к уравнению (4.4), что если отношение [Ind]/[HInd] будет близко к 1/10 и меньше, то цвет раствора будет восприниматься как цвет индикаторной формы HInd. В интервале отношений [Ind-]/[HInd] ≥ 10 до [Ind-]/[HInd] ≤ 0,1 наблюдается промежуточная окраска индикатора. Уравнение (4.4) связывает интервал концентрационного отношения [Ind-]/[HInd] от 10 до 0,1 с интервалом рН.
В кислых и нейтральных растворах фенолфталеин бесцветен (HInd), в щелочной среде он приобретает красный цвет (форма Ind-).
В качестве кислотно-основных индикаторов используются многие другие группы соединений: сульфофталеины (тимоловый синий и др.), трифенилметановые красители (метиловый фиолетовый и др.).
Смешением нескольких индикаторов получают так называемый универсальный индикатор, непрерывно изменяющий свою окраску в широком интервале рН и пригодный для приближённого определения рН в этом интервале.
В качестве кислотно-основных индикаторов могут быть также слабые органические основания. Если В – молекула такого индикатора, то его взаимодействие с протоном будет описываться схемой
| В + Н+ = ВН+ | (4.6) |
Процесс (4.6) характеризуется константой протонирования: КПр
|
|
Частицы В и ВН+ имеют разную окраску. Для индикатора-основания сохраняются в силе все те соображения, которые были высказаны ранее об индикаторе-кислоте относительно интервала перехода и других свойствах и характеристиках.
Основные типы индикаторов.
Индикаторы классифицируют по типу реакции:
I. Окислительно-восстановительные индикаторы.
II. Индикаторы присоединения ионов:
1) Металлохромные индикаторы.
2) Кислотно-основные индикаторы:
3) Осадкообразующие индикаторы. Адсорбционные индикаторы.
Все индикаторы присоединения ионов в общем смысле имеют одинаковую природу, ион водорода занимает место ионов металла при переходе от металлохромных к кислотно-основным индикаторам, и фактически все индикаторы в некотором роде реагируют на ион водорода. [1, 273]
3.1. Окислительно-восстановительные индикаторы
Окислительно-восстановительные индикаторы— вещества, применяемые для определения точки эквивалентности в окислительно-восстановительных реакциях.
В большинстве случаев такими индикаторами являются органические соединения, проявляющие окислительно-восстановительные свойства, и металлоорганические, в которых по достижению определённого потенциала изменяется степень окисления металла. И в том, и в другом случаях структурные изменения сопровождаются изменением окраски соединения. [3, 57]
Классификация окислительно-восстановительных индикаторов
В зависимости от типа взаимодействия различают индикаторы:
общие — изменяют свою окраску в соответствии с потенциалом и независимо от природы веществ в растворе (например, дифениламин, метиленовый синий);
специфические — реагируют только с определёнными соединениями (крахмал является индикатором на йод, тиоцианат-ионы — на катион Fe3+).
В зависимости от схемы перехода цвета индикаторы делят на:
одноцветные — одна форма имеет цвет, другая — бесцветная;
двухцветные — обе формы имеют собственные цвета. [2, 124]
Требования к применяемым индикаторам
быть хорошо растворимыми в воде, кислотах и других типичных средах для титрования;
быть устойчивыми к действию факторов окружающей среды (света, воздуха), других компонентов в растворе и стабильными при длительном хранении;
окраски окисленной и восстановленной форм должны чётко отличаться;
интервал потенциала, на котором происходит переход между формами, должен быть узким и отвечать скачку на кривой титрования;
окраска должна изменяться быстро, а ответная реакция быть полностью обратимой, не нести влияния посторонних реакций;
изменение цвета раствора в конечной точке титрования должно быть чётким даже при наименьшем количестве добавленного индикатора. [6,67]
3.2. Кислотно-основные индикаторы
Кислотно-основные индикаторы (по-другому их называют pH - индикаторы) — это соединения, изменяющие свою окраску в зависимости от среды, в которой они находятся. Обычно такими веществами являются слабые кислоты либо слабые основания. При растворении в воде они слабо диссоциируют, образуя ионы. [7, 380]
Универсальным индикатором является смесь индикаторов, дающее постепенное изменение окраски в широком диапазоне изменений pH. Если в раствор прилить несколько капель универсального индикатора, то по окрашиванию раствора можно приблизительно определить его pH. [4, 52]
3.3. Осадкообразующие (адсорбционные) индикаторы
Адсорбционные индикаторы - это вещества, адсорбция или десорбция которых осадком при осадительном титровании сопровождается изменением окраски около точки эквивалентности.
Индикаторы этого типа - органические соединения, которые в точке эквивалентности адсорбируются осадком и окрашивают его, а до точки эквивалентности - не адсорбируются. Пример их использования - определение хлорид-ионов по методу Фаянса-Фишера-Ходакова прямым титрованием стандартным раствором нитрата серебра в присутствии адсорбционного индикатора – флуоресциина. До точки эквивалентности неоттитрованные хлорид-ионы препятствуют адсорбции ионов индикатора на поверхности осадка хлорида серебра, и раствор имеет желто-зеленый цвет индикатора. Белый осадок хлорида серебра вследствие окраски раствора также выглядит желтым. После достижения точки эквивалентности практически все хлорид-ионы оказываются оттитрованными, и ионы индикатора начинают адсорбироваться осадком, образуя красно-розовый адсорбционный комплекс. Таким образом, после точки эквивалентности происходит изменение цвета осадка хлорида железа из желтого в красно-розовый. [5, 312]
Типы соединений, содержащиеся в различных растениях, которые можно использовать в качестве индикаторов.
Природа – уникальное творение Вселенной. Царство растений поражает многообразием красок. Цветовая палитра разнообразна и определяется химическим составом клеточного содержимого каждого растения, в состав которого входят пигменты - биофлавоноиды. Пигменты - красящие вещества, придающие цвет растениям. Растительные пигменты – это крупные органические молекулы, имеющие группировки, ответственные за поглощение света. Пигменты находятся чаще в тех или иных структурных образованиях клетки, реже — в жидкостях организма в растворённом состоянии. Так, хлорофилл сосредоточен в хлоропластах, каротиноиды — в хромо - и хлоропластах, гемоглобин — в эритроцитах, флавоноиды — в клеточном соке растений.
Каротиноиды — наиболее распространённый класс биологических пигментов. Они обнаружены у большинства живых существ, в том числе у всех без исключений растений, многих микроорганизмов. Синтезируются бактериями, грибами, водорослями, высшими растениями и коралловыми полипами. Когда хлорофилл исчерпывается в холодное время года, листья приобретают заметную жёлтую или оранжевую окраску за счёт пролонгированного действия пигмента каротиноида. Каротиноиды защищают растения от пагубного действия солнечного света, принимая УФ-излучения солнца на себя, трансформируя в энергию и передавая её хлорофиллу. Каротиноиды включают две основных группы структурно близких веществ: каротины и ксантофиллы. Каротины в основном - это бета-каротин, а ксантофиллы - это окисленные каротины. Каротин. Эмпирическая формула С40H56. Нерастворим в воде, но растворяется в органических растворителях. Содержится в листьях всех растений, а также в корне моркови, плодах шиповника и др. Различают два изомера каротина: α-каротин и β-каротин. β-каротин встречается в жёлтых, оранжевых и зелёных листьях фруктов и овощей.
Ксантофилл— желтый пигмент из группы каротиноидов, имеющий эмпирическую формулу С40Н5602, не растворяется в воде, но хорошо растворяется в спирте; содержится наряду с каротином в хлоропластах и хромопластах.
Хиноны — химические соединения, производные моноциклических или полициклических ароматических углеводородов, в составе которых присутствует ненасыщеный циклический дикетон. Их окраска варьирует от бледно-жёлтой до оранжевой, красной, пурпурной, коричневой и почти чёрной. Обнаружены у многих грибов, лишайников и в некоторых группах беспозвоночных.
Флавоноиды — O-гетероциклические фенольные соединения. В природе синтезируются почти исключительно высшими растениями. В их число входят антоцианы, обуславливающие наиболее яркие цвета растений — красные, пурпурные, синие части цветов и плодов; флавоны, флавонолы, ауроны, халконы определяют жёлтую и оранжевую окраску плодов и листьев. К группе флавоноидов относятся также природные антиоксиданты катехины. Флавоны - обычно находятся в виде своих гликозидов в соке растений, и именно их присутствие обусловливает собой всю гамму желтых оттенков в окраске последних. Флавон представляет собой бесцветные кристаллы, плохо растворяющиеся в воде, но хорошо растворимые во многих органических растворителях. Химическая формула флавона- C₁₅H₁₀O₂.
|
| Красный венгерский перец- источник флавоноидов |
Флавонолы- представляют собой класс флавоноидов, которые имеют 3- гидроксифлавоновую главную цепь. Их разнообразие обусловлено различными положениями фенольных групп –ОН.
Ауроны- название происходит от латинского aurum - золото. Ауроны придают растениям золотисто-желтый цвет, присутствующий в окраске цветов некоторых известных садовых растений. В природе ауроны распространены менее широко, чем другие флавоноиды и менее изучены. Молекулы ауронов могут образовывать два изомера, обозначаемые как Е-конфигурация и Z-конфигурация. 
В растениях чаще присутствуют Z ауроны, поскольку указанная конфигурация более устойчива. В растениях ауроны служат для защиты от грибковой и бактериальной инфекции, защиты от насекомых-вредителей, тогда как яркая окраска цветов, содержащих ауроны, может использоваться для привлечения насекомых-опылителей.
Халконы- соединения класса флавоноидов с незамкнутым пирановым кольцом. В индивидуальном виде кристаллические вещества жёлтой, оранжевой или оранжево-красной окраски. Встречаются в 9 семействах растений, в различных органах, как в виде агликонов, так и в виде гликозидов. Нередко входят в состав хромофорных комплексов, обусловливающих окраску цветков, к примеру, бутеин, характерный для семейства сложноцветных. Издавна были известны в виде пигментов из цветков сафлора.  .
.
Катехины — органические вещества из группы флавоноидов. Являются сильными антиоксидантами. Больше всего катехинов содержится в белом чае. В больших количествах они обнаружены во многих плодах и ягодах. Являясь сильным антиоксидантом, зелёный чай уменьшает количество свободных радикалов в организме человека, в определённой мере предотвращая возникновение рака.
Фитохром-голубой растительный пигмент белкового строения, контролирует процессы цветения и прорастания семян. Фитохром играет роль «биологических часов» растения, механизм действия пока не изучен. Известно, что строение пигмента меняется в зависимости от светлого и тёмного времени суток, сигнализируя об этом растению. Это вещество регулирует синтез белковых молекул-ДНК и РНК, образование хлорофилла, каротиноидов, антоцианов, органических фосфатов, витаминов. Фитохром связан с клеточными мембранами и встречается практически во всех органах растения.
Антохлор-пигмент жёлтого цвета. Встречается в клетках кожицы лепестков первоцвета, льнянки, жёлтого мака, георгины, в плодах лимонов и других растениях. Антофеин- редко встречающийся пигмент тёмного цвета, содержащийся в клеточном соке некоторых растений (например, в лепестках бобов, в околоцветнике некоторых орхидных) Антоцианы ( pH в вакуолях может варьировать от 4 до 6) Среди пигментов в растительном мире наиболее распространен антоциан. Он принадлежит к безазотистым соединениям, в растворенном состоянии входит в состав клеточного сока.
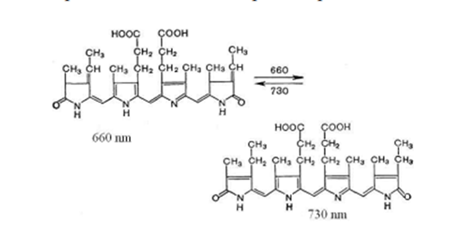
Антоциан встречается во всех органах растений: проростках, стеблях, листьях, цветках, пыльниках, пыльце, плодах, семенах. В зависимости от реакций, какие он претерпевает в клеточном соке с солями, кислотами, дубильными веществами, он придает различную окраску клеточному соку. Присутствие антоцианов в клеточном соке растений придает цветкам колокольчиков синий цвет, фиалок - фиолетовый, незабудок - небесно-голубой, тюльпанов, пионов, роз, георгинов - красный, а цветкам гвоздик, флоксов, гладиолусов - розовый. Почему же этот краситель является таким многоликим? Дело в том, что антоциан в зависимости от того, в какой среде он находится, способен быстро изменять свой оттенок. Соединения антоциана с кислотами имеют красный или розовый цвет, в нейтральной среде - фиолетовый, а в щелочной - синий. Разнообразие окраски цветков зависит от числа гидроксильных групп в молекулах антоцианов: с их увеличением окраска становится более синей. При метилировании гидроксилов образуется пигмент мальвидин, придающий лепесткам красный цвет. Антоцианы в клетках растений выполняют не только роль вещества, придающего их тканям яркую привлекательную окраску. Оказывается, что эти пигменты, появляющиеся в листьях и стеблях при воздействии пониженных температур, в ранневесенний и осенний периоды служат своего рода "ловушкой" солнечных лучей, избирательно работающим фильтром. Окраска растений полезна и для их защиты от избытка солнечного света. Поэтому в горной местности с увеличением высоты цветки имеют более яркую и плотную окраску. Существуют разнообразные методы извлечения антоциановых пигментов из растительного сырья экстрагентами различной природы: 1. Экстрагирование водой в присутствии лимонной или других минеральных кислот. Экстракцией называется извлечение одного или нескольких комнентов из сложного по составу сырья с помощью растворителя. 2. Выделение антоцианового пигмента спиртовым и водо-спиртовым растворами.
| Класс органических веществ | Типы соединений, содержащиеся в различных растениях, которые потенциально можно использовать в качестве индикаторов | Источник |
| Каратиноиды | Каротин | Богатым источником каротинов являются морковь, сладкий картофель, тыква, помидоры, грейпфруты, персики, слива, курага, крыжовник, черника. |
| Ксантофилл | Ксантофиллы наряду с другими каротиноидами являются дополнительными пигментами фотосинтеза и содержатся в основном в листьях растений. | |
| Хиноны | Хиноны | Содержится в растительных маслах, салате, капусте, желтке, злаки, овсянка. |
| Флавоноиды | Флавоноиды | Большое количество флавоноидов содержится в темных сортах винограда, вишне, гранатах, ежевике, клубнике, крыжовнике, лимоне, малине, облепихе, белой, красной и черной смородине, черешне, чернике, яблоках. |
| Ауроны | Ауроны это растительные флавоноиды, отвечающие за жёлтую окраску цветков таких как львиный зев и космея[4]. Ауроны состоят из 4'-хлор-2-гидроксиаурона (C15H11O3Cl) и 4'-хлораурона (C15H9O2Cl), которые также обнаружены в бурой глине Spatoglossum variabile[3]. | |
|
| Халконы | Сафлор красильный (жёлтый картамин — 2,4,4’5-тетраоксихалкон-б-гликозид, красный картамон — 4,4'-диокси-4’6,7-хинохалкон-6-гликозид). |
| Катехины | Они содержатся в темном шоколаде, яблоках, абрикосах, вишне, сливе, землянике, смородине, малине, шпинате, брокколи и многих других продуктах питания. | |
| Фитохром- голубой | Фитохром- голубой | голубой растительный пигмент белкового строения, контролирует процессы цветения и прорастания семян. У одних растений ускоряя цветение, у других — задерживая. |
| Антоциан | Антоциан | В кислой среде он обычно имеет красные тона, например, у герани, гортензии, фиалок. В щелочной эти растения приобретают сине-голубые тона. Если же к синему или фиолетовому раствору антоциана прибавить кислоту, раствор снова станет розовым. Красная окраска — у маков, роз, герани, синяя — у васильков, голубая — у колокольчиков обусловлена наличием пигмента антоциана. Плоды винограда, слив, терна, краснокочанной капусты, свеклы окрашены антоцианом. Считается, что антоциан защищает растения от низких температур, от вредного воздействия солнечного цвета на цитоплазму. |
Вывод: анализ литературы привел к выводу, что лучшими вещества, которые легко меняют свою окраску это антоцианы. Поэтому, в своем исследовании нами использованию вишня, смородина, свекла, чай каркаде.
Параметры процесса.
Требования предъявляются к индикаторам, применяемым в кислотно-основном титровании. Ценность индикатора.
Для фиксации точки стехиометричности в кислотно-основном титровании используют:
Инструментальные способы (потенциометрическое титрование).
Индикаторные способы.
Кислотно-основные (рН – индикаторы, цветные индикаторы) - органические кислоты или основания, изменяющие свою окраску при нейтрализации кислоты или основания в точке стехиометричности или вблизи нее.
Требования, предъявляемые к ним:
Изменение окраски индикатора должно проходить в узком интервале рН.
Окраска должна изменяться резко и близи точки стехиометричности.
Окраска должна быть интенсивной.
Изменение окраски должно быть обратимым.
Количество рабочего раствора, изменяющего окраску индикатора, должно быть небольшим, чтобы не искажались результаты анализа.
Титрование раствора уксусной кислоты, в присутствии индикаторов Приготовление растительных индикаторов и исследование их свойств
Для приготовления растительных индикаторов выбрали следующие методы:
Приготовление индикаторов из ягодного сахарного сиропа и свежих ягод.
Цель: приготовление вытяжки антоцианов.
Оборудование:сироп чёрной смородины; свежие ягоды -смородина, сок вишни, свеклы дистиллированная вода, спирт, пробирка, фильтровальная бумага, фильтр.
Ход опыта: а) Берут сахарный сироп из чёрной смородины. Добавляют 10 мл воды и настаивают в течении 30 мин. Затем отфильтровывают раствор через бумажный фильтр в чистую пробирку.
б) Из свежего сырья индикаторы изготавливают следующим способом. Плоды и ягоды разотрем в чашке с небольшим количеством песка и добавим несколько миллилитров спирта. После этого экстракт нейтрализуем мелом, так как сок растений чаще всего кислый.
Наблюдение: происходит окрашивание раствора.
Вывод: Цвет раствора убеждает в том, что антоцианы - водорастворимые пигменты.
Приготовление индикатора из листьев краснокочанной капусты.
Цель: приготовление вытяжки антоцианов.
Оборудование: листья краснокочанной капусты, дистиллированная вода; пробирка, фильтровальная бумага, фильтр, спиртовка, колба.
Ход опыта: листья краснокочанной капусты, измельчаем и помещаем в колбу и заливали этиловым спиртом. Антоцианы свободно выходят из клеток, окрашивают раствор. Затем раствор охлаждают и отфильтровывают через бумажный фильтр в чистую пробирку.
Вывод: цвет раствора убеждает в том, что антоцианы - водорастворимые пигменты.
Экспериментальное подтверждение индикаторных свойств отвара листьев краснокочанной капусты, сока вишни, настоя смородины, сока свеклы, чая каркаде.
Цель: доказать, что цвет пигментов зависит от рН среды.
Ход опыта: К двум образцам отвара добавляем кислоту и щелочь, третий образец для сравнения.
Наблюдение: При добавлении кислоты цвет изменился на красный, при добавлении щёлочи - на зелёный.
| № | Объект исследования | Среда | ||
| кислая | нейтральная | щелочная | ||
| 1. | Каркаде |
| ||
| 2. | Черная смородина |
| ||
| 3. | Вишня |
| ||
| 4. | Свекла |
| ||
| 5 | Краснокочанная капуста |
| ||
Вывод: все испытуемые растения обладает индикаторными свойствами.
Кислотно-основное титрование с полученными индикаторами.
Титрование 0,1 молярным раствором гидроксида натрия- титрант, 0,1 молярного раствора уксусной кислоты- аналит, в присутствии полученных индикаторов. Раствор гидроксида натрия готовили по фиксаналу. Каждый образец титровали 3 раза, потом рассчитывали средний объем гидроксида натрия.
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии настоя чая каркаде.
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Каркаде | 2 | 1.4 | 0,07 |
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии настоя ягод смородины черной.
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Настой ягод смородины черной | 2 | 1.8 | 0,09 |
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии сока свёклы.
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Сок свёклы | 2 | 3.3 | 0,165 |
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии сока вишни.
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Сок вишни | 2 | 1,7 | 0.085 |
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии спиртового настоя краснокочанной капусты.
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Спиртовой настой листьев краснокочанной капусты | 2 | 1,8 | 0,09 |
Титрование 0,1 молярным раствором гидроксида натрия 0,1 молярного раствора уксусной кислоты, в присутствии спиртового раствора фенолфталеина
| Индикатор | Объем уксусной кислоты, мл | Средний объем 0,1 Н NaOH раствора, мл | Расчетная концентрация уксусной кислоты |
| Спиртовой раствор фенолфталеина | 2 | 1,9 | 0,095 |
Калибрование растительных индикаторов.





Изменение цвета растворов кислот и солей в присутствии спиртового настоя краснокочанной капусты.

Изменение цвета растворов кислот и солей в присутствии настоя смородины черной.

Изменение цвета растворов кислот и солей в присутствии настоя чая каркаде.

Изменение цвета растворов кислот и солей в присутствии сока свёклы.
Изменение цвета растворов кислот и солей в присутствии сока вишни
6. Эффективность технологической схемы. Коммерческая доступность.
| № | Сырье | Масса, г | Получено сока, л | Длительности процесса получения индикатора | Стоимости готового продукта с учётом затрат на все дополнительные реактивы и оборудование |
| 1. | Вишня | 1000 | 0.6 | 10 минут | 430 р |
| 2. | Смородина | 1000 | 0.8 | 10 -15 минут | 1000 р, |
| 3. | Каркаде |
|
| 2-3 минуты, настоять пакетик в кипятке | Пакетики хранятся долго, отвар начинает портится через 24 часа |
| 4. | Свёкла | 1000 | 0.250 | 20-30 минут | 40 р |
| 5. | Краснокочанная капуста | 1000 | 1000 | Нашинковать – 10 минут, настоять 30 минт | 43 р + 240 р водка=283 р |
| № | Сырье | Безопасность процесса получения и применения индикаторов | Эффективность получаемых растительных индикаторов по сравнению с классическими синтетическими индикаторами кислотно-основного титрования | Длительность хранения и использования растительных индикаторов
| Возможные варианты использования отходов получения индикаторов из растительного сырья. |
| 1. | Вишня | безопасен | Хорошо работает только в щелочных средах | долго не хранится, начинается процесс брожения | Изготовление пастилы, вина, изготовление пектинов |
| 2. | Смородина | безопасен | Хорошо работает в щелочных средах | долго не хранится, начинается процесс брожения | Изготовление пастилы, вина, изготовление пектинов |
| 3. | Каркаде | безопасен | Хорошо работает в щелочных средах | долго не хранится, начинается процесс зарастания поверхности грибами. плюс дешевый и быстро готовится | Изготовление кубиков льда и применение в косметологии |
| 4. | Свёкла | безопасен | Хорошо работает в щелочных средах | Самый не чувствительный из всех испытуемых индикаторов. Плюс- дешевый, минус- осторожно надо работать при приготовлении сока | Жмых свёклы представляет собой свекольную стружку, из которой отжата большая часть жидкости.. Жмых можно использовать для приготовления отдельных блюд, таких как свекольные шарики, оладьи, запеканки. Продукт можно добавлять в супы, соусы, овощные салаты. Жмых свёклы иногда используют для приготовления оригинальной выпечки. Свежую свекольную стружку допустимо добавлять в овощные и сливочные коктейли, смузи. |
| 5. | Краснокочанная капуста | безопасен | Отлично работает во всех средах | Самый чувствительный растительный индикатор. Быстро готовится и долго хранится в виде спиртового раствора. | Капустный квас. заморозить и применять для приготовления щей. |

–Предложите варианты масштабирования и улучшения предложенной вами технологии
На наш взгляд лучшим индикатором является спиртовой раствор антоциана краснокочанной капусты, хранится достаточно долго и работает качественно. Переход цветов четкий и можно использовать для определения рН растворов.
Литература.
1.Бишоп Э. Индикаторы. В 2-х т. Т. 1. / Э. Бишоп. – М.: Мир, 1976. – 483 с
2. Бишоп Э. Индикаторы. В 2-х т. Т. 2. / Э. Бишоп. – М.: Мир, 1976. – 437 с
3. Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1: Титриметрические и гравиметрический методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. / В.П. Васильев. – М.: Дрофа, 2005. – 336 с.
4. Домина Н.Г. Аналитическая химия. Химические методы анализа. Учебное пособие / Н.Г. Домина и др.– Барнаул: Типография АлтГТУ, 2010. – 176 с.
5. Золотов Ю.А. Основы аналитической химии. В 2 кн .; Кн. 2. Методы химического анализа / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева.– М.: Высшая школа, 2002. – 461 с.
6. Манахова С.В. Основы количественного анализа: учеб. пособие / С.В. Манахова, Н.В. Шкаева. – Архангельск: Северный (Арктический) федеральный университет, 2010. – 128 с.
7. Фримантл М. Химия в действии. В 2-х ч. Ч. 1: Пер. с англ. Учебное пособие / М. Фримантл. — М.: Мир, 1998 — 528 с.
Отто М. Современные методы аналитической химии. В 2-х томах.; Том I. / М. Отто. — М.: Техносфера, 2003. — 416 с.
33

 Получите свидетельство
Получите свидетельство Вход
Вход


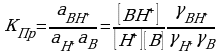 .
.














 Растительные индикаторы (2.54 MB)
Растительные индикаторы (2.54 MB)
 0
0 531
531 1
1 Нравится
0
Нравится
0


