Муниципальное общеобразовательное учреждение
Иконниковская средняя общеобразовательная школа
Красносельского района Костромской области
« Согласовано» « Утверждаю»
Зам. директора по УВР: Директор школы:
___________________ _____________________
/ Г.Г.Смирнова / / И.В. Ермолина /
«____» _____________ 2014г. «____»__________ 2014г.
Приказ №53 от «29» августа 2014г.
РАБОЧАЯ ПРОГРАММА ПО ХИМИИ
Период освоения программы – 2 года
Ступень обучения ( класс) – основное общее
Количество часов - 136
Уровень - базовый
Рабочая программа учебного курса по химии 8-9 классов разработана
на основе Примерной программы основного общего образования по химии (базовый уровень)
(М. «Просвещение» 2011г.) и авторской программы О.С.Габриеляна,
соответствующей Федеральному компоненту государственного стандарта основного общего образования и допущенной Министерством образования и науки Российской Федерации
(О.С.Габриелян. Программа курса химии для 8-11 классов
общеобразовательных учреждений. Дрофа, М.: 2011 г.).
Иконниково
Содержание:
1. Пояснительная записка……………………………………………………………………………………..2
2. Общая характеристика учебного предмета «химия» ………………………………………………2-3
3. Учебно- методическое обеспечение …………………………………………………………………….3-4
4. Содержание программы по классам ………………………………………………………………………4-8
5. Планируемые результаты освоения химии …………….………..…………………………………..8-10
6. Формы, методы и средства обучения при реализации программы………………… ……………10
7. Место учебного предмета в учебном плане ……………………………………………………………….10
8. Материально-техническое обеспечение……………………………………………………………..11-12
9. Нормы оценок…………………………………………………………………………………………….12-13
10. Контрольно-измерительные материалы…………………………………………………………13-15
11.Учебно - тематическое планирование……………..………………………………………………15-17
● Пояснительная записка
Исходными документами для составления примерной рабочей программы явились:
Закон «Об образовании»;
Федеральный компонент государственного стандарта общего образования, утвержденный приказом Минобразования РФ № 1089 от 09.03.2004;
Федеральный перечень учебников, рекомендованных (допущенных) Министерством образования к использованию в образовательном процессе в образовательных учреждениях, реализующих образовательные программы общего образования ;
Примерная программа основного общего образования по химии (базовый уровень);
Авторская программа О.С.Габриеляна, соответствующая Федеральному компоненту Государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации (О.С.Габриелян. Программа курса химии для 8-11 классов общеобразовательных учреждений. Дрофа, М.: 2011 г.).
Цели изучения курса
Изучение химии в основной школе направлено на достижение следующих целей:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Задачами изучения учебного предмета «Химия» являются:
учебные: формирование системы химических знаний как компонента естественнонаучной картины мира;
развивающие: развитие личности обучающихся, их интеллектуальное и нравственное совершенствование, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и в трудовой деятельности;
воспитательные: формирование умений безопасного обращения с веществами, используемыми в повседневной жизни; выработка понимания общественной потребности в развитии химии, а также формирование отношения к химии как к возможной области будущей практической деятельности.
● Общая характеристика учебного предмета «Химия»
В соответствии с Федеральным государственным образовательным стандартом основного общего образования учащиеся должны овладеть такими познавательными учебными действиями, как умение формулировать проблему и гипотезу, ставить цели и задачи, строить планы достижения целей и решения поставленных задач, проводить эксперимент и на его основе делать выводы и умозаключения, представлять их и отстаивать вою точку зрения. Кроме этого, учащиеся должны овладеть приемами, связанными с определением понятий: ограничивать их, описывать, характеризовать и сравнивать. Следовательно, при изучении химии в основной школе учащиеся должны овладеть учебными действиями, позволяющими им достичь личностных, предметных и метапредметных образовательных результатов.
Предлагаемая программа по химии раскрывает вклад учебного предмета в достижение целей основного общего образования и определяет важнейшие содержательные линии предмета:
· вещество — знания о составе и строении веществ, их важнейших физических и химических свойствах, биологическом действии;
· химическая реакция — знания об условиях, в которых проявляются химические свойства веществ, способах управления химическими процессами;
· применение веществ — знания и опыт практической деятельности с веществами, которые наиболее часто употребляются в повседневной жизни, широко используются в промышленности, сельском хозяйстве, на транспорте;
· язык химии — система важнейших понятий химии и терминов, в которых они описываются, номенклатура неорганических веществ, т. е. их названия (в том числе и тривиальные), химические формулы и уравнения, а также правила перевода информации с естественного языка на язык химии и обратно.
● Учебно – методическое обеспечение
Для учащихся:
| Класс | Автор, название | Издательство, год |
|
8 | Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений. | М.: Дрофа, 2010.
|
| Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 кл. Дидактические материалы. | М.: Блик плюс, 2003.
|
| О.С. Габриелян, А.В. Яшукова «Рабочая тетрадь» к учебнику О.С. Габриеляна «Химия.8» | Дрофа, Москва 2005.
|
| Габриелян О.С., Воскобойникова Н.П. Химия в тестах, задачах, упражнениях. 8 – 9 кл. | М.: Дрофа, 2005.
|
|
9 | Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений | М.: Дрофа, 2010. |
| Габриелян О.С., Смирнова Т.В. Изучаем химию в 9 кл.: Дидактические материалы. | М.: Блик плюс, 2004.
|
| О.С. Габриелян, А.В. Яшукова «Рабочая тетрадь» к учебнику О.С. Габриеляна «Химия.9» | Дрофа, Москва 2004.
|
| Габриелян О.С., Воскобойникова Н.П. Химия в тестах, задачах, упражнениях. 8 – 9 кл. | М.: Дрофа, 2005.
|
| КИМ Химия 9 класс. Составитель Е.Н. Стрельникова. | Москва «ВАКО»2014 г |
| А.А. Каверина, Р.Г. Иванова, Д.Ю. Добротин Система заданий 8-9 классы. | М.: Просвещение 2013 г. |
| Для учителя:
| Программно-методические материалы. 1.Стандарт основного общего образования(базовый уровень) 2.Оценка качества подготовки выпускников основной школы по химии; 3.Рабочая программа по химии для 8-11 классов. Составитель В.Е. Морозов .
4.Примерные программы по учебным предметам. Химия. Литература: Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. настольная книга учителя. Химия. 8,9 класс Методическое пособие. Н.П. Троегубова «Поурочные разработки по химии»8 класс. М.Ю. Горковенко «Поурочные разработки по химии» 9 класс. О.С. Габриелян, П.В. Решетов, И.Г. Остроумов «Задачи по химии и способы их решения» А.И. Врублевский «Решение заданий химических превращений» с тестовым самоконтролем. С.В. Бочарова «Занимательные материалы по химии 8 класс» Е.В. Тяглова «Исследовательская деятельность учащихся по химии». О.С. Аранская, И.В. Бурая «Проектная деятельность школьников в процессе обучения химии»8-11 классы. В.Г. Денисова «Мастер-класс учителя химии».+ CD диск В.Г. Денисова «Мастер-класс учителя химии ВЫПУСК №2», «Химия элементов».+CD диск Г.И. Штремплер, Г.А. Пичугина «Дидактические игры при обучении химии». А.А. Журин «поурочное тематическое планирование по химии 8 класс» А.А. Журин «поурочное тематическое планирование по химии 9 класс» Учебно- методическая литература для подготовки к ОГЭ : Тесты. Химия 9 класс. Варианты и ответы централизованного (итогового)тестирования.
Р.Г. Иванова, А.С. Корощенко, А.В. Яшукова ГИА 2011. В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. Подготовка к ГИА – 2013. В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. Подготовка к ГИА – 2014. Легион Ростов-на-Дону 2013 В.В. Еремин Химия. Подготовка к ГИА в 2014 году.
И.Е. Баронова «Пособие для интенсивной подготовки к экзамену по химии»
|
– 2-е изд., доп, испр.-М.:Глобус, 2009.-221с. – (Образовательный стандарт). Москва «Просвещение» 2011 г.
М.: Дрофа, 2008г
Москва «ВАКО» 2012.
Москва «ВАКО» 2005.
Москва, Дрофа.2004
Минск. ООО «Юнипресс» 2003
Издательско-торговый дом «Корифей». Волгоград. 2006 Москва « Глобус» 2007
Москва Издательский центр «Вентана – Граф» 2005 Москва «Планета» 2010
Москва «Планета» 2011
Москва. Дрофа 2003
Москва Просвещение 2013
Москва Просвещение 2013
–М.: Федеральное государственное учреждение «Федеральный центр тестирования», 2005
Москва Дрофа 2011
Легион Ростов-на-Дону 2013
Легион Ростов-на-Дону 2013
Москва. Издательство МЦНМО 2014.
Москва «ВАКО» 2007
|
● Содержание программы по классам
Содержание тем учебного курса химии в 8 классе
| Модуль1. Введение – 5 часов |
| Вводный инструктаж. Предмет химии. Вещества. |
|
| Практическая работа №1.Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами. |
|
| Превращения веществ. Роль химии в жизни человека. Химическая символика. Периодическая система Д.И. Менделеева. |
|
| Относительные атомная и молекулярная массы. Расчетные задачи по химической формуле. |
|
| Расчетные задачи: 1. Нахождение относительной молекулярной массы вещества по химической формуле.2.Вычисление массовой доли химического элемента в веществе по его формуле. Модуль 2. Атомы химических элементов – 9 часов |
|
| Основные сведения о строении атома. |
|
| Изотопы. |
|
| Электроны и их расположение по энергетическим уровням элементов № 1 – 20. |
|
| Периодическая система и строение атома. |
|
| Ионы, ионная связь. |
|
| Ковалентная неполярная связь. |
|
| Электроотрицательность. Ковалентная полярная связь. |
|
| Металлическая связь. |
|
| Коррекционные упражнения по теме «Атомы химических элементов». |
|
| Контрольная работа №1 по теме «Атомы химических элементов». |
|
| Модуль 3. Простые вещества – 7 часов |
|
| Простые вещества металлы. |
|
| Простые вещества неметаллы. Аллотропия. |
|
| Количество вещества. Моль. Молярная масса вещества. |
|
| Молярный объем газообразных веществ. |
|
| Решение задач с использованием понятий: количество вещества, молярная масса. |
|
| Решение задач с использованием понятий: молярный объем газов, число Авогадро. |
|
| Контрольная работа №2 по теме «Простые вещества» |
|
| Расчетные задачи:1. Вычисление молярной массы веществ по химическим формулам. 2. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов », «постоянная Авогадро». Модуль 4. Соединения химических элементов – 15 часов |
|
| Степень окисления. |
|
| Важнейшие классы бинарных соединений. |
|
| Основания. |
|
| Кислоты. |
|
| Соли. |
|
| Коррекционные упражнения по важнейшим классам бинарных соединений. |
|
| Кристаллические решетки. |
|
| Чистые вещества и смеси. |
|
| Практическая работа №2.Анализ почвы и воды. |
|
| Массовая и объемная доли компонентов смеси. |
|
| Количественные расчеты, связанные с понятием «доля». |
|
| Практическая работа № 3.Приготовление раствора сахара и определение массовой доли его в растворе. |
|
| Контрольная работа №3 по теме «Соединения химических элементов» |
|
| Лабораторные работы:1. Знакомство с образцами веществ разных классов.2.Разделение смесей. Модуль 5. Изменения, происходящие с веществами – 12 часов |
|
| Физические явления в химии. |
|
| Практическая работа №4. Наблюдения за изменениями, происходящими с горящей свечой. |
|
| Химические реакции. |
|
| Химические уравнения. Реакции разложения. |
|
| Реакции соединения. |
|
| Реакции замещения. |
|
| Реакции обмена . |
|
| Практическая работа №5. Признаки химических реакций. |
|
| Типы химических реакций на примере свойств воды. |
|
| Решение расчетных задач по химическим уравнениям. |
|
| Решение расчетных задач по химическим уравнениям. |
|
| Обобщение по теме «Изменения, происходящие с веществами» |
|
| Контрольная работа №4 по теме «Изменения, происходящие с веществами» |
|
| Лабораторные работы: № 3. Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. №4. Окисление меди в пламени спиртовки. № 5. Помутнение известковой воды от выдыхаемого углекислого газа. № 6. Получение углекислого газа взаимодействием соды и кислоты. №7. Замещение меди в растворе хлорида меди (ІІ) железом. Модуль 6. Растворение. Растворы. Свойства растворов электролитов – 20 часов |
|
| Растворение. Растворимость. Типы растворов. |
|
| Электролитическая диссоциация. Основные положения. |
|
| Ионные уравнения. |
|
| Кислоты в свете ТЭД. |
|
| Коррекционные упражнения по кислотам. |
|
| Основания в свете ТЭД. |
|
| Коррекционные упражнения по основаниям. |
|
| Оксиды. |
|
| Коррекционные упражнения по оксидам. |
|
| Соли в свете ТЭД. |
|
| Коррекционные упражнения по солям. |
|
| Практическая работа №6. Свойства кислот, оснований, оксидов и солей. |
|
| Практическая работа №7. Решение экспериментальных задач. |
|
| Генетическая связь между классами неорганических соединений. |
|
| Окислительно-восстановительные реакции. |
|
| Упражнения в составлении ОВР методом электронного баланса. |
|
| Свойства веществ изученных классов в свете ОВР. |
|
| Решение упражнений по теме «Растворение. Растворы. Свойства растворов электролитов». |
|
| Контрольная работа №5 по теме «Растворение. Растворы. Свойства растворов электролитов». Лабораторные работы: № 8. Реакции, характерные для растворов кислот. № 9. Реакции, характерные для растворов щелочей. № 10. Получение и свойства нерастворимого основания. № 11. Реакции, характерные для растворов солей. № 12. Реакции, характерные для основных оксидов. № 13. Реакции, характерные для кислотных оксидов. |
|
Содержание тем учебного курса химии в 9 классе
Повторение основных вопросов курса 8 класса и введение в курс 9 класса.( 6 ч.)
ТБ на уроках химии. Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделеева.
Свойства оксидов, кислот, оснований и солей в свете ТЭД.
Свойства оксидов, кислот, оснований и солей в свете ТЭД.
Окислительно-восстановительные реакции.
Понятие о переходных элементах. Амфотерность.
Периодический закон и ПСХЭ Д.И.Менделеева.
Лабораторная работа №1: Получение и свойства Zn(OH)2
Тема №1: Металлы (18 ч.)
Положение металлов в ПСХЭ Д.И.Менделеева. Металлическая кристаллическая решетка и металлическая связь. Общие физические свойства металлов.
Сплавы, их свойства и значение.
Химические свойства металлов.
Практическая работа №1:Осуществление цепочки химических превращений.
Способы получения металлов.
Коррозия металлов и способы борьбы с ней.
Общая характеристика щелочных металлов: строение атомов, получение, свойства, важнейшие соединения и их значение.
Общая характеристика элементов главной подгруппы II группы: строение атомов, получение, свойства, важнейшие соединения и их значение.
Алюминий: строение атома, получение, свойства, его важнейшие соединения и их значение.
Железо: строение атома, получение, его свойства, важнейшие соединения и их значение.
Генетические ряды Fe3+ и Fe2+. Качественные реакции на Fe3+ и Fe2+.
Практическая работа №2:Получение и свойства соединений металлов.
Практическая работа №3: Экспериментальные задачи по распознаванию и получению веществ.
Лабораторные работы:
№2: Ознакомление с образцами металлов
№3: Взаимодействие металлов с растворами кислот и солей.
№4: Ознакомление с образцами природных соединений: а) натрия; б)кальция; в) алюминия; в) железа.
№5: Получение и свойства Al(OH)3
Тема №2: Неметаллы. (26 ч).
Общая характеристика неметаллов: положение в ПС, строение атомов, электроотрицательность.
№
6: Качественные реакции на Fe3+ и Fe2+.
Кристаллическое строение. Аллотропия. Физические свойства неметаллов.
Водород: положение в ПС, строение атома и молекулы, физ. и хим. свойства, получение и применение.
Общая характеристика галогенов. Простые вещества: свойства, получение, применение.
Соединения галогенов, их свойства.
Решение задач на избыток, недостаток по теме «Галогены».
Сера: аллотропия, свойства и применение.
Оксиды серы (IV) и (VI), их получение, свойства.
Сероводородная и сернистая кислоты.
Серная кислота и её соли. Применение серной кислоты и её солей.
Практическая работа №4: Экспериментальные задачи по теме:»Подгруппа кислорода»
Азот: строение атома, молекулы, свойства простого вещества
Аммиак: строение, свойства, получение и применение.
Соли аммония, их свойства и применение.
Оксиды азота (II), (ІV).
Азотная кислота, ее свойства и применение.
Нитраты и нитриты. Азотные удобрения
Строение, свойства и применение фосфора.
Оксид фосфора, фосфорная кислота, фосфаты и удобрения на их основе.
Строение, свойства и применение углерода.
Кислородные соединения углерода.
Практическая работа № 5. « Получение, собирание и распознавание газов».
Кремний: строение, свойства, его соединения, их применение.
Практическая работа № 3. Экспериментальные задачи по теме «Подгруппы азота и углерода».
Лабораторные опыты:
Л.О.7 Качественная реакция на хлорид -ион.
Л.О.8 Качественная реакция на сульфат-ион.
Л.О.9 Распознавание солей аммония.
Л.О. 10 Получение СО2 и его распознавание.
Л.О.11 Качественная реакция на карбонат-ион.
Л.О. 12.Ознакомление с природными силикатами.
Л.О.13. Ознакомление с продукцией силикатной промышленности.
Тема№3:Органические вещества.(10ч).
Вещества органические и неорганические. Причины многообразия и хим. строение органических соединений.
Теория строения органических соединений Бутлерова А.М.
Понятие о гомологическом ряде.
Метан и этан: строение молекул, горение, разложение, применение.
Этилен: строение молекулы, реакции гидратации, полимеризации. Полиэтилен.
Понятие о спиртах: метанол, этанол, глицерин.
Понятие об альдегидах на примере этаналя.
Понятие о карбоновых кислотах на примере уксусной и стеариновой.
Понятие о сложных эфирах и жирах. Реакция этерификации.
Понятие об аминокислотах и белках, их биологическая роль.
Углеводы.
Лабораторные работы:
Л.О.14 Изготовление моделей молекул
Л.О. 15Свойства глицерина
Л.Р.16-17 Взаимодействия: а)глюкозы с гидроксидом меди(II), Б) крахмала с иодом.
Тема №4: Обобщение знаний по химии за курс основной школы.(8ч).
Периодический закон и строение атома.
Типы химических связей и кристаллические решетки.
Классификация химических реакций по различным признакам.
Свойства металлов и неметаллов.
Генетические ряды металлов, неметаллов, переходных элементов.
Свойства оксидов, кислот, оснований, солей.
● Планируемые результаты освоения курса химии
Требования к уровню подготовки учащихся 8 класса:
В результате изучения химии ученик должен:
Знать:
▪ химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
▪важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация, химический элемент, относительные атомная и молекулярная массы, ион, молярная масса, молярный объем, окислитель и восстановитель, окисление и восстановление;
▪основные законы химии: закон сохранения массы веществ, постоянства состава, периодический закон.
Уметь:
▪ называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
▪ объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в Периодической системе Д. И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
▪ характеризовать: химические элементы (от водорода до кальция) на основе их положения в Периодической системе Д. И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
▪ определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
▪ составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов Периодической системы; уравнения химических реакций;
▪ обращаться с химической посудой и лабораторным оборудованием;
▪ распознавать опытным путем: кислород, водород, углекислый газ, аммиак, растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
▪ вычислять: массовую долю химического элемента по формуле соединения, массовую долю растворенного вещества в растворе, количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для :
▪ для безопасного обращения с веществами и материалами;
▪ экологически грамотного поведения в окружающей среде;
▪ оценки влияния химического загрязнения окружающей среды на организм человека;
▪ критической оценки информации о веществах, используемых в быту;
▪ приготовления растворов заданной концентрации.
Требования к уровню подготовки выпускников:
В результате изучения химии ученик должен:
Знать/Понимать:
- химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
- важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
- основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
Уметь:
- называть: химические элементы, соединения изученных классов;
- объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
- характеризовать: химические элементы (от водорода до кальция) на основе их положения в Периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
- определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
- составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов Периодической системы Д.И. Менделеева; уравнения химических реакций;
- обращаться с химической посудой и лабораторным оборудованием;
- распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы;
- вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- безопасного обращения с веществами и материалами;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека;
- критической оценки информации о веществах, используемых в быту;
- приготовления растворов заданной концентрации.
● Формы, методы и средства обучения при реализации программы
| Образовательные технологии | Метод проектов в обучении и воспитании; Личностно - ориентированные технологии; Информационные технологии; Коммуникационные и развивающие технологии; Технология развития критического мышления; Технология исследовательского обучения; Модульная технология обучения; Технология эвристического обучения. |
| Формы организации учебного процесса:
| индивидуальные; групповые; фронтальные; практические работы лабораторные опыты |
| Методы обучения | |
| Средства обучения | Словесные средства: учебники и другие тексты. Простые визуальные средства: реальные предметы, модели, изображения и пр. Сложные средства: Компьютер.. Аудиовизуальные средства: видеофильмы. |
| Формы контроля ЗУН :
| наблюдение; беседа; фронтальный опрос; контрольные работы тестирование проверочные работы |
● Место учебного предмета в учебном плане
Особенностью содержания курса «Химия» являются то, что в базисном учебном (образовательном) плане этот предмет появляется последним в ряду изучения естественнонаучных дисциплин. Данная необходимость освоения объясняется тем, что школьники должны обладать не только определенным запасом предварительных естественнонаучных знаний, но и достаточно хорошо развитым абстрактным мышлением. Учащимися уже накоплены знания по смежным дисциплинам цикла: биологии, физики, математики, географии, сформировались умения анализировать, вести наблюдения, сравнивать объекты наблюдения.
В соответствии с учебным планом на изучение химии в 8 и 9 классах отводится по 2 часа в неделю. В соответствии со сложившейся практикой организации основного общего образования в образовательных учреждениях общего образования реальная продолжительность учебного года составляет 34 учебные недели. Таким образом, время, выделяемое рабочими учебными планами на изучение химии в 8 и 9 классах на практике равно по 68 часов.
● Материально-техническое обеспечение:
Для обучения учащихся основной школы в соответствии с требованиями Федерального государственного образовательного стандарта необходима реализация деятельностного подхода. Деятельностный подход требует постоянной опоры процесса обучения химии на демонстрационный эксперимент, практические занятия и лабораторные опыты, выполняемые учащимися. Кабинет химии оснащён комплектом демонстрационного и лабораторного оборудования по химии для основной школы. В кабинете химии осуществляются как урочная, так и внеурочная формы учебно-воспитательной деятельности с учащимися. Оснащение в большей части соответствует Перечню оборудования кабинета химии и включает различные типы средств обучения. Большую часть оборудования составляют учебно-практическое и учебно-лабораторное оборудование, в том числе комплект натуральных объектов, модели, приборы и инструменты для проведения демонстраций и практических занятий, демонстрационные таблицы.В комплект технических и информационно-коммуникативных средств обучения входят: компьютер.
Натуральные объекты
Натуральные объекты, используемые в обучении химии, включают в себя коллекции минералов и горных пород, металлов и сплавов, минеральных удобрений, пластмасс, каучуков, волокон и т. д.
Ознакомление учащихся с образцами исходных веществ, полупродуктов и готовых изделий позволяет получить наглядное представление об этих материалах, их внешнем виде, а также о некоторых физических свойствах.
Химические реактивы и материалы
Обращение со многими веществами требует строгого соблюдения правил техники безопасности, особенно при выполнении опытов самими учащимися. Все необходимые меры предосторожности указаны в соответствующих документах и инструкциях.
Химическая лабораторная посуда, аппараты и приборы
Химическая посуда подразделяется на две группы: для выполнения опытов учащимися и демонстрационных опытов.
Приборы, аппараты и установки, используемые на уроках химии, подразделяют на основе протекающих в них физических и химических .
Модели
Объектами моделирования в химии являются атомы, молекулы, кристаллы, заводские аппараты, а также происходящие процессы.
В преподавании химии используются модели кристаллических решёток графита, поваренной соли, наборы моделей атомов для составления шаростержневых моделей молекул.
Учебные пособия на печатной основе
В процессе обучения химии используются следующие таблицы постоянного экспонирования: «Периодическая система химических элементов Д.И. Менделеева», «Таблица растворимости кислот, оснований и солей», «Электрохимический ряд напряжений металлов», «Круговорот веществ в природе» и др.
Для организации самостоятельной работы обучающихся на уроках используют разнообразные дидактические материалы: отдельные рабочие листы — инструкции, карточки с заданиями разной степени трудности для изучения нового материала, самопроверки и контроля знаний учащихся.
Для обеспечения безопасного труда кабинете химии имеется:
противопожарный инвентарь
аптечка с набором медикаментов и перевязочных средств;
инструкции по правилам безопасности труда для обучающихся
журнал регистрации инструктажа по правилам безопасности труда.
Наличие демонстрационного и лабораторного оборудования - СМ. Паспорт кабинета «Химии»
● Нормы оценок
Устный ответ
Оценка «5» - ответ полный, правильный, самостоятельный, материал изложен в определенной логической последовательности.
Оценка «4» - ответ полный и правильный, материал изложен в определенной логической последовательности, допущены две-три несущественные ошибки, исправленные по требованию учителя.
Оценка «3» - ответ полный, но допущены существенные ошибки или ответ неполный.
Оценка «2» - ученик не понимает основное содержание учебного материала или допустил существенные ошибки, которые не может исправить даже при наводящих вопросах учителя.
Расчетные задачи
Оценка «5» - в логическом рассуждении нет ошибок, задача решена рациональным способом.
Оценка «4» - в рассуждении нет ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Оценка «3» - в рассуждении нет ошибок, но допущена ошибка в математических расчетах.
Оценка «2» - имеются ошибки в рассуждениях и расчетах.
Экспериментальные задачи
Оценка «5» - правильно составлен план решения, подобраны реактивы, дано полное объяснение и сделаны выводы.
Оценка «4» - правильно составлен план решения, подобраны реактивы, при этом допущено не более двух ошибок (несущественных) в объяснении и выводах.
Оценка «3» - правильно составлен план решения, подобраны реактивы, допущена существенная ошибка в объяснении и выводах.
Оценка «2» -допущены две и более ошибки в плане решения, в подборе реактивов, выводах.
Практическая работа
Оценка «5» - работа выполнена полностью, правильно сделаны наблюдения и выводы, эксперимент осуществлен по плану, с учетом техники безопасности, поддерживается чистота рабочего места, экономно расходуются реактивы.
Оценка «4»- работа выполнена полностью, правильно сделаны наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Оценка «3»- работа выполнена не менее чем на половину или допущены существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, но исправляются по требованию учителя.
Оценка «2»- допущены две или более существенные ошибки, учащийся не может их исправить даже по требованию учителя.
Контрольная работа
Оценка «5» - работа выполнена полностью, возможна несущественная ошибка.
Оценка «4» - работа выполнена полностью, допущено не более двух несущественных ошибок.
Оценка «3» - работа выполнена не менее чем наполовину, допущена одна существенная или две несущественные ошибки.
Оценка «2» - работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
● Контрольно-измерительные материалы
8 класс: Тест по теме: «Атомы химических элементов. Изотопы» Вариант 1.
Атом любого химического элемента заряжен:
1) положительно; 2) отрицательно; 3) нейтрально; 4) не знаю.
Количество энергетических уровней в атоме определяется:
1) по номеру группы; 2) по порядковому номеру; 3) по номеру периода; 4) по номеру ряда.
Количество электронов в атоме на последнем энергетическом уровне определяется:
1) по номеру группы; 2) по порядковому номеру; 3) по номеру периода; 4) по номеру ряда.
Верны ли следующие суждения? А) Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Б) Изотопы – это атомы одного химического элемента, имеющие разные относительные атомные массы.
1) верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
Число протонов в изотопе атома скандия 45Sc (порядковый номер 21):
1) 4; 2) 45; 3) 24; 4) 21.
Число нейтронов в изотопе атома мышьяка 75As (порядковый номер 33):
1) 42; 2) 48; 3) 25; 4) 70.
Изотопами являются:
1) 39K и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K.
Что происходит с энергией электрона при переходе со второго энергетического уровня на третий:
1) уменьшается; 2) увеличивается; 3) не изменяется; 4) не знаю.
В третьем периоде, в четвёртой группе, главной подгруппе находится:
1) Sc; 2) Ti; 3) Si; 4) Ge.
В пятом периоде, во второй группе, побочной подгруппе находится:
Cd; 2) Te; 3) Mo; 4) Bi .
8 класс: Контрольная работа №3 по теме : "Изменения, происходящие с веществами". Вариант - 1. Задание 1:Расставьте коэффициенты в схемах реакций, укажите их тип:
а) Cu + O2 →CuO; б) CaCO3 → CaO + CO2;
в) Zn + HCl → ZnCl2 + H2; г) CuO + HCl →CuCl2 + H2O.
Задание 2. Решить задачу: Рассчитайте объём водорода (н.у.), полученного при взаимодействии цинка массой 13 г с избытком соляной кислоты. Уравнение химической реакции: Zn + 2HCl = ZnCl2 + H2
Задание 3. Задача. Найдите массу кислорода, получившегося при разложении 108 г воды .
Задание 4. Запишите уравнения по схемам:
а) серная кислота + алюминий = сульфат алюминия + водород
б) азотная кислота = вода + кислород + оксид азота (IV)
Контрольная работа №3 по теме:
"Изменения, происходящие с веществами".
Вариант – 2.
Задание 1. Даны схемы реакций:
а) гидроксид железа (III) →оксид железа (III) + вода;
б) нитрат бария + сульфат железа (III) →сульфат бария + нитрат железа (III);
в) алюминий + серная кислота → сульфат алюминия + водород;
г) оксид фосфора (V) + вода → фосфорная кислота.
Запишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
Задание 2. Решить задачу: Технический цинк массой 650 мг, содержащий 20 % примесей, растворили в избытке соляной кислоты. Рассчитайте объём выделившегося водорода (н.у.).
Задание 3.Запишите уравнения реакций переходов:
S → SO2 →H2SO3
Задание 4. Задача. Найдите объем водорода ,необходимого для получения 3, 6 г воды(н.у.).
Итоговая контрольная работа в 9 классе по химии за 1 полугодие
1 вариант 2 вариант
№1.Осуществить цепочку превращений:
Fe→ FeCl2 → Fe(OH)2 →Fe(OH)3→Fe2 O3 KBr → KCl →Cl2 →HCl → ZnCl2
№ 2. Расставить коэффициенты методом электронного баланса:
Zn + H2SO4 →ZnSO4 + H2 S + H2O Fe + HNO3 → Fe(NO3)3 + N2 + H2O
№ 3. Решить задачу:
Объем воздуха, необходимого для полного Объем воздуха, необходимого для
Сжигания серы массой 640 кг, равен ….. м ? полного сжигания угля массой 160 кг,
равен …..м ?
№ 4. Реши задачу:
Объем водорода, выделившегося при взаи- Масса железа, полученного при
модействии с водой лития массой 30 г, восстановлении оксидом углерода
содержащего 5% примесей и объемной (II) красного железняка (Fe O )массой
долей выхода газа 90 %, равен…. л. 4 кг, содержащего 10 % пустой поро-
ды, при массовой доле выхода железа
0.80, равна … т.
Итоговая контрольная по химии за 3 четверть в 9 классе :
Вариант №1: Вариант№2:
Задание №1: Расставить коэффициенты методом электронного баланса:
Cu + H2 SO4 → CuSO4 + SO2 ↑ + H2 O Cu + HNO3 → Cu(NO3)3 + NO + H2O
Задание №2: Осуществить цепочку превращений:
S→ SO2 →SO3 →H2 SO4 →MqSO4 N2 →NH3 →NO → NO2 →HNO3
Задание №3: Решить задачу:
Определите количество вещества, объем При прокаливании 340 г натриевой
(н.у.) и массу аммиака, необходимого для селитры получили 33,6 л (н.у.)кислорода.
получения 250 кг сульфата аммония, Рассчитайте массовую долю примесей в
используемого в качестве удобрения. cелитре.
Задание №4: Напишите молекулярные и ионные уравнения реакций между растворами:
азотная кислота с гидроксидом меди ( II ); оксид железа ( III ) с карбонатом натрия .
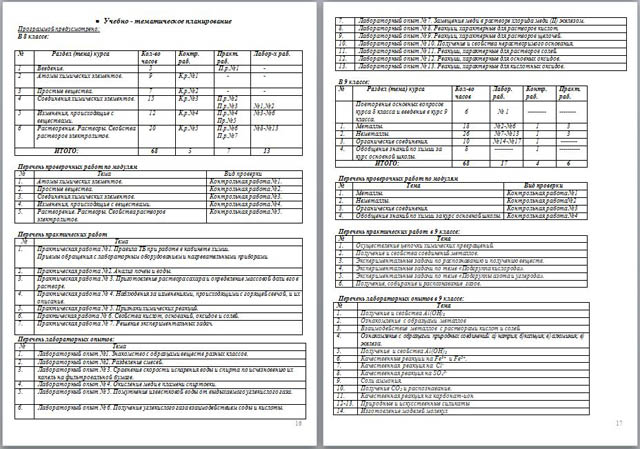
● Учебно - тематическое планирование
Программой предусмотрено:
| № | Раздел (тема) курса | Кол-во часов | Контр. раб. | Практ. раб. | Лабор-х раб. |
| 1 | Введение. | 5 |
| П.р.№1 | - |
| 2 | Атомы химических элементов. | 9 | К.р.№1 | - | - |
| 3 | Простые вещества. | 7 | К.р.№2 | - | - |
| 4 | Соединения химических элементов. | 15 | К.р.№3 | П.р.№2 П.р.№3 |
№1,№2 |
| 5 | Изменения, происходящие с веществами. | 12 | К.р.№4 | П.р.№4 Пр.№5 | №3-№6 |
| 6 | Растворение. Растворы. Свойства растворов электролитов. | 20 | К.р.№5 | П.р.№6 П.р.№7 | №8-№13 |
| ИТОГО: | 68 | 5 | 7 | 13 |
В 8 классе:
Перечень проверочных работ по модулям
| № | Тема | Вид проверки |
| 1. | Атомы химических элементов. | Контрольная работа №1. |
| 2. | Простые вещества. | Контрольная работа №2. |
| 3. | Соединения химических элементов. | Контрольная работа №3. |
| 4. | Изменения, происходящие с веществами. | Контрольная работа №4. |
| 5. | Растворение. Растворы. Свойства растворов электролитов. | Контрольная работа №5. |
Перечень практических работ
| № | Тема |
| 1. | Практическая работа №1. Правила ТБ при работе в кабинете химии. Приемы обращения с лабораторным оборудованием и нагревательными приборами. |
| 2. | Практическая работа №2. Анализ почвы и воды. |
| 3. | Практическая работа № 3. Приготовление раствора сахара и определение массовой доли его в растворе. |
| 4. | Практическая работа № 4. Наблюдения за изменениями, происходящими с горящей свечой, и их описание. |
| 5. | Практическая работа № 5. Признаки химических реакций. |
| 6. | Практическая работа № 6. Свойства кислот, оснований, оксидов и солей. |
| 7. | Практическая работа № 7. Решение экспериментальных задач.
|
Перечень лабораторных опытов:
| № | Тема |
| 1. | Лабораторный опыт №1. Знакомство с образцами веществ разных классов. |
| 2. | Лабораторный опыт №2. Разделение смесей. |
| 3. | Лабораторный опыт № 3. Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. |
| 4. | Лабораторный опыт № 4. Окисление меди в пламени спиртовки. |
| 5. | Лабораторный опыт № 5. Помутнение известковой воды от выдыхаемого углекислого газа. |
| 6. | Лабораторный опыт № 6. Получение углекислого газа взаимодействием соды и кислоты. |
| 7. | Лабораторный опыт № 7. Замещение меди в растворе хлорида меди (ІІ) железом. |
| 8. | Лабораторный опыт № 8. Реакции, характерные для растворов кислот. |
| 9. | Лабораторный опыт № 9. Реакции, характерные для растворов щелочей. |
| 10. | Лабораторный опыт № 10. Получение и свойства нерастворимого основания. |
| 11. | Лабораторный опыт № 11. Реакции, характерные для растворов солей. |
| 12. | Лабораторный опыт № 12. Реакции, характерные для основных оксидов. |
| 13. | Лабораторный опыт № 13. Реакции, характерные для кислотных оксидов. |
В 9 классе:
| № | Раздел (тема) курса | Кол-во часов | Лабор. раб. | Контр. раб. | Практ. раб. |
| | Повторение основных вопросов курса 8 класса и введение в курс 9 класса. | 6 | № 1 |
--------- |
-------- |
| 1. | Металлы. | 18 | №2-№6 | 1 | 3 |
| 2. | Неметаллы. | 26 | №7-№13 | 1 | 3 |
| 3. | Органические соединения. | 10 | №14-№17 | 1 | -------- |
| 4. | Обобщение знаний по химии за курс основной школы. | 8 | --------- | 1 | ---------- |
| ИТОГО: | 68 | 17 | 4 | 6 |
Перечень проверочных работ по модулям
| № | Тема | Вид проверки |
| 1. | Металлы. | Контрольная работа №1 |
| 2. | Неметаллы. | Контрольная работа№2 |
| 3. | Органические соединения. | Контрольная работа №3 |
| 4. | Обобщение знаний по химии за курс основной школы. | Контрольная работа №4 |
Перечень практических работ в 9 классе:
| № | Тема |
| 1. | Осуществление цепочки химических превращений. |
| 2. | Получение и свойства соединений металлов. |
| 3. | Экспериментальные задачи по распознаванию и получению веществ. |
| 4. | Экспериментальные задачи по теме «Подгруппа кислорода». |
| 5. | Экспериментальные задачи по теме «Подгруппы азота и углерода». |
| 6. | Получение, собирание и распознавание газов. |
Перечень лабораторных опытов в 9 классе:
| № | Тема |
| 1. | Получение и свойства Al(OH)3 |
| 2. | Ознакомление с образцами металлов |
| 3. | Взаимодействие металлов с растворами кислот и солей. |
| 4. | Ознакомление с образцами природных соединений: а) натрия; б)кальция; в) алюминия; в) железа. |
| 5. | Получение и свойства Al(OH)3 |
| 6. | Качественные реакции на Fe3+ и Fe2+. |
| 7. | Качественная реакция на Cl- |
| 8. | Качественная реакция на SO42- |
| 9. | Соли аммония. |
| 10. | Получение СО2 и распознавание. |
| 11. | Качественная реакция на карбонат-ион |
| 12-13. | Природные и искусственные силикаты |
| 14. | Изготовление моделей молекул |
| 15. | Свойства глицерина |
| 16-17. | Качественные реакции на глюкозу и крахмал |
18

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии для 9 класса (0.31 MB)
Рабочая программа по химии для 9 класса (0.31 MB)
 0
0 632
632 9
9 Нравится
0
Нравится
0









