Негосударственное образовательное учреждение
«Русская гимназия полного дня»
| «Рассмотрено» Руководитель методического совета __________/С.В.Желенина/ Протокол №_____ | «Согласовано» Заместитель директора по УВР __________ /О.П.Матвеева/ | «Утверждаю» Директор НОУ «Русская гимназия полного дня» _______/В.Н. Скажутин/ Приказ №____ от «___»____2014г. |
РАБОЧАЯ ПРОГРАММА
по химии
9 класс
Составитель:
учитель биологии-химии
Алексеева Татьяна Валерьевна
г. Чита, 2014 г.
Аннотация к рабочей программе
Рабочая программа по химии для 9 класса. Программа составлена в соответствии требованиям стандартов 2004 г. Курс рассчитан на 68 часов (2 часа в неделю). Планирование ориентированно на использование УМК О.С. Габриеляна.
Пояснительная записка
Рабочая программа по химии для 9 класса, разработана на основе федерального компонента государственного стандарта общего образования 2004 года, а так же на основе авторской программы курса химии для 8-9 классов основной общеобразовательной школы О.С. Габриеляна, допущенной Министерством образования и науки Российской Федерации к использованию в образовательных учреждениях. Программа представляет собой один из возможных вариантов построения курса химии изучаемого в 9 классе. Определяет базовый уровень подготовки учащихся по предмету и содержит все темы, включенные в федеральный компонент содержания образования.
Программа курса «Химии» построена на основе спиральной модели, предусматривающей постепенное развитие и углубление теоретических представлений при линейном ознакомлении с эмпирическим материалом.
При составлении программы были использованы правовые документы:
- Федеральный компонент государственного стандарта общего образования, утвержденный приказом Министерства образования РФ №1089 от 05.03.2004;
- Федеральный базисный учебный план для среднего (полного) общего образования, утвержденный приказом Министерства образования РФ №1312 от 05.03.2004;
- Программа курса химии для 8-11 классов общеобразовательных учреждений О.С. Габриелян.- 2-е издание, переработанное и дополненное – М.: Дрофа, 2009
Химия как наука о веществах и их превращениях, выступая в качестве учебного предмета в школе, вносит существенный вклад в систему знаний об окружающем мире. Она раскрывает роль науки в экономическом и культурном развитии общества, способствует формированию современного научного мировоззрения.
Основными целями обучения химии в основной школе являются:
формирование у обучающихся умения видеть и понимать ценность образования, значимость химического знания для каждого человека независимо от его профессиональной деятельности; умения различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
формирование у обучающихся целостного представления о мире и роли химии в создании современной естественно-научной картины мира; умения объяснять объекты и процессы окружающей действительности — природной, социальной, культурной, технической среды, используя для этого химические знания;
приобретение обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков (ключевых компетентностей), имеющих универсальное значение для различных видов деятельности: решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни.
Задачами изучения учебного предмета «Химия» в 9 классе являются:
учебные: формирование системы химических знаний как компонента естественнонаучной картины мира;
развивающие: развитие личности обучающихся, их интеллектуальное и нравственное совершенствование, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и в трудовой деятельности;
воспитательные: формирование умений безопасного обращения с веществами, используемыми в повседневной жизни; выработка понимания общественной потребности в развитии химии, а также формирование отношения к химии как к возможной области будущей практической деятельности.
Общая характеристика учебного предмета «Химия»
Предлагаемая программа по химии раскрывает вклад учебного предмета в достижение целей основного общего образования и определяет важнейшие содержательные линии предмета:
вещество — знания о составе и строении веществ, их важнейших физических и химических свойствах, биологическом действии;
химическая реакция — знания об условиях, в которых проявляются химические свойства веществ, способах управления химическими процессами;
применение веществ — знания и опыт практической деятельности с веществами, которые наиболее часто употребляются в повседневной жизни, широко используются в промышленности, сельском хозяйстве, на транспорте;
язык химии — система важнейших понятий химии и терминов, в которых они описываются, номенклатура неорганических веществ, т. е. их названия (в том числе и тривиальные), химические формулы и уравнения, а также правила перевода информации с естественного языка на язык химии и обратно.
При отборе содержания, конкретизирующего программу, учитывалось, что перед общим образованием не стоит задача профессиональной подготовки обучающихся. Это определило построение курса как общекультурного, направленного, прежде всего на формирование и развитие интереса к изучению химии. Учтена основная особенность подросткового возраста — начало перехода от детства к взрослости, который характеризуется развитием познавательной сферы. На этапе основного общего среднего образования происходит включение обучающихся в проектную и исследовательскую деятельность, основу которой составляют такие универсальные учебные действия, как умение видеть проблемы, ставить вопросы, классифицировать, наблюдать, проводить эксперимент, делать выводы и умозаключения, объяснять, доказывать, защищать свои идеи, давать определения понятиям. Сюда же относятся приёмы, сходные с определением понятий: описание, характеристика, разъяснение, сравнение, различение. Формирование этих универсальных учебных действий начинается ещё в начальной школе, а в курсе химии основной школы происходит их развитие и совершенствование. В связи с этим резервные часы планируется использовать на формирование и развитие умений проектной и исследовательской деятельности, умение видеть проблемы, делать выводы и умозаключения.
Место учебного предмета в учебном плане
Особенностью содержания курса «Химия» являются то, что в базисном учебном (образовательном) плане этот предмет появляется последним в ряду изучения естественнонаучных дисциплин. Данная необходимость освоения объясняется тем, что школьники должны обладать не только определенным запасом предварительных естественнонаучных знаний, но и достаточно хорошо развитым абстрактным мышлением. Учащимися уже накоплены знания по смежным дисциплинам цикла: биологии, физики, математики, географии, сформировались умения анализировать, вести наблюдения, сравнивать объекты наблюдения.
В соответствии с учебным планом на изучение химии в 9 классе отводится 2 часа в неделю, 70 часов в год, при нормативной продолжительности учебного года 35 учебных недель. В соответствии со сложившейся практикой организации основного общего образования в образовательных учреждениях общего образования реальная продолжительность учебного года меньше нормативной и составляет 34 учебные недели. Таким образом, время, выделяемое рабочими учебными планами на изучение химии в 9 классе на практике равно 68 часам. С учетом неизбежных потерь учебного времени, вызываемых различными объективными причинами, а также необходимости выделения дополнительного времени на изучение отдельных вопросов курса химии программой предусмотрен большой объем резервного времени -6 часов. Допускается корректировка рабочей программы в течение 2014-2015 учебного года.
Программой предусмотрено проведение:
контрольных работ – 4,
практических работ – 6 часов.
Срок реализации программы – один учебный год.
Формы, методы и средства обучения, технологии
В данном классе ведущими методами обучения предмету являются: объяснительно-иллюстративный и репродуктивный, хотя используется и частично-поисковый. На уроках используются элементы следующих технологий: личностно - ориентированное обучение, обучение с применением опорных схем, ИКТ, проектная деятельность.
Используются следующие формы обучения: учебные занятия, экскурсии, наблюдения, опыты, эксперименты, работа с учебной и дополнительной литературой, анализ, мониторинг, исследовательская работа, презентация. Определенное место в овладении данным курсом отводится самостоятельной работе: подготовка творческих работ, сообщений, рефератов.
Формы промежуточной и итоговой аттестации
Промежуточная аттестация проводится в форме:
- тестов;
-контрольных;
- самостоятельных работ;
- практических;
- творческих работ.
Учащиеся проходят итоговую аттестацию – в виде ГИА.
Обучение ведётся по учебнику О.С.Габриелян «Химия 9 класс», который составляет единую линию учебников, соответствует федеральному государственного образовательного стандарта второго поколения базового уровня и реализует авторскую программу О.С.Габриеляна(2012г.)
Отличительные особенности рабочей программы
Основное содержание авторской программы О.С.Габриеляна полностью нашло отражение в данной рабочей программе. В рабочую программу по химии внесены изменения по сравнению с авторской: из резерва добавлено 3 часа на «Введение», что связано с необходимостью уделить больше внимания на изучение ОВР, являющихся одними из трудных тем курса химии 8 класса, из резерва добавлено 1 час на «Металлы» и добавлен 1час на Практикум 1 «Свойства металлов и их соединений». Основное отличие данной рабочей программы от авторской состоит в том, что в авторской программе практические работы сгруппированы в блоки - химические практикумы, которые проводятся после изучения нескольких разделов, а в рабочей программе эти же практические работы даются после изучения конкретной темы. Это позволяет лучше закрепить теоретический материал на практике и проверить практические умения и навыки непосредственно по данной теме. Чтобы провести практическую работу по когда-то изученной теме, требуется дополнительное время для повторения теоретических основ, что исключается в данной рабочей программе.
| Раздел | Количество часов в авторской программе | Количество часов в рабочей программе |
| 1. Введение. Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д.И.Менделеева | 10 | 10+3 |
| 2.Металлы | 14 | 14 +1 +2+1 |
| 3.Практикум 1 «Свойства металлов и их соединений» | 2 | - |
| 4.Неметаллы | 25 | 25+3 |
| 5. Практикум 2 «Свойства неметаллов и их соединений» | 3 | - |
| 6.Обобщение знаний по химии за курс основной школы. Подготовка к ГИА. | 10 | 10 |
| Резерв | 6 | 1 |
| Итого: | 70 | 70 |
Требования к уровню подготовки
Требования к уровню подготовки обучающихся включает в себя как требования, основанные на усвоении и воспроизведении учебного материала, понимание смысла химических понятий и явлений, так и основанные на более сложных видах деятельности: объяснении физических и химических явлений, приведении примеров практического использования изучаемых химических явлений и законов. Требования направлены на реализацию деятельностного, практико-ориентированного и личностно-ориентированного подходов, овладение учащимися способами интеллектуальной и практической деятельности, овладение знаниями и умениями востребованными в повседневной жизни, позволяющими ориентироваться в окружающем мире, значимыми для сохранения окружающей среды и собственного здоровья.
В результате изучения химии ученик должен
знать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
определять: состав веществ по их формулам; принадлежность веществ к определенному классу соединений; валентность и степень окисления элементов в соединениях;
составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов периодической системы; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю растворенного вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде, школьной лаборатории и в быту.
Тематическое планирование учебного материала
| № главы | Название главы | Количество часов | Практические работы | Контрольные работы |
|
| Введение. Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д.И.Менделеева | 10 |
| №1 |
| 1. | Металлы | 18 | №1-3 | №2 |
| 3. | Неметаллы | 28 | №4-6 | №3 |
| 5. | Обобщение знаний по химии за курс основной школы. Подготовка к ГИА. | 10 |
| №4 |
|
| Итого | 70 | 6 | 4 |
Основное содержание курса
Введение. Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д. И. Менделеева (10 ч)
Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева. Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и окисления-восстановления. Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента. Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Химическая организация живой и неживой природы. Химический состав ядра, мантии и земной коры. Химические элементы в клетках живых организмов. Макро- и микроэлементы. Обобщение сведений о химических реакциях. Классификация химических реакций по различным признакам: «число и состав реагирующих и образующихся веществ», «тепловой эффект», «направление», «изменение степеней окисления элементов, образующих реагирующие вещества», «фаза», «использование катализатора». Понятие о скорости химической реакции. Факторы, влияющие на скорость химических реакций. Катализаторы и катализ. Ингибиторы. Антиоксиданты.
Демонстрации.
Различные формы таблицы Д. И. Менделеева. Модели атомов элементов 1—3-го периодов. Модель строения земного шара (поперечный разрез). Зависимость скорости химической реакции от природы реагирующих веществ. Зависимость скорости химической реакции от концентрации реагирующих веществ. Зависимость скорости химической реакции от площади соприкосновения реагирующих веществ («кипящий слой»). Зависимость скорости химической реакции от температуры реагирующих веществ. Гомогенный и гетерогенный катализы. Ферментативный катализ. Ингибирование.
Лабораторные опыты.
1. Получение гидроксида цинка и исследование его свойств.
2.Моделирование построения Периодической системы химических элементов Д. И. Менделеева.
3. Замещение железом меди в растворе сульфата меди (II).
4. Зависимость скорости химической реакции от природы реагирующих веществ на примере взаимодействия кислот с металлами.
5. Зависимость скорости химической реакции от концентрации реагирующих веществ на примере взаимодействия цинка с соляной кислотой различной концентрации.
6. Зависимость скорости химической реакции от площади соприкосновения реагирующих веществ.
7. Моделирование «кипящего слоя».
8. Зависимость скорости химической реакции от температуры реагирующих веществ на примере взаимодействия оксида меди (II) с раствором серной кислоты различной температуры.
9. Разложение пероксида водорода с помощью оксида марганца (IV) и каталазы.
10. Обнаружение каталазы в некоторых пищевых продуктах.
11. Ингибирование взаимодействия кислот с металлами уротропином.
Тема 1. Металлы (14 ч)
Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Сплавы, их свойства и значение. Химические свойства металлов как восстановителей, а также в свете их положения в электрохимическом ряду напряжений металлов. Коррозия металлов и способы борьбы с ней. Металлы в природе. Общие способы их получения.
Общая характеристика щелочных металлов. Металлы в природе. Общие способы их получения. Строение атомов. Щелочные металлы — простые вещества. Важнейшие соединения щелочных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, сульфаты, нитраты), их свойства и применение в народном хозяйстве. Калийные удобрения.
Общая характеристика элементов главной подгруппы II группы.
Строение атомов. Щелочноземельные металлы — простые вещества. Важнейшие соединения щелочноземельных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, нитраты, сульфаты, фосфаты), их свойства и применение в народном хозяйстве.
Алюминий.
Строение атома, физические и химические свойства простого вещества. Соединения алюминия — оксид и гидроксид, их амфотерный характер. Важнейшие соли алюминия. Применение алюминия и его соединений.
Железо.
Строение атома, физические и химические свойства простого вещества. Генетические ряды Fe+2 и Fe+3 . Важнейшие соли железа. Значение железа и его соединений для природы и народного хозяйства.
Демонстрации.
Образцы щелочных и щелочноземельных металлов. Образцы сплавов. Взаимодействие натрия, лития и кальция с водой. Взаимодействие натрия и магния с кислородом. Взаимодействие металлов с неметаллами. Получение гидроксидов железа (II) и (III).
Лабораторные опыты.
12. Взаимодействие растворов кислот и солей с металлами.
13. Ознакомление с рудами железа.
14. Окрашивание пламени солями щелочных металлов.
15. Взаимодействие кальция с водой.
16.Получение гидроксида кальция и исследование его свойств.
17. Получение гидроксида алюминия и исследование его свойств.
18. Взаимодействие железа с соляной кислотой.
19. Получение гидроксидов железа (II) и (III) и изучение их свойств.
Тема 2. Практикум 1. Свойства металлов и их соединений (3 ч)
1. Осуществление цепочки химических превращений. 2. Получение и свойства соединений металлов. 3. Решение экспериментальных задач на распознавание и получение соединений металлов.
Предметные результаты обучения
Учащийся должен уметь:
обращаться с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности;
наблюдать за свойствами металлов и их соединений и явлениями, происходящими с ними;
описывать химический эксперимент с помощью естественного (русского или родного) языка и языка химии;
делать выводы по результатам проведенного эксперимента.
Метапредметные результаты обучения
Учащийся должен уметь:
определять, исходя из учебной задачи, необходимость использования наблюдения или эксперимента.
Тема 3. Неметаллы (25 ч)
Общая характеристика неметаллов: положение в Периодической системе химических элементов Д. И. Менделеева,особенности строения атомов, электроотрицательность (ЭО) какмера «неметалличности», ряд ЭО. Кристаллическое строение неметаллов — простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл».
Водород.Положение водорода в Периодической системе химических элементов Д. И. Менделеева. Строение атома и молекулы. Физические и химические свойства водорода, его получение и применение.
Вода.
Строение молекулы. Водородная химическая связь. Физические свойства воды. Аномалии свойств воды. Гидрофильные и гидрофобные вещества. Химические свойства воды. Круговорот воды в природе. Водоочистка. Аэрация воды. Бытовые фильтры. Минеральные воды. Дистиллированная вода, ее получение и применение.
Общая характеристика галогенов.
Строение атомов. Простые вещества и основные соединения галогенов, их свойства.
Краткие сведения о хлоре, броме, фторе и йоде. Применение галогенов и их соединений в народном хозяйстве.
Сера.
Строение атома, аллотропия, свойства и применение ромбической серы. Оксиды серы (IV) и (VI), их получение, свойства и применение. Серная кислота и ее соли, их применение в народном хозяйстве. Производство серной кислоты.
Азот.
Строение атома и молекулы, свойства простого вещества. Аммиак, строение, свойства, получение и применение. Соли аммония, их свойства и применение. Оксиды азота (II) и (IV).
Азотная кислота, ее свойства и применение. Нитраты и нитриты, проблема их содержания в сельскохозяйственной продукции. Азотные удобрения.
Фосфор.
Строение атома, аллотропия, свойства белого и красного фосфора, их применение. Основные соединения: оксид фосфора (V) и ортофосфорная кислота, фосфаты. Фосфорные удобрения.
Углерод.
Строение атома, аллотропия, свойства модификаций, применение. Оксиды углерода (II) и (IV), их свойства и применение. Карбонаты: кальцит, сода, поташ, их значение в природе и жизни человека.
Кремний.
Строение атома, кристаллический кремний, его свойства и применение. Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Понятие о силикатной промышленности.
Демонстрации.
Образцы галогенов — простых веществ. Взаимодействие галогенов с натрием, с алюминием. Вытеснение хлором брома или иода из растворов их солей. Взаимодействие серы с металлами, водородом и кислородом. Взаимодействие концентрированной азотной кислоты с медью. Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. Образцы природных соединений хлора, серы, фосфора, углерода, кремния. Образцы важнейших для народного хозяйства сульфатов, нитратов, карбонатов, фосфатов. Образцы стекла, керамики, цемента.
Лабораторные опыты.
20. Получение и распознавание водорода. 21. Исследование поверхностного натяжения воды. 22.Растворение перманганата калия или медного купороса в воде. 23. Гидратация обезвоженного сульфата меди (II). 24. Изготовление гипсового отпечатка. 25. Ознакомление с коллекцией бытовых фильтров. 26. Ознакомление с составом минеральной воды. 27. Качественная реакция на галогенид-ионы. 28. Получение и распознавание кислорода. 29. Горение серы на воздухе и в кислороде. 30.Свойства разбавленной серной кислоты. 31. Изучение свойств аммиака. 32. Распознавание солей аммония. 33. Свойства разбавленной азотной кислоты. 34. Взаимодействие концентрированной азотной кислоты с медью. 35. Горение фосфора на воздухе и в кислороде. 36. Распознавание фосфатов. 37. Горение угля в кислороде. 38. Получение угольной кислоты и изучение ее свойств. 39. Переход карбонатов в гидрокарбонаты.40. Разложение гидрокарбоната натрия. 41. Получение кремневой кислоты и изучение ее свойств.
Тема 4. Практикум 2. Свойства соединений неметаллов (3 ч)
1. Решение экспериментальных задач по теме «Подгруппа галогенов».
2. Решение экспериментальных задач по теме «Подгруппа кислорода».
3. Решение экспериментальных задач по теме «Подгруппа азота».
4. Решение экспериментальных задач по теме «Подгруппа углерода».
5. Получение, собирание и распознавание газов.
Тема 5. Обобщение знаний по химии за курс основной школы. Подготовка
к государственной итоговой аттестации (ГИА) (10 ч)
Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Физический смысл порядкового номера элемента, номеров периода и группы. Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов.
Значение периодического закона. Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ. Классификация химических реакций по различным признакам (число и состав реагирующих и образующихся веществ; наличиеграницы раздела фаз; тепловой эффект; изменение степеней окисления атомов; использование катализатора; направление протекания). Скорость химических реакций и факторы, влияющие на нее. Обратимость химических реакций и способы смещения химического равновесия.
Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла, неметалла и переходного металла. Оксидыи гидроксиды (основания, кислоты, амфотерные гидроксиды), соли. Их состав, классификация и общие химические свойства в свете теории электролитической диссоциации.
Планируемые результаты обучения:
Выпускник научится:
• описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки;
• характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
• раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», используя знаковую систему химии;
• изображать состав простейших веществ с помощью химических формул и сущность химических реакций с помощью химических уравнений;
• вычислять относительную молекулярную и молярную массы веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости;
• сравнивать по составу оксиды, основания, кислоты, соли;
• классифицировать оксиды и основания по свойствам, кислоты и соли по составу;
• пользоваться лабораторным оборудованием и химической посудой;
• проводить несложные химические опыты и наблюдения за изменениями свойств веществ в процессе их превращений; соблюдать правила техники безопасности при проведении наблюдений и опытов;
• различать экспериментально кислоты и щёлочи, пользуясь индикаторами; осознавать необходимость соблюдения мер безопасности при обращении с кислотами и щелочами.
• раскрывать смысл периодического закона Д. И. Менделеева;
• описывать и характеризовать табличную форму периодической системы химических элементов;
• характеризовать состав атомных ядер и распределение числа электронов по электронным слоям атомов химических элементов малых периодов периодической системы, а также калия и кальция;
• различать виды химической связи: ионную, ковалентную полярную, ковалентную неполярную и металлическую;
• изображать электронно-ионные формулы веществ, образованных химическими связями разного вида;
• выявлять зависимость свойств веществ от строения их кристаллических решёток: ионных, атомных, молекулярных, металлических;
• характеризовать химические элементы и их соединения на основе положения элементов в периодической системе и особенностей строения их атомов;
• характеризовать научное и мировоззренческое значение периодического закона и периодической системы химических элементов Д. И. Менделеева; • объяснять суть химических процессов и их принципиальное отличие от физических;
• называть признаки и условия протекания химических реакций;
• устанавливать принадлежность химической реакции к определённому типу по одному из классификационных признаков: 1) по числу и составу исходных веществ и продуктов реакции (реакции соединения, разложения, замещения и обмена); 2) по выделению или поглощению теплоты (реакции экзотермические и эндотермические); 3) по изменению степеней окисления химических элементов (реакции окислительно-восстановительные); 4) по обратимости процесса (реакции обратимые и необратимые);
• составлять уравнения электролитической диссоциации кислот, щелочей, солей; полные и сокращённые ионные уравнения реакций обмена; уравнения окислительно-восстановительных реакций;
• прогнозировать продукты химических реакций по формулам/названиям исходных веществ; определять исходные вещества по формулам/названиям продуктов реакции;
• составлять уравнения реакций, соответствующих последовательности («цепочке») превращений неорганических веществ различных классов;
• выявлять в процессе эксперимента признаки, свидетельствующие о протекании химической реакции;
• приготовлять растворы с определённой массовой долей растворённого вещества;
• определять характер среды водных растворов кислот и щелочей по изменению окраски индикаторов;
• проводить качественные реакции, подтверждающие наличие в водных растворах веществ отдельных ионов
• определять принадлежность неорганических веществ к одному из изученных классов/групп: металлы и неметаллы, оксиды, основания, кислоты, соли;
• составлять формулы веществ по их названиям;
• определять валентность и степень окисления элементов в веществах;
• составлять формулы неорганических соединений по валентностям и степеням окисления элементов, а также зарядам ионов, указанным в таблице растворимости кислот, оснований и солей;
• объяснять закономерности изменения физических и химических свойств простых веществ (металлов и неметаллов) и их высших оксидов, образованных элементами второго и третьего периодов;
• называть общие химические свойства, характерные для групп оксидов: кислотных, оснóвных;
• называть общие химические свойства, характерные для каждого из классов неорганических веществ: кислот, оснований, солей;
• приводить примеры реакций, подтверждающих химические свойства неорганических веществ: оксидов, кислот, оснований и солей;
• определять вещество-окислитель и вещество-восстановитель в окислительно-восстановительных реакциях;
• составлять окислительно-восстановительный баланс (для изученных реакций) по предложенным схемам реакций;
• проводить лабораторные опыты, подтверждающие химические свойства основных классов неорганических веществ;
Выпускник получит возможность научиться:
• грамотно обращаться с веществами в повседневной жизни;
• осознавать необходимость соблюдения правил экологически безопасного поведения в окружающей природной среде;
• понимать смысл и необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.;
• использовать приобретённые ключевые компетентности при выполнении исследовательских проектов по изучению свойств, способов получения и распознавания веществ;
• развивать коммуникативную компетентность, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы;
• объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации, недобросовестной рекламе, касающейся использования различных веществ.
• осознавать значение теоретических знаний для практической деятельности человека;
• описывать изученные объекты как системы, применяя логику системного анализа;
• применять знания о закономерностях периодической системы химических элементов для объяснения и предвидения свойств конкретных веществ;
• развивать информационную компетентность посредством углубления знаний об истории становления химической науки, её основных понятий, периодического закона как одного из важнейших законов природы, а также о современных достижениях науки и техники.
• составлять молекулярные и полные ионные уравнения по сокращённым ионным уравнениям;
• приводить примеры реакций, подтверждающих существование взаимосвязи между основными классами неорганических веществ;
• прогнозировать результаты воздействия различных факторов на изменение скорости химической реакции;
• прогнозировать результаты воздействия различных факторов на смещение химического равновесия.
• прогнозировать химические свойства веществ на основе их состава и строения;
• прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав;
• выявлять существование генетической взаимосвязи между веществами в ряду: простое вещество — оксид — гидроксид — соль;
• организовывать, проводить ученические проекты по исследованию свойств веществ, имеющих важное практическое значение.
Описание учебно-методического и
материально-технического обеспечения
Учебно – методическое обеспечение
1.Примерная программа основного общего образования по химии (базовый уровень);
2.Авторская программа О.С.Габриеляна, соответствующая Федеральному Государственному образовательному стандарту основного общего образования и допущенная Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-9 классов общеобразовательных учреждений / О.С.Габриелян. – М.: Дрофа, 2012г.).
3.Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 9 к л.: Методическое пособие. — М.: Дрофа, 2010г
4.Химия. 9 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 9 / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2009г.
5.Габриелян О. С., Остроумов И. Г. Изучаем химию в 9 к л.: Дидактические материалы. — М.: Блик плюс, 2009г.
6.Габриелян О. С., Яшукова А. В. Рабочая тетрадь. 9 к л. К учебнику О. С. Габриеляна «Химия. 9». — М.: Дрофа, 2012г.
7.Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2009г.
8. Химия. 9 класс: учебник для общеобразоват учреждений /О.С.Габриелян. – М.: Дрофа, 2013. – 319 с.
Материально-техническое обеспечение:
Кабинет химии оснащён комплектом демонстрационного и лабораторного оборудования по химии для основной школы. В кабинете химии осуществляются как урочная, так и внеурочная формы учебно-воспитательной деятельности с учащимися. Оснащение в большей части соответствует Перечню оборудования кабинета химии и включает различные типы средств обучения. Большую часть оборудования составляют учебно-практическое и учебно-лабораторное оборудование, в том числе комплект натуральных объектов, модели, приборы и инструменты для проведения демонстраций и практических занятий, демонстрационные таблицы, видео - оснащение.
В комплект технических и информационно-коммуникативных средств обучения входят: компьютер, телевизор, выход в Интернет.
Использование электронных средств обучения позволяют:
активизировать деятельность обучающихся, получать более высокие качественные результаты обучения;
при подготовке к ЕГЭ обеспечивать самостоятельность в овладении содержанием курса .
формировать ИКТ - компетентность, способствующую успешности в учебной деятельности;
формировать УУД;
Натуральные объекты
Натуральные объекты, используемые в обучении химии, включают в себя коллекции минералов и горных пород, металлов и сплавов, минеральных удобрений, пластмасс, каучуков, волокон и т. д.
Ознакомление учащихся с образцами исходных веществ, полупродуктов и готовых изделий позволяет получить наглядное представление об этих материалах, их внешнем виде, а также о некоторых физических свойствах.
Химические реактивы и материалы
Обращение со многими веществами требует строгого соблюдения правил техники безопасности, особенно при выполнении опытов самими учащимися. Все необходимые меры предосторожности указаны в соответствующих документах и инструкциях.
Химическая лабораторная посуда, аппараты и приборы
Химическая посуда подразделяется на две группы: для выполнения опытов учащимися и демонстрационных опытов.
Приборы, аппараты и установки, используемые на уроках химии, подразделяют на основе протекающих в них физических и химических.
Модели
Объектами моделирования в химии являются атомы, молекулы, кристаллы, заводские аппараты, а также происходящие процессы. В преподавании химии используются модели кристаллических решёток графита, поваренной соли, наборы моделей атомов для составления шаростержневых моделей молекул.
Учебные пособия на печатной основе
В процессе обучения химии используются следующие таблицы постоянного экспонирования: «Периодическая система химических элементов Д.И. Менделеева», «Таблица растворимости кислот, оснований и солей», «Электрохимический ряд напряжений металлов», «Круговорот веществ в природе» и др.
Для организации самостоятельной работы обучающихся на уроках используют разнообразные дидактические материалы: отдельные рабочие листы — инструкции, карточки с заданиями разной степени трудности для изучения нового материала, самопроверки и контроля знаний учащихся.
Для обеспечения безопасного труда кабинете химии имеется:
противопожарный инвентарь;
аптечку с набором медикаментов и перевязочных средств;
инструкцию по правилам безопасности труда для обучающихся журнал регистрации инструктажа по правилам безопасности труда.
Контроль уровня знаний
Контроль уровня знаний учащихся предусматривает проведение текущих контрольных работ, итоговой контрольной работы, практических и самостоятельных работ, химических диктантов, тестовых заданий, устных зачетов по изученной теме, проведение независимого контроля. Также используются нетрадиционные формы контроля: работа в парах, компьютерное тестирование, самостоятельное оценивание, защита проектов.
График контролирующих мероприятий соответствует учебно-тематическому плану.
Критерии оценивания знаний
Оценка устного ответа
Отметка «5»: ответ полный и правильный на основании изученных теорий, материал изложен в определенной логической последовательности, литературным языком, ответ самостоятельный.
Отметка «4»: ответ полный и правильный на основании изученных теорий, материал изложен в определенной логической последовательности, при этом допущены две – три несущественные ошибки, исправленные по требованию учителя.
Отметка «3»: ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»: при ответе обнаружено непонимание учащегося основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Оценка контрольных работ
Отметка «5»: ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»: ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»: работа выполнена не менее чем на половину, допущена одна существенная ошибка и при этом две – три несущественные ошибки.
Отметка «2»: работа выполнена меньше чем на половину или содержит несколько существенных ошибок.
Оценка умений решать задачи
Отметка «5»: в логическом рассуждении и решении ошибок нет, задача решена рациональным способом.
Отметка «4»: в логическом рассуждении и решении нет существенных ошибок, но задача решена не рациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»: в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»: имеются существенные ошибки в логическом рассуждении и решении.
Оценка экспериментальных умений
Отметка «5»: работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы, эксперимент осуществлен по плану с учетом ТБ, проявлены организационно – трудовые умения.
Отметка «4»: работа выполнена правильно, сделаны правильные выводы и наблюдения, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами.
Отметка «3»: работа выполнена правильно, сделан эксперимент не менее чем на половину, но допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил ТБ.
Отметка «2»: допущены две и более существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил ТБ при работе с веществами.
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
ХИМИЯ. 9 КЛАСС
Общее количество часов — 68, в неделю — 2часа.
Допускается корректировка календарно-тематического планирования в течение 2014-2015 учебного года.
| № п/п | Название раздела, темы урока | Тип урока | Характеристика основных видов учебной деятельности обучающихся | Требования к уровню подготовки выпускников | Демонстрации Лабораторные работы | Виды контроля Д/З | Дата проведения |
| Общая характеристика химических элементов и химических реакций (10 ч.) |
| 1-2 | Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева | Комбинированный урок: обобщение полученных знаний и применение их на практике. | Состав атома. Строение электронных оболочек атома первых 20 элементов периодической системы Д.И. Менделеева. Характер простого вещества; сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами; аналогично для соседей по подгруппе. Состав и характер высшего оксида, гидроксида, летучего водородного соединения (для неметаллов). Генетические ряды металла и неметалла. | Знать/понимать: вещество, классификация веществ. Уметь: соединения изученных классов; химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенности строения их атомов; принадлежность веществ к определённому классу соединений; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева. | Д.: Получение и изучение характерных свойств основного и кислотного оксидов, оснований и кислот на примерах MgO и SO2, Mg(OH)2 и H2SO4. | Предварительный Д/З § 1, упр. 1-10
| 1 неделя |
| 3 | Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды. | Комбинированный урок: обобщение полученных знаний и применение их на практике. | Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента. | Знать/понимать: понятие «амфотерность», «амфотерные элементы» Уметь составлять: уравнения реакций, подтверждающие амфотерность соединений | ЛР: Получение гидроксида цинка и исследование его свойств. | Текущий Д/З § 2, упр. 1-4
|
2 неделя |
| 4 | Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома. | Комбинированный урок: обобщение полученных знаний и применение их на практике. | Периодический закон Д.И.Менделеева. Периодическая система химических элементов Д.И.Менделеева – графическое отображение ПЗ. Физический смысл номера элемента, номера периода и номера группы. Закономерности изменения свойств элементов в периодах и группах. Значение ПЗ и ПСХЭ Д.И. Менделеева Виды химической связи, виды кристаллических решеток, степень окисления. | Знать/понимать химические понятия химический элемент, атом; Периодический закон. Уметь: химические элементы по их символам; физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов главных подгрупп. |
| Текущий Д/З § 3, упр. 1, 2, 5, 6, 8
|
2 неделя |
| 5 | Химическая организация живой и неживой природы.
| Комбинированный урок: обобщение полученных знаний и применение их на практике. | Химическая организация живой и неживой природы. Химический состав ядра, мантии, земной коры. Химические элементы в клетках живых организмов. Макро- и микроэлементы. | Знать/понимать: Характеризовать роль химических элементов в живой и неживой природе.
| Д.: Модель строения земного шара в поперечном разрезе. | Фронтальный Д/З § 4, упр. 1-5 |
3 неделя |
| 6 | Классификация химических реакций по различным основаниям.
| Комбинированный урок: обобщение полученных знаний и применение их на практике. | Обобщение сведений о химических реакциях. Классификация химических реакций по различным основаниям: составу и числу реагирующих и образующихся веществ, тепловому эффекту, направлению, изменению степеней окисления элементов, образующих реагирующие вещества, фазе, использованию катализатора. | Знать/понимать: химическая реакция, реакции соединения, разложения, обмена, замещения, нейтрализации, экзотермические и эндотермические реакции, обратимые и необратимые реакции, ОВР, гомогенные реакции, гетерогенные реакции, каталитические реакции, некаталитические реакции, тепловой эффект химической реакции. Уметь характеризовать: химические реакции по различным признакам. Составлять: молекулярные, полные и сокращенные ионные уравнения реакций. | ЛР: Замещение меди в растворе сульфата меди (II) железом. | Текущий Д/З § 5, упр. 1,2
|
3 неделя |
| 7-8 | Окислительно-восстановительные реакции. | Комбинированный урок: обобщение полученных знаний и применение их на практике. | Окислительно-восстановительные реакции. | Знать/понимать: химические понятия: ОВР, окислитель, восстановитель, окисление, восстановление. Уметь составлять: окислительно-восстановительные реакции методом электронного баланса. окислитель, восстановитель, пр-с окисления, пр-с восстановления |
|
|
4 неделя |
| 9 | Понятие о скорости химической реакции. Катализаторы. | Комбинированный урок: обобщение полученных знаний и применение их на практике. | Понятие о скорости химической реакции. Факторы, влияющие на скорость химических реакций. Катализаторы и катализ. Ингибиторы. Антиоксиданты. | Знать/понимать химические понятия: скорость химической реакции, катализатор, ингибитор. Уметь объяснять: влияние некоторых факторов на скорость химических реакций. опыты, подтверждающие зависимость скорости химической реакции от различных факторов. | ЛР.: зависимость скорости химической реакции от природы реагирующих веществ (на примере взаимодействия кислот с металлами) и от концентрации реагирующих веществ на примере взаимодействия цинка с соляной кислотой различной концентрации. | Фронтальный Д/З § 5, упр. 3-8 § 6, упр. 1-5 |
5 неделя |
| 10 | ПР№1 (урок - исследование) «Зависимость скорости химической реакции от различных факторов» | Практическая работа (урок - исследование) |
|
|
|
| 5 неделя |
| 11 | Обобщение и систематизация знаний по теме: «Общая характеристика химических элементов и химических реакций» | Комбинированный урок: обобщение полученных знаний и применение их на практике. |
|
|
|
|
6 неделя |
| 12 | Контрольная работа №1 «Общая характеристика химических элементов и химических реакций» |
|
|
|
6 неделя |
| Тема 1. Металлы (18 часов) |
| 1 | Век медный, бронзовый, железный. | Урок ознакомления с новым материалом | Металлы в истории человечества. |
|
| Предварительный Д/З § 7, упр. 1-6
|
7 неделя |
| 2 | Положение элементов металлов в Периодической системе, особенности строения атомов металлов. | Урок ознакомления с новым материалом | Положение металлов в ПСХЭ Д.И.Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. | Уметь характеризовать: положение металлов в периодической системе химических элементов Д.И.Менделеева и особенности строения их атомов.
| . | Текущий Д/З § 8, упр. 1 - 3 § 9, упр. 2,4
|
7 неделя |
| 3 | Физические свойства металлов. | Урок ознакомления с новым материалом | Общие физические свойства металлов. | Уметь характеризовать: общие физические свойства металлов; связь между физическими свойствами и строением металлов (металлическая связь, металлическая кристаллическая решётка).
|
| § 10, упр. 2-4 |
|
| 4 | Сплавы металлов и их свойства. | Урок ознакомления с новым материалом | Сплавы, их классификация, свойства и значение. |
|
|
|
|
| 5 | Химические свойства металлов | Урок ознакомления с новым материалом | Химические свойства металлов как восстановителей. Электрохимический ряд напряжений металлов и его использование для характеристики химических свойств конкретных металлов. | Уметь характеризовать: химические свойства металлов; уравнения реакций, характеризующие химические свойства металлов в свете представлений об окислительно-восстановительных реакциях и их положения в электрохимическом ряду напряжений (взаимодействие с неметаллами, кислотами и солями). | Д. Взаимодействие металлов с неметаллами. Л. Взаимодействие металлов с растворами кислот и солей. | Фронтальный Д/З § 11, упр. 2, 5,7 |
8 неделя |
| 6 | Металлы в природе. Общие способы получения металлов. | Урок ознакомления с новым материалом | Нахождение металлов в природе. Способы получения металлов: пиро-, гидро- и электрометаллургия. | Знать/понимать химические понятия: окислитель и восстановитель, окисление и восстановление. Уметь составлять: уравнения реакций восстановления металлов из их оксидов водородом, оксидом углерода (II), алюминием. | Д. Образцы сплавов. Коллекция руд металлов, полезные ископаемые.
| Фронтальный Д/З § 12, упр. 2-4 |
8неделя |
| 7 | Понятие о коррозии металлов | Урок ознакомления с новым материалом | Коррозия металлов и способы борьбы с ней. | Знать/понимать химические понятия: коррозия, химическая коррозия, электрохимическая коррозия. Уметь характеризовать: способы защиты металлов от коррозии. |
| Фронтальный Д/З § 13, упр. 1-4 |
8 неделя |
| 8-9 | Общая характеристика элементов I А группы. Соединения щелочных металлов. | Урок ознакомления с новым материалом | Строение атомов щелочных металлов. Щелочные металлы – простые вещества, их физические и химические свойства. Важнейшие соединения щелочных металлов – оксиды, гидроксиды и соли, их свойства и применение в народном хозяйстве. | Уметь называть: соединения щелочных металлов (оксиды, гидроксиды, соли); объяснять закономерности изменения свойств щелочных металлов в пределах главной подгруппы; сходства и различия в строении атомов щелочных металлов; характеризовать щелочные металлы (литий, натрий, калий) по их положению в ПСХЭ Д.И.Менделеева; связь между составом, строением и свойствами щелочных металлов; составлять уравнения химических реакций, характеризующие свойства щелочных металлов, их оксидов и гидроксидов; | Д. Образцы щелочных металлов. Взаимодействие натрия, лития с водой; натрия с кислородом. Л. Ознакомление с образцами природных соединений натрия. | Фронтальный Д/З § 14, упр. 1-5 |
8 - 9 неделя |
| 10-11 | Щелочно-земельные металлы. Соединения щелочно-земельных металлов. | Урок ознакомления с новым материалом | Строение атомов щелочноземельных металлов. Щелочноземельные металлы – простые вещества, их физические и химические свойства. | Уметь называть: соединения щелочноземельных металлов (оксиды, гидроксиды, соли); объяснятьзакономерности изменения свойств щелочноземельных металлов в пределах главной подгруппы; сходства и различия в строении атомов щелочноземельных металлов; характеризовать: щелочноземельные металлы по их положению в периодической системе химических элементов Д.И.Менделеева; связь между составом, строением и свойствами щелочноземельных металлов; | Д. Образцы щелочноземельных металлов. Взаимодействие кальция с водой; магния с кислородом. | Текущий Д/З § 15, упр. 1 – 7
|
9 - 10 неделя |
| 10-11 | Алюминий и его соединения. | Урок ознакомления с новым материалом | Строение атома алюминия. Физические и химические свойства алюминия - простого вещества. Области применения алюминия. Природные соединения алюминия. Соединения алюминия - оксид и гидроксид, их амфотерный характер. | Уметь называть: соединения алюминия по их химическим формулам; характеризовать: алюминий по его положению в периодической системе химических элементов Д.И.Менделеева; физические и химические свойства алюминия; составлять: уравнения химических реакций, характеризующие свойства алюминия. | Д. Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей. Л. Ознакомление с образцами природных соединений алюминия. | Текущий Д/З § 16, упр. 1-7
|
10-11 неделя |
| 12-13 | Железо и его соединения. | Урок ознакомления с новым материалом | Строение атома железа. Степени окисления железа. Физические и химические свойства железа. Оксиды и гидроксиды железа. Генетические ряды Fe2+ и Fe3+. Важнейшие соли железа. | Уметь называть: соединения железа по их химическим формулам; характеризовать: особенности строения атома железа по его положению в периодической системе химических элементов Д.И.Менделеева; физические и химические свойства железа, оксидов железа (II) и (III); области применения железа;
| Д. Получение гидроксидов железа (II) и (III). Л. Ознакомление с образцами природных соединений железа. | Текущий Д/З § 17, упр. 1 – 6
| 11-12 неделя |
| 14 | Практическая работа №1. «Решение экспериментальных задач на распознавание и получение соединений металлов». | Практическая работа |
| Уметь характеризовать: химические свойства металлов и их соединений; составлять: уравнения химических реакций, характеризующие свойства металлов и их соединений;
|
|
| 12 неделя |
| 15 | Практическая работа №2. «Решение экспериментальных задач на распознавание и получение соединений металлов». | Практическая работа | Решение экспериментальных задач на распознавание и получение соединений металлов. | Уметь: характеризовать: химические свойства металлов и их соединений; составлять: уравнения химических реакций, характеризующие свойства металлов и их соединений; обращаться: с химической посудой и лабораторным оборудованием; |
|
| 13 неделя |
| 16 | Решение задач на определение массовой, объемной доли выхода продукта от теоретически возможного | Практикум по решению задач |
|
|
| 13 неделя |
| 17 | Обобщение знаний по теме «Металлы» | Комбинированный урок: обобщение полученных знаний и применение их на практике. Контроль знаний. |
|
| Фронтальный | 14 неделя |
| 18 | Контрольная работа № 2 «Металлы» | Контрольный урок |
|
| Итоговый | 14 неделя |
| Тема 3. Неметаллы (28 часов) |
| 1 | Общая характеристика неметаллов | Урок ознакомления с новым материалом | Положение неметаллов в периодической системе химических элементов Д.И. Менделеева. Особенности строения атомов неметаллов. Электроотрицательность. Кристаллическое строение неметаллов – простых веществ. Аллотропия. Физические свойства неметаллов. Состав воздуха. | Знать/понимать химическую символику: знаки химических элементов-неметаллов. Уметь называть: химические элементы-неметаллы по их символам; Объяснять закономерности изменения свойств неметаллов в пределах малых периодов и главных подгрупп; Характеризовать неметаллы малых периодов на основе их положения в ПСХЭ Д.И.Менделеева; особенности строения атомов неметаллов; определять тип химической связи в соединениях неметаллов. | Д. Коллекция образцов неметаллов в различных агрегатных состояниях. | Предварительный Д/З § 18, упр. 1-6
|
15 неделя |
| 2 | Общие химические свойства неметаллов. Неметаллы в природе и способы их получения. | Урок ознакомления с новым материалом | Общие химические свойства неметаллов. | Знать/понимать характеристику неметаллов: строение, физические и химические свойства. Уметь составлять молекулярные уравнения реакций, характеризующие химические свойства неметаллов и их соединений. |
| Текущий Д/З § 18, упр. 1-6
|
15 неделя |
| 3 | Водород | Урок ознакомления с новым материалом | Двойственное положение водорода в периодической системе химических элементов Д.И.Менделеева. Физические и химические свойства водорода, его получение, применение. Распознавание водорода. | Уметь объяснять: двойственное положение водорода в периодической системе химических элементов Д.И. Менделеева; характеризовать: физические свойства водорода; химические свойства водорода в свете представлений об окислительно-восстановительных реакциях. Составлять: уравнения химических реакций, характеризующие свойства водорода; распознавать опытным путём: водород среди других газов. |
| Текущий Д/З § 19, упр. 2 - 5
| 16 неделя |
| 4 | Вода. | Урок ознакомления с новым материалом | Строение молекулы. Водородная химическая связь. Физические свойства воды. Аномалии свойств воды. Гидрофильные и гидрофобные вещества. Химические свойства воды. Круговорот воды в природе. Водоочистка. Аэрация воды. Бытовые фильтры. Минеральные воды. Дистиллированные вода, ее получение и применение. | Знать/понимать химические понятия: молекула, относительная молекулярная масса. Уметь характеризовать: состав, физические свойства воды, нахождение в природе и применение. составлять: уравнения химических реакций, характеризующие свойства воды; электронные уравнения процессов окисления-восстановления. | ЛР.: 1) Исследование поверхностного натяжения воды. 2)Растворение перманганата калия или медного купороса в воде. 3) Гидратация обезвоженного сульфата меди (II). 4) Изготовление гипсового отпечатка. 5) Ознакомление с коллекцией бытовых фильтров. 6) Ознакомление с составом минеральной воды. | Текущий Д/З § 20, упр. 1,2,6 § 21, упр. 4,6.8
| 16 неделя |
| 5 | Галогены. | Урок ознакомления с новым материалом | Строение атомов галогенов и их степени окисления. Строение молекул галогенов. Физические и химические свойства галогенов. Применение галогенов и их соединений в народном хозяйстве. | Знать/понимать химическую символику: знаки химических элементов-галогенов, формулы простых веществ – галогенов. Уметь объяснять: закономерности изменения свойств галогенов в пределах главной подгруппы; характеризовать: особенности строения атомов галогенов; физические и химические свойства галогенов: взаимодействие с металлами, водородом, растворами солей галогенов; определять степень окисления галогенов в соединениях; тип химической связи в соединениях галогенов; составлять: уравнения химических реакций, характеризующие свойства галогенов. | Д. Образцы галогенов – простых веществ. | Текущий Д/З § 22, упр. 2-4
| 17 неделя |
| 6 | Соединения галогенов. | Урок ознакомления с новым материалом | Галогеноводороды и их свойства. Галогениды и их свойства. Применение соединений галогенов в народном хозяйстве. Качественная реакция на хлорид-ион. | Знать/понимать химическую символику: формулы галогеноводородов, галогеноводородных кислот. Уметь называть: соединения галогенов по их химических формулам; характеризовать: химические свойства соляной кислоты; составлять: химические формулы галогеноводородов и галогенидов; уравнения химических реакций, характеризующие свойства соляной кислоты и хлоридов; распознавать опытным путём: соляную кислоту среди растворов веществ других классов; хлорид-ион среди других ионов. | Д. Получение хлороводорода и его растворение в воде. Образцы природных соединений хлора. Л. Качественная реакция на хлорид-ион. | Предварительный Д/З § 23, упр. 1-4 § 24, упр. 1-2
| 17 неделя |
| 7 | Практическая работа №3. «Решение экспериментальных задач по теме «Подгруппа галогенов». | Урок ознакомления с новым материалом | Решение экспериментальных задач по теме «Подгруппа галогенов». | Экспериментальное исследование свойств неметаллов и их соединений, решение экспериментальных задач по теме «Подгруппа галогенов». Работа с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности. Наблюдение за свойствами галогенов, их соединений и явлениями, происходящими с ними. |
|
| 18 неделя |
| 8 | Кислород. | Урок ознакомления с новым материалом | Строение атома и аллотропия кислорода. Свойства и применение его аллотропных модификаций. | Знать/понимать химические понятия: химический элемент, атом, молекула, относительная атомная и молекулярная массы, окислитель и восстановитель, окисление и восстановление. Уметь объяснять: строение атома кислорода по его положению в периодической системе химических элементов Д.И.Менделеева; характеризовать: физические свойства кислорода; химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами; определять: тип химической связи в молекуле кислорода и в оксидах; степень окисления атома кислорода в соединениях; составлять: уравнения химических реакций, характеризующие свойства кислорода; кислород среди других газов. | ЛР.: Получение и распознавание кислорода. | Текущий Д/З § 25, упр. 1-3,8
| 18 неделя |
| 9 | Сера, физические и химические свойства | Урок ознакомления с новым материалом | Строение атома серы и степени окисления серы. Аллотропия серы. Химические свойства серы. Сера в природе. Биологическое значение серы, её применение (демеркуризация). | Уметь объяснять: строение атома серы по её положению в периодической системе химических элементов Д.И. Менделеева; закономерности изменения свойств элементов (кислорода и серы) в пределах главной подгруппы; характеризовать: физические свойства серы; химические свойства серы (взаимодействие с металлами, кислородом, водородом) в свете представлений об ОВР; определять: тип химической связи в соединениях серы; степень окисления атома серы в соединениях; составлять: уравнения химических реакций, характеризующие свойства серы; использовать приобретённые знания для: экологически грамотного поведения (для удаления и обезвреживания разлитой ртути). | Д. Взаимодействие серы с металлами и кислородом. Образцы природных соединений серы. | Текущий Д/З § 26, упр. 1-5
| 19 неделя |
| 10 | Соединения серы | Урок ознакомления с новым материалом | Оксиды серы (IV) и (VI), их получение, свойства и применение. Сернистая кислота и её соли. | Знать/понимать химическую символику: формулы оксида серы (IV) и оксида серы (VI). Уметь называть: оксиды серы по их химическим формулам; характеризовать: физические свойства оксидов серы; химические свойства оксидов серы (как типичных кислотных оксидов); определять: принадлежность оксидов серы к кислотным оксидам; степень окисления атома серы и тип химической связи в оксидах; составлять: уравнения химических реакций взаимодействия оксидов с водой, с основными оксидами, щелочами.
| Д. Получение оксида серы (IV), его взаимодействие с водой и со щёлочью. | Текущий Д/З § 27, упр. 1-2
| 19 неделя |
| 11 | Серная кислота как электролит и ее соли | Урок ознакомления с новым материалом | Свойства серной кислоты в свете теории электролитической диссоциации и окислительно-восстановительных реакций. Сравнение свойств концентрированной и разбавленной серной кислоты. Применение серной кислоты. Соли серной кислоты и их применение в народном хозяйстве. Качественная реакция на сульфат-ион. | Знать/понимать химическую символику: формулу серной кислоты. Уметь называть: серную кислоту и сульфаты по их химическим формулам; характеризовать: физические свойства концентрированной серной кислоты; химические свойства серной кислоты в свете теории электролитической диссоциации и окислительно-восстановительных реакций; народнохозяйственное значение серной кислоты и её солей; определять: принадлежность серной кислоты и её солей к соответствующим классам неорганических соединений; валентность и степень окисления серы в серной кислоте и в сульфатах; составлять: химические формулы сульфатов; уравнения химических реакций, характеризующие свойства разбавленной серной кислоты; уравнения химических реакций, характеризующие свойства концентрированной серной кислоты (взаимодействие с медью). | Д. Образцы важнейших для народного хозяйства сульфатов. Разбавление концентрированной серной кислоты. Свойства разбавленной серной кислоты. Л. Качественная реакция на сульфат-ион | Текущий Д/З § 22, упр. 1-3
| 20 неделя |
| 12 | Серная кислота как окислитель Получение и применение серной кислоты | Урок ознакомления с новым материалом | Серная кислота как окислитель. Производство серной кислоты и ее применение. | Уметь составлять: молекулярные уравнения химических реакций, характеризующие свойства серной Кислоты как окислителя, электронных уравнений процессов окисления-восстановления. характеризовать: способы получения, производство и применение серной кислоты. |
| Текущий Д/З § 27, упр. 4
| 20 неделя |
| 13 | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» | Практическая работа | Экспериментальные задачи по теме: «Подгруппа кислорода». | Экспериментальное исследование свойств неметаллов и их соединений, решение экспериментальных задач по теме «Подгруппа кислорода М ». Работа с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности. Наблюдение за свойствами галогенов, их соединений и явлениями, происходящими с ними. |
| | 21 неделя |
| 14 | Азот и его свойства | Урок ознакомления с новым материалом | Строение атома и молекулы азота. Физические и химические свойства азота в свете представлений об окислительно-восстановительных реакциях. Получение и применение азота. Азот в природе и его биологическое значение. | Знать/понимать химическую символику: азота. Уметь характеризовать: физические и химические свойства азота; определять: тип химической связи в молекуле азота; строение молекулы азота; составлять: уравнения химических реакций, характеризующие свойства азота (взаимодействие кислородом, водородом, металлами); |
| Текущий Д/З § 28, упр. 1-5 | 21 неделя |
| 15-16 | Аммиак и его свойства. Соли аммония | Урок ознакомления с новым материалом | Строение молекулы аммиака. Физические и химические свойства, получение, собирание и распознавание аммиака. Состав, получение, физические и химические свойства солей аммония: взаимодействие со щелочами и разложение. Применение солей аммония в народном хозяйстве. | Знать/понимать химическую символику: формулу аммиака, катион аммония. Уметь называть: аммиак по его химической формуле; соли аммония по их химическим формулам; характеризовать: физические и химические свойства аммиака; химические свойства солей аммония; определять тип химической связи в молекуле аммиака; принадлежность солей аммония к определённому классу соединений; тип химической связи в солях аммония; валентность и степень окисления атома азота в аммиаке; составлять: уравнения химических реакций, характеризующие свойства аммиака (взаимодействие с водой, кислотами и кислородом); химические формулы солей аммония; уравнения химических реакций, характеризующие свойства солей аммония. | Д. Получение, собирание и распознавание аммиака. Растворение аммиака в воде и взаимодействие аммиака с хлороводородом. ЛР. Распознавание солей аммония. | Текущий Д/З § 29-30, по 3 упр. По выбору
| 22 неделя |
| 17 | Оксиды азота Азотная кислота как электролит, ее применение | Урок ознакомления с новым материалом | Оксиды азота. Физические и химические свойства оксида азота (IV), его получение и применение. | Знать/понимать химическую символику: формулы оксида азота (II) и оксида азота (IV). Уметь называть: оксиды азота по их химическим формулам; характеризовать: физические свойства оксидов азота; химические свойства оксида азота (IV) (как типичного кислотного оксида); определять: принадлежность оксидов азота к соответствующему классу неорганических соединений; степень окисления атома азота и тип химической связи в оксидах; составлять: уравнения химических реакций, характеризующие свойства оксида азота (IV). |
| Текущий Д/З § 31, упр. 1-2, 5, 6, 7 по выбору
| 23 неделя |
| 18 | Азотная кислота как окислитель, ее получение. Соли азотной кислоты. | Урок ознакомления с новым материалом | Состав и химические свойства азотной кислоты как электролита. Особенности окислительных свойств концентрированной азотной кислоты. Применение азотной кислоты. Нитраты и их свойства. Проблема повышенного содержания нитратов в сельскохозяйственной продукции. | Знать/понимать химическую символику: формулу азотной кислоты. Уметь характеризовать: физические свойства азотной кислоты; химические свойства азотной кислоты в свете теории электролитической диссоциации и окислительно-восстановительных реакций; определять: принадлежность азотной кислоты к соответствующему классу неорганических соединений; валентность и степень окисления азота в азотной кислоте; составлять: уравнения химических реакций, характеризующие свойства разбавленной азотной кислоты; уравнения химических реакций, характеризующие свойства концентрированной азотной кислоты (взаимодействие с медью). | Д. Взаимодействие концентрированной азотной кислоты с медью. | Текущий Д/З § 31, упр. 4
| 23 неделя |
| 19 | Фосфор. Соединения фосфора. Понятие о фосфорных удобрениях. | Урок ознакомления с новым материалом | Строение атома фосфора. Аллотропия фосфора. Химические свойства фосфора. Применение и биологическое значение фосфора. Оксид фосфора (V) - типичный кислотный оксид. Ортофосфорная кислота и три ряда её солей: фосфаты, гидрофосфаты и дигидрофосфаты. | Знать/понимать химическую символику: формулы оксида фосфора (V) и ортофосфорной кислоты. Уметь объяснять: строение атома фосфора по его положению в ПСХЭ; закономерности изменения свойств элементов (азота и фосфора) в пределах главной подгруппы. Характеризовать: химические свойства фосфора (взаимодействие с металлами, кислородом) в свете представлений об ОВР; химические свойства оксида фосфора (V), ортофосфорной кислоты в свете ТЭД. определять: тип химической связи в соединениях фосфора; степень окисления атома фосфора в соединениях; принадлежность оксида фосфора (V), ортофосфорной кислоты и её солей к соответствующим классам неорганических соединений; валентность и степень окисления атома фосфора в оксиде фосфора (V), ортофосфорной кислоте и в фосфатах. уравнения химических реакций, характеризующие свойства фосфора; химические формулы фосфатов; уравнения химических реакций, характеризующие свойства оксида фосфора (V) как типичного кислотного оксида; уравнения химических реакций, характеризующие свойства ортофосфорной кислоты. называть: оксид фосфора (V), ортофосфорную кислоту и её соли по их химическим формулам. | Д. Образцы природных соединений фосфора. Получение белого фосфора из красного. | Текущий Д/З § 32, упр. 1- 4 , 5 или 6 по выбору
| 24 неделя |
| 20 | Углерод | Урок ознакомления с новым материалом | Строение атома углерода. Аллотропия: алмаз и графит. Физические и химические свойства углерода. | Уметь объяснять: строение атома углерода по его положению в ПСХЭ; характеризовать: химические свойства углерода (взаимодействие с металлами, оксидами металлов, водородом, кислородом) в свете представлений об окислительно-восстановительных реакциях; определять: тип химической связи в соединениях углерода; степень окисления атома углерода в соединениях; составлять: уравнения химических реакций, характеризующие свойства углерода. | Д. Образцы природных соединений углерода. | Текущий Д/З § 33, упр. 1-5, 8
| 24 неделя |
| 21 | Оксиды углерода | Урок ознакомления с новым материалом | Оксид углерода (II) или угарный газ: получение, свойства, применение. Оксид углерода (IV) или углекислый газ: получение, свойства, применение. | Знать/понимать химическую символику формулы оксида углерода (II) и оксида углерода (IV). Уметь называть: оксиды углерода по их химическим формулам; характеризовать: физические свойства оксидов углерода; химические свойства оксида углерода (IV) (как типичного кислотного оксида); определять принадлежность оксидов углерода к определённому классу соединений; степень окисления атома углерода и тип химической связи в оксидах; составлять уравнения химических реакций, характеризующие свойства оксида углерода (IV); распознавать опытным путём: углекислый газ среди других газов. | Л. Получение углекислого газа и его распознавание. | Текущий Д/З § 34, упр. 1-4
| 25 неделя |
| 22 | Угольная кислота и ее соли Жесткость воды и способы ее устранения | Урок ознакомления с новым материалом | Состав и химические свойства угольной кислоты. Карбонаты и их значение в природе и жизни человека. Переход карбонатов в гидрокарбонаты и обратно. Распознавание карбонат-иона среди других ионов. | Знать/понимать: химическую символику: формулу угольной кислоты. Уметь называть: соли угольной кислоты по их химическим формулам; характеризовать: химические свойства угольной кислоты; народнохозяйственное значение карбонатов; определять: принадлежность угольной кислоты и её солей к определённым классам неорганических соединений; валентность и степень окисления углерода в угольной кислоте; составлять: химические формулы карбонатов и гидрокарбонатов; уравнения химических реакций превращения карбонатов в гидрокарбонаты и наоборот; распознавать опытным путём: карбонат-ион среди других ионов. | Д. Образцы важнейших для народного хозяйства карбонатов. Л. Качественная реакция на карбонат-ион. | Текущий Д/З § 34, упр. 5-7
| 25 неделя |
| 23 | Кремний | Урок ознакомления с новым материалом | Строение атома кремния, сравнение его свойств со свойствами атома углерода. Кристаллический кремний: его свойства и применение. |
| Д. Образцы природных соединений кремния. Образцы стекла, керамики, цемента. Л. Ознакомление с природными силикатами. Л. Ознакомление с продукцией силикатной промышленности. | Текущий Д/З § 35, упр. 2-3
| 26 неделя |
| 24 | Соединения кремния | Урок ознакомления с новым материалом | Оксид кремния (IV) и его природные разновидности. Кремниевая кислота и её соли. Значение соединений кремния в живой и неживой природе. Понятие силикатной промышленности. | Знать/понимать: химическую символику: формулы оксида кремния (IV) и кремниевой кислоты. Уметь называть оксид кремния (IV), кремниевую кислоту и её соли по их химическим формулам; характеризовать: химические свойства оксида кремния (IV), кремниевой кислоты в свете теории электролитической диссоциации; народнохозяйственное значение силикатов; составлять: химические формулы силикатов; уравнения химических реакций, характеризующие свойства кремния, оксида кремния (IV) и кремниевой кислоты. |
| Текущий Д/З § 35, упр. 1, 4
| 26 неделя |
| 25 | Силикатная промышленность | Урок ознакомления с новым материалом | Понятие о силикатной промышленности. Стекло. Цемент. Керамика. | Уметь характеризовать: силикатную промышленность: виды силикатов, их применение.
| Д.: Образцы стекла, керамики, цемента. | Текущий Д/З § 35 | 27 неделя |
| 26 | Практическая работа №5 «Получение, собирание и распознавание газов»
| Практическая работа | Получение, собирание и распознавание газов. | Уметь характеризовать: способы получение, собирания и распознавания важнейших газов; составлять: уравнения химических реакций получения газов; обращаться: с химической посудой и лабораторным оборудованием; |
|
| 27 неделя |
| 27 | Обобщение по теме «Неметаллы» | Итоговый урок |
| Вычисления по химическим формулам и уравнениям реакций, протекающих с участием неметаллов и их соединений. |
|
| 28 неделя |
| 28 | Контрольная работа по теме «Неметаллы» | Контрольный урок |
|
|
| Итоговый | 28 неделя |
| Тема 4. Обобщение знаний по химии за курс основной школы. Подготовка к государственной итоговой аттестации (ГИА) (10 часов) |
| 1-2 | Периодический закон и периодическая система Д.И.Менделеева в свете теории строения атома | Урок обобщения и систематизации знаний | ПЗ и ПСХЭ Д.И.Менделеева. Физический смысл порядкового номера элемента, номеров периода и группы. Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов Значение ПЗ. | Представление информации по теме «Периодический закон и периодическая система Д.И.Менделеева в свете теории строения атома» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. |
| Текущий Д/З § 36, упр. 1 - 10
| 29 неделя |
| 3 | Виды химической связи и типы кристаллических решеток. Взаимосвязь строения и свойств веществ. | Урок обобщения и систематизации знаний | Виды химической связи и типы кристаллических решеток. Взаимосвязь строения и свойств веществ. | Представление информации по теме «Виды химической связи и типы кристаллических решеток. Взаимосвязь строения и свойств веществ» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. |
| Текущий Д/З § 37, упр. 1 - 10
| 30 неделя |
| 4 | Классификация химических реакций по различным признакам. Скорость химических реакций. | Урок обобщения и систематизации знаний | Классификация химических реакций по различным признакам (число и состав реагирующих и образующихся веществ; наличие границы раздела фаз: тепловой эффект; изменение степеней окисления атомов; использование катализатора; направление протекания). Скорость химических реакций и факторы, влияющие на нее. | Представление информации по теме «Классификация химических реакций по различным признакам. Скорость химических реакций» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. |
| Текущий Д/З § 38, упр. 1 - 10
| 30 неделя |
| 5 | Диссоциация электролитов в водных растворах. Ионные уравнения. | Урок обобщения и систематизации знаний | Электролитическая диссоциация кислот, оснований, солей. Сущность реакций ионного обмена и условия их протекания. Классификация ионов и их свойства. Составление полных и сокращенных ионных уравнений реакций. Таблица растворимости кислот, оснований и солей в воде. | Представление информации по теме «Диссоциация электролитов в водных растворах. Ионные уравнения» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. Определение понятия «ионные реакции». Составление молекулярных, полных и сокращенных ионных уравнений реакций с участием электролитов. | ЛР. Взаимодействие растворов хлорида натрия и нитрата серебра. ЛР. Получение нерастворимого гидроксида и взаимодействие его с кислотами. | Текущий Д/З § 39, упр. 1-10
| 31 неделя |
| 6 | Окислительно-восстановительные реакции. | Урок обобщения и систематизации знаний | Окислительно-восстановительные реакции. Окислитель. Восстановитель. | Представление информации по теме «Окислительно-восстановительные реакции» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. |
| Текущий Д/З § 40, упр. 1-10
| 31 неделя |
| 7-8 | Классификация и свойства неорганических веществ. | Урок обобщения и систематизации знаний | Простые и сложные вещества. Металлы и неметаллы. Состав, классификация и общие химические свойства оксидов и гидроксидов (оснований, кислот, амфотерных гидроксидов), солей в свете ТЭД. | Представление информации по теме «Классификация и свойства неорганических веществ» в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ. Выполнение тестовых заданий по теме. |
| Текущий Д/З § 41, упр. 1-10 § 42, упр. 1-10
| 32 неделя |
| 9-10 | Тренинг-тестирование по вариантам ГИА прошлых лет и демоверсии. | Урок обобщения и систематизации знаний | Тренинг-тестирование по вариантам ГИА прошлых лет и демоверсии. | Выполнение теста за курс основной школы. |
|
| 33неделя |
| 11-12 | РЕЗЕРВ. |
|
|
|
|
| 34 неделя |
2
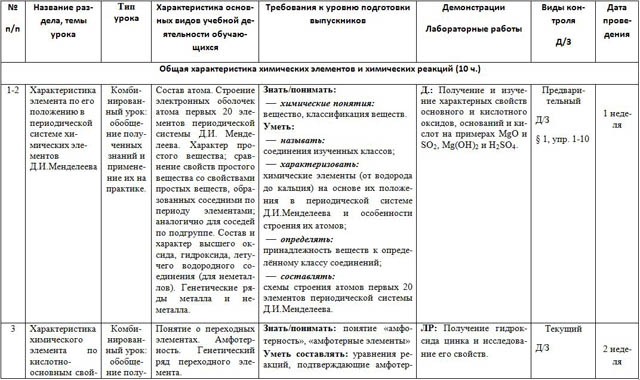

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии для 9-х классов (0.39 MB)
Рабочая программа по химии для 9-х классов (0.39 MB)
 0
0 614
614 3
3 Нравится
0
Нравится
0


