| | Пояснительная записка Рабочая программа разработана на основе авторской программы О.С.Габриеляна, соответствующей Федеральному компоненту Государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений / О.С.Габриелян. – 2-е издание, переработанное и дополненное – М.: Дрофа, 2013.). Авторской программе соответствует учебник: «Химия 9 класс» О.С.Габриелян - рекомендовано Министерством образования и науки РФ / 10-е издание, переработанное – М.: Дрофа, 2013 Рабочая программа рассчитана на 3 часа в неделю (всего 105 часов). Контрольных работ – 5, практических работ – 8. Изучение химии в основной школе направлено на достижение следующих целей: · освоение важнейших знаний об основных понятиях и законах химии, химической символике; · овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций; · развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями; · воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры; · применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
При составлении рабочей программы использовался учебно-методический комплект: для учителя: 1. Габриелян О.С. Методическое пособие для учителя. – М.: Дрофа, 1998. 2. Габриелян О.С., Остроумов И.Г. Химия. 8 класс: Настольная книга учителя. - М.: Дрофа, 2004. 3. Габриелян О.С. Химия. 8 класс: контрольные и проверочные работы. - М.: Дрофа, 2003.
для учащихся: 1. Химия. 8 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян. - М.: Дрофа, 2007. 2. Габриелян О.С., Яшукова А.В. Химия. 8 класс: рабочая тетрадь к учебнику Габриеляна О.С. – М.: Дрофа, 2007.
Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования – атомах, изотопах, ионах; простых веществах и важнейших соединениях элементов (оксидах, основаниях, кислотах, солях); о строении вещества, некоторых закономерностях протекания реакций и их классификации. В тематическом планировании, следуя, в основном идее О.С. Габриеляна, несколько изменил последовательность изучения тем, используя принципы опережающего обучения и неоднократного обращения к наиболее сложным вопросам курса, таким как: окислительно-восстановительные реакции, составление химических формул и уравнений, решение задач по химическим уравнениям, а так же даю понятие «валентность» одновременно с понятием «степень окисления». На изучение темы №4 отвожу 11 часов вместо 10. Часы добавлены за счет резервного времени. Изменение планирования позволяет изучать многие темы в проблемном режиме, повышает интерес к предмету с первых уроков. Принципиальным моментом является перепланирование изучения тем 5 и 8 - «Химический практикум», а именно: практические работы проводятся не блоком, а при изучении соответствующих тематических вопросов. Так практическую работу №1 «Приемы обращения с лабораторным оборудованием» и практическую работу №2 «Наблюдение за горящей свечой» провожу во введении; практическую работу №3 «Анализ почвы и воды», практическую работу №4 «Приготовление раствора сахара с заданной массовой долей растворенного вещества» провожу в теме №3 «Соединения химических элементов»; практическую работу №5 «Признаки химических реакций» провожу в теме №4 «Изменения, происходящие с веществами»; практическую работу №6 «Условия протекания химических реакций между растворами электролитов», практическую работу №7 «Свойства кислот, оснований, оксидов и солей» и практическую работу №8 «Решение экспериментальных задач» провожу в теме №5 «Растворение. Растворы. Свойства растворов электролитов». Благодаря данной перепланировке логически изученные темы подтверждаются экспериментально. Курс 8 класса заканчивается темой «Растворение. Растворы. Свойства растворов электролитов». В данную тему включены 3 практические работы, так же чередуя теоретический материал раздела. Данная рабочая программа может быть реализована при использовании традиционной технологии обучения, а также элементов других современных образовательных технологий, передовых форм и методов обучения, таких как проблемный метод, развивающее обучение, компьютерные технологии, тестовый контроль знаний и др. в зависимости от склонностей, потребностей, возможностей и способностей каждого конкретного класса в параллели. Требования к уровню подготовки учащихся В результате изучений данного предмета в 8 классе учащиеся должны: знать/понимать: важнейшие химические понятия, основные законы химии, основные теории химии, важнейшие вещества и материалы; уметь: называть, определять, характеризовать вещества, объяснять явления и свойства, выполнять химический эксперимент; использовать: приобретённые знания и умения в практической деятельности и повседневной жизни. Тема «Введение» - 5 часов Учащиеся должны знать: Определение важнейших понятий: простые и сложные вещества, химический элемент, атом, молекула, различать понятия «вещество» и «тело», «простое вещество» и «химический элемент». Определение химической формулы вещества, формулировку закона постоянства состава. Знаки первых 20 химических элементов. Понимать и записывать химические формулы веществ. Правила техники безопасности при работе в химической лаборатории. Уметь: отличать химические реакции от физических явлений. Использовать приобретённые знания для безопасного обращения с веществами и материалами, экологически грамотного поведения в окружающей среде, оценки влияния химического загрязнения окружающей среды на организм человека. Определять положение химического элемента в Периодической системе. Называть химические элементы. Определять состав веществ по химической формуле, принадлежность к простым и сложным веществам. Вычислять массовую долю химического элемента по формуле соединения. Тема 1. Атомы химических элементов - 8 часов Учащиеся должны знать: определение понятия «химический элемент», формулировку Периодического закона, определение понятий: «химическая связь», «ион», «ионная связь», определение металлической связи. Уметь: объяснять физический смысл атомного (порядкового) номера химического элемента. Объяснять физический смысл номера группы и периода, составлять схемы строения атомов первых 20 элементов ПСХЭ Д.И. Менделеева. Объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп. Характеризовать химические элементы (от Н до Са) на основе их положения в ПСХЭ и особенностей строения их атомов. Определять виды химических связей в соединениях. Тема 2. Простые вещества - 7 часов Учащиеся должны знать: общие физические свойства металлов. Определение понятий «моль», «молярная масса». Определение молярного объёма газов. Уметь: характеризовать связь между составом, строением и свойствами металлов и неметаллов. Характеризовать физические свойства неметаллов. Вычислять молярную массу по формуле соединения, массу вещества и число частиц по известному количеству вещества (и обратные задачи), объём газа по количеству, массу определённого объёма или числа молекул газа (и обратные задачи). Тема 3. Соединения химических элементов – 15 часов Учащиеся должны знать: определения степени окисления, электроотрицательности, оксидов, оснований, кислот и солей, кристаллических решёток, смесей, массовой или объёмной доли растворённого вещества. Уметь: определять степень окисления элементов в бинарных соединениях, составлять формулы соединений по степени окисления, называть бинарные соединения. Определять принадлежность веществ к классам оксидов, оснований, кислот и солей, называть их, составлять формулы. Знать качественные реакции на углекислый газ, распознавания щелочей и кислот. Характеризовать и объяснять свойства веществ на основании вида химической связи и типа кристаллической решётки. Вычислять массовую долю вещества в растворе, готовить растворы заданной концентрации. Тема 4. Изменения, происходящие с веществами – 11 часов Учащиеся должны знать: способы разделения смесей. Определение понятия «химическая реакция», признаки и условия течения химических реакций по поглощению и выделению энергии. Определение понятия «химическая реакция». Уметь: обращаться с химической посудой и лабораторным оборудованием при проведении опытов с целью очистки загрязнённой поваренной соли. Составлять уравнения химической реакции на основе закона сохранения массы веществ. Вычислять по химическим уравнениям массу, объём или количество одного из продуктов реакции по массе исходного вещества и вещества, содержащего определённую долю примесей. Отличать реакции разложения, соединения, замещения и обмена друг от друга, составлять уравнения реакций данных типов. Составлять уравнения реакций взаимодействия металлов с растворами кислот и солей, используя ряд активности металлов. Определять возможность протекания реакций обмена в растворах до конца. Тема 5. Растворение. Растворы. Свойства растворов электролитов – 21 час Учащиеся должны знать: определение понятия «растворы», условия растворения веществ в воде. Определение понятия «электролит», «неэлектролит», «электролитическая диссоциация», «сильный электролит», «слабый электролит», Понимать: сущность процесса электролитической диссоциации. Основные положения теории электролитической диссоциации. Определение кислот, щелочей и солей с точки зрения ТЭД. Классификацию и химические свойства кислот, оснований, оксидов и солей. Определение понятий «окислитель», «восстановитель», «окисление», «восстановление». Уметь: пользоваться таблицей растворимости. Составлять уравнения электролитической диссоциации кислот, щелочей и солей. Составлять уравнения реакций ионного обмена, понимать их сущность. Определять возможность протекания реакций ионного обмена. Составлять уравнения реакций, характеризующих химические свойства кислот, оснований, оксидов и солей в молекулярном и ионном виде. Составлять уравнения реакций, характеризующие химические свойства и генетическую связь основных классов неорганических соединений в молекулярном и ионном виде. Определять окислители и восстановители, отличать окислитель – восстановительные реакции от других типов реакций, расставлять коэффициенты в окислительно – восстановительных реакциях методом электронного баланса.
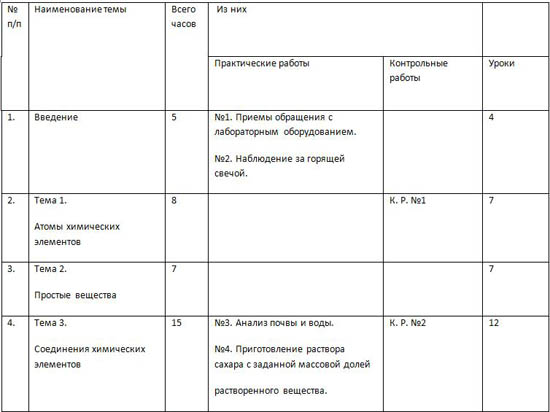
Учебно-тематический план по химии 8 класс (3 час в неделю) — 105 часов. Автор УМК - О. С. Габриелян | № п/п | Наименование темы | Всего часов | Из них |
| | Практические работы | Контрольные работы | Уроки
| | 1. | Введение | 5 | №1. Приемы обращения с лабораторным оборудованием. №2. Наблюдение за горящей свечой. | | 4 | | 2. | Тема 1. Атомы химических элементов | 8 | | К.Р. №1 | 7 | | 3. | Тема 2. Простые вещества | 7 | | | 7 | | 4. | Тема 3. Соединения химических элементов | 15 | №3. Анализ почвы и воды. №4. Приготовление раствора сахара с заданной массовой долей растворенного вещества. | К.Р. №2 | 12 | | 5. | Тема 4. Изменения, происходящие с веществами. | 11 | №5. Признаки химических реакций. | К.Р. №3 | 9 | | 6. | Тема 5. Растворение. Растворы. Свойства растворов электролитов. | 21 | № 6 . Условия протекания химических реакций между растворами электролитов. №7.Свойства кислот, оснований, оксидов и солей. №8. Решение экспериментальных задач. | К.Р. №4 | 17 | | | Итоговая контрольная работа | 1 | | К.Р.№5 | | | | Резервное время | 2 | | | 2 | | | Итого | 70 | 8 | 5 | 57 |
|
Содержание тем учебного курса химии в 8 классе
Введение – 5 часов
Предмет химии. Основные понятия и теории химии.
Превращения веществ. Физические и химические явления.
Краткие сведения по истории развития химии.
Атомы. Молекулы. Химические элементы. Химические знаки.
Система химических элементов Д.И.Менделеева.
Химические формулы. Простые и сложные вещества. Закон постоянства состава вещества.
Относительная атомная и молекулярная массы.
Массовая доля элементов в веществах.
I. Атомы химических элементов – 8 часов
Строение атома. Состав атомных ядер.
Изменение числа протонов и нейтронов в ядре. Изотопы.
Состояние электронов в атоме.
Периодичность в изменении свойств элементов. Периодический закон Д.И.Менделеева.
Периодическая система в свете теории строения атома.
Характеристика химического элемента и его свойств на основе положения в периодической системе и теории строения атома
Химическая связь. Ионная связь. Ковалентная связь. Электроотрицатльность. Полярные и неполярные связи. Металлическая связь.
II. Простые вещества – 7 часов
Простые вещества металлы и неметаллы. Аллотропия.
Количество вещества. Молярная масса и молярный объем. Относительная плотность. Закон Авогадро.
III. Соединения химических элементов - 15 часов
Степень окисления химических элементов. Определение степени окисления по формулам соединений. Бинарные соединения. Оксиды Составление формул бинарных соединений по степени окисления. Основания. Кислоты. Соли. Классификация неорганических веществ. Аморфное и кристаллическое состояние вещества. Кристаллические решетки. Чистые вещества и смеси. Разделение смесей. Очистка веществ. Массовая и объемная доли компонента смеси.
IV. Изменения, происходящие с веществами – 11 часов
Сущность химических реакций и условия их протекания. Тепловой эффект реакции.
Законы сохранения массы и энергии. Химическое уравнение.
Расчеты по химическим уравнениям.
Типы химических реакций: разложения, соединения, замещения, обмена.
Вода и ее свойства.
Простейшие операции с веществом. Химический практикум – 5 часов
Практическая работа № 1. Правила по технике безопасности в химическом кабинете. Изучение лабораторного оборудования и приемы обращения с ним.
Практическая работа № 2. Наблюдения за изменениями, происходящими с горящей свечой.
Практическая работа № 3. Анализ почвы и воды.
Практическая работа № 4. Признаки протекания химических реакций
Практическая работа № 5. Приготовление раствора сахара и определение массовой доли сахара в растворе.
V. Растворение. Растворы. Свойства растворов электролитов – 21 час
Растворение – физико-химический процесс. Растворимость. Растворы. Гидраты и кристаллогидраты.
Электролиты и неэлектролиты. Электролитическая диссоциация. Основные положения ТЭД. Механизм диссоциации. Степень диссоциации. Сильные и слабые электролиты
Ионы. Свойства ионов. Классификация ионов. Ионные уравнения реакций.
Кислоты, основания, оксиды, соли в свете ТЭД. Генетическая связь между классами неорганических веществ.
Окислительно-восстановительные реакции. Окислитель и восстановитель. Свойства классов веществ в свете ОВР.
Свойства электролитов. Химический практикум
Практическая работа № 1.Условия протекания химических реакций между растворами электролитов до конца.
Практическая работа № 2. Свойства кислот, оснований, оксидов, солей.
Практическая работа № 3. Решение экспериментальных задач.
VI. Резервное время 2 часа.
Формы и средства контроля
Контроль (текущий, рубежный, итоговый) за уровнем знаний учащихся предусматривает проведение лабораторных, практических, самостоятельных, тестовых и контрольных работ.
Контрольных работ - 4, по темам: «Атомы химических элементов», «Соединения химических элементов», «Изменения, происходящие с веществами», «Растворение. Растворы. Свойства растворов электролитов», самостоятельные работы по темам «Введение» и «Простые вещества».
Кроме вышеперечисленных основных форм контроля проводятся текущие самостоятельные работы в рамках каждой темы в виде фрагмента урока.
Критерии и нормы оценки знаний обучающихся
1. Оценка устного ответа
Отметка «5»:
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4»;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З»:
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении;
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок;
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала:
для теста из пяти вопросов
• нет ошибок — оценка «5»;
• одна ошибка — оценка «4»;
• две ошибки — оценка «З»;
• три ошибки — оценка «2».
Для теста из 30 вопросов:
• 25-З0 правильных ответов — оценка «5»;
• 19-24 правильных ответов — оценка «4»;
• 13-18 правильных ответов — оценка «З»;
• меньше 12 правильных ответов — оценка «2».
6. Оценка реферата.
Реферат оценивается по следующим критериям:
• соблюдение требований к его оформлению;
• необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;
• умение обучающегося свободно излагать основные идеи, отраженные в реферате;
• способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них.
3. Критерии и нормы оценки знаний и умений обучающихся
Общедидактические
Оценка «5» ставится в случае:
1.Знания, понимания, глубины усвоения обучающимися всего объёма программного материала.
2.Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применять полученные знания в незнакомой ситуации.
3. Отсутствия ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранения отдельных неточностей с помощью дополнительных вопросов учителя, соблюдения культуры письменной и устной речи, правил оформления письменных работ.
Оценка «4» ставится в случае:
1. Знания всего изученного программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Допущения незначительных (негрубых) ошибок, недочётов при воспроизведении изученного материала; соблюдения основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка «3» ставится в случае:
1. Знания и усвоения материала на уровне минимальных требований программы, затруднения при самостоятельном воспроизведении, возникновения необходимости незначительной помощи преподавателя.
2. Умения работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличия грубой ошибки, нескольких грубых ошибок при воспроизведении изученного материала; незначительного несоблюдения основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка «2» ставится в случае:
1. Знания и усвоения материала на уровне ниже минимальных требований программы; наличия отдельных представлений об изученном материале.
2. Отсутствия умения работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличия нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительного несоблюдения основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка «1» ставится в случае:
1. Нет ответа.
Критерии и нормы оценки знаний и умений обучающихся за устный ответ.
Оценка "5" ставится, если ученик:
1.Показывает глубокое и полное знание и понимание всего программного материала; полное понимание сущности рассматриваемых понятий, явлений и закономерностей, теорий, взаимосвязей.
2.Умеет составить полный и правильный ответ на основе изученного материала; выделять главные положения, самостоятельно подтверждать ответ конкретными примерами, фактами; самостоятельно и аргументировано делать анализ, обобщения, выводы; устанавливать межпредметные связи (на основе ранее приобретённых знаний) и внутрипредметные связи, творчески применять полученные знания в незнакомой ситуации; последовательно, чётко, связно, обоснованно и безошибочно излагать учебный материал. Умеет составлять ответ в логической последовательности с использованием принятой терминологии; делать собственные выводы; формулировать точное определение и истолкование основных понятий, законов, теорий. Может при ответе не повторять дословно текст учебника; излагать, материал литературным языком; правильно и обстоятельно отвечать на дополнительные вопросы учителя; самостоятельно и рационально использовать наглядные пособия, справочные материалы, учебник, дополнительную литературу, первоисточники; применять систему условных обозначений при ведении записей, сопровождающих ответ; использовать для доказательства выводов из наблюдений и опытов.
3. Самостоятельно, уверенно и безошибочно применяет полученные знания в решении проблем на творческом уровне; допускает не более одного недочёта, который легко исправляет по требованию учителя; имеет необходимые навыки работы с приборами, чертежами, схемами, графиками, картами, сопутствующими ответу; записи, сопровождающие ответ, соответствуют требованиям.
Оценка "4" ставится, если ученик:
1. Показывает знания всего изученного программного материала. Даёт полный и правильный ответ на основе изученных теорий; допускает незначительные ошибки и недочёты при воспроизведении изученного материала, небольшие неточности при использовании научных терминов или в выводах, обобщениях из наблюдений. Материал излагает в определённой логической последовательности, при этом допускает одну негрубую ошибку или не более двух недочётов, которые может исправить самостоятельно при требовании или небольшой помощи преподавателя; подтверждает ответ конкретными примерами; правильно отвечает на дополнительные вопросы учителя.
2.Умеет самостоятельно выделять главные положения в изученном материале; на основании фактов и примеров обобщать, делать выводы. Устанавливать внутрипредметные связи. Может применять полученные знания на практике в видоизменённой ситуации, соблюдать основные правила культуры устной речи; использовать при ответе научные термины.
3. Не обладает достаточным навыком работы со справочной литературой, учебником, первоисточником (правильно ориентируется, но работает медленно).
Оценка "3" ставится, если ученик:
1. Усваивает основное содержание учебного материала, но имеет пробелы, не препятствующие дальнейшему усвоению программного материала.
2. Излагает материал несистематизированно, фрагментарно, не всегда последовательно; показывает недостаточную сформированность отдельных знаний и умений; слабо аргументирует выводы и обобщения, допускает ошибки при их формулировке; не использует в качестве доказательства выводы и обобщения из наблюдений, опытов или допускает ошибки при их изложении; даёт нечёткие определения понятий.
3. Испытывает затруднения в применении знаний, необходимых для решения задач различных типов, практических заданий; при объяснении конкретных явлений на основе теорий и законов; отвечает неполно на вопросы учителя или воспроизводит содержание текста учебника, но недостаточно понимает отдельные положения, имеющие важное значение в этом тексте, допуская одну-две грубые ошибки.
Оценка "2" ставится, если ученик:
1. Не усваивает и не раскрывает основное содержание материала; не знает или не понимает значительную часть программного материала в пределах поставленных вопросов; не делает выводов и обобщений.
2. Имеет слабо сформированные и неполные знания, не умеет применять их при решении конкретных вопросов, задач, заданий по образцу.
3. При ответе на один вопрос допускает более двух грубых ошибок, которые не может исправить даже при помощи учителя.
Оценка «1» ставится в случае:
1. Нет ответа.
Примечание.При окончанию устного ответа учащегося педагогом даётся краткий анализ ответа, объявляется мотивированная оценка, возможно привлечение других учащихся для анализа ответа.
Критерии и нормы оценки знаний и умений обучающихся за самостоятельные письменные и контрольные работы.
Оценка «5» ставится, если ученик:
1. Выполняет работу без ошибок и /или/ допускает не более одного недочёта.
2. Соблюдает культуру письменной речи; правила оформления письменных работ.
Оценка «4» ставится, если ученик:
1. Выполняет письменную работу полностью, но допускает в ней не более одной негрубой ошибки и одного недочёта и /или/ не более двух недочётов.
2. Соблюдает культуру письменной речи, правила оформления письменных работ, но -допускает небольшие помарки при ведении записей.
Оценка «3» ставится, если ученик:
1. Правильно выполняет не менее половины работы.
2. Допускает не более двух грубых ошибок, или не более одной грубой, одной негрубой ошибки и одного недочёта, или не более трёх негрубых ошибок, или одной негрубой ошибки и трёх недочётов, или при отсутствии ошибок, но при наличии пяти недочётов.
3. Допускает незначительное несоблюдение основных норм культуры письменной речи, правил оформления письменных работ.
Оценка «2» ставится, если ученик:
1. Правильно выполняет менее половины письменной работы.
2. Допускает число ошибок и недочётов, превосходящее норму, при которой может быть выставлена оценка "3".
3. Допускает значительное несоблюдение основных норм культуры письменной речи, правил оформления письменных работ.
Оценка «1» ставится в случае:
1. Нет ответа.
Примечание. — учитель имеет право поставить ученику оценку выше той, которая предусмотрена нормами, если им работа выполнена в оригинальном варианте. — оценки с анализом работ доводятся до сведения учащихся, как правило, на последующем уроке; предусматривается работа над ошибками и устранение пробелов в знаниях и умениях учеников.
Критерии и нормы оценки знаний и умений обучающихся за практические и лабораторные работы.
Оценка «5» ставится, если:
1. Правильной самостоятельно определяет цель данных работ; выполняет работу в полном объёме с соблюдением необходимой последовательности проведения опытов, измерений.
2. Самостоятельно, рационально выбирает и готовит для выполнения работ необходимое оборудование; проводит данные работы в условиях, обеспечивающих получение наиболее точных результатов.
3. Грамотно, логично описывает ход практических (лабораторных) работ, правильно формулирует выводы; точно и аккуратно выполняет все записи, таблицы, рисунки, чертежи, графики, вычисления.
4. Проявляет организационно-трудовые умения: поддерживает чистоту рабочего места, порядок на столе, экономно расходует материалы; соблюдает правила техники безопасности при выполнении работ.
Оценка «4» ставится, если ученик:
1. Выполняет практическую (лабораторную) работу полностью в соответствии с требованиями при оценивании результатов на "5", но допускает в вычислениях, измерениях два — три недочёта или одну негрубую ошибку и один недочёт.
2. При оформлении работ допускает неточности в описании хода действий; делает неполные выводы при обобщении.
Оценка «3» ставится, если ученик:
1.1 Правильно выполняет работу не менее, чем на 50%, однако объём выполненной части таков, что позволяет получить верные результаты и сделать выводы по основным, принципиальным важным задачам работы.
2. Подбирает оборудование, материал, начинает работу с помощью учителя; или в ходе проведения измерений, вычислений, наблюдений допускает ошибки, неточно формулирует выводы, обобщения.
3. Проводит работу в нерациональных условиях, что приводит к получению результатов с большими погрешностями; или в отчёте допускает в общей сложности не более двух ошибок (в записях чисел, результатов измерений, вычислений, составлении графиков, таблиц, схем и т.д.), не имеющих для данной работы принципиального значения, но повлиявших на результат выполнения.
4. Допускает грубую ошибку в ходе выполнения работы: в объяснении, в оформлении, в соблюдении правил техники безопасности, которую ученик исправляет по требованию учителя.
Оценка "2" ставится, если ученик:
1. Не определяет самостоятельно цель работы, не может без помощи учителя подготовить соответствующее оборудование; выполняет работу не полностью, и объём выполненной части не позволяет сделать правильные выводы.
2. Допускает две и более грубые ошибки в ходе работ, которые не может исправить по требованию педагога; или производит измерения, вычисления, наблюдения неверно.
Оценка «1» ставится в случае:
1.Нет ответа.
Критерии и нормы оценки знаний и умений обучающихся за наблюдением объектов.
Оценка «5» ставится, если ученик:
1. Правильно проводит наблюдение по заданию учителя.
2. Выделяет существенные признаки у наблюдаемого объекта, процесса.
3. Грамотно, логично оформляет результаты своих наблюдений, делает обобщения, выводы.
Оценка "4" ставится, если ученик:
1. Правильно проводит наблюдение по заданию учителя.
2. Допускает неточности в ходе наблюдений: при выделении существенных признаков у наблюдаемого объекта, процесса называет второстепенные.
3. Небрежно или неточно оформляет результаты наблюдений.
Оценка "3" ставится, если ученик:
1. Допускает одну-две грубые ошибки или неточности в проведении наблюдений по заданию учителя.
2. При выделении существенных признаков у наблюдаемого объекта, процесса называет лишь некоторые из них.
3. Допускает одну-две грубые ошибки в оформлении результатов, наблюдений и выводов.
Оценка «2» ставится, если ученик:
1.Допускает три-четыре грубые ошибки в проведении наблюдений по заданию учителя.
2. Неправильно выделяет признаки наблюдаемого объекта, процесса.
3. Допускает три-четыре грубые ошибки в оформлении результатов наблюдений и выводов.
Оценка «1» ставится в случае:
1. Нет ответа.
Примечание.
Оценки с анализом умений и навыков проводить наблюдения доводятся до сведения учащихся, как правило, на последующем уроке, после сдачи отчёта.
Общая классификация ошибок.
При оценке знаний, умений, навыков следует учитывать все ошибки (грубые и негрубые), недочёты в соответствии с возрастом учащихся.
Грубыми считаются ошибки:
- незнание определения основных понятий, законов, правил, основных положений , теории, незнание формул, общепринятых символов обозначений величин, единиц их измерения, наименований этих единиц;
- неумение выделить в ответе главное; обобщить результаты изучения;
- неумение применить знания для решения задач, объяснения явления;
- неумение читать и строить графики, принципиальные схемы;
- неумение подготовить установку или лабораторное оборудование, провести опыт, ,, наблюдение, сделать необходимые расчёты или использовать полученные данные для выводов;
- неумение пользоваться первоисточниками, учебником, справочником;
- нарушение техники безопасности, небрежное отношение к оборудованию, приборам, материалам.
К негрубым относятся ошибки:
- неточность формулировок, определений, понятий, законов, теорий, вызванная неполнотой охвата основных признаков определяемого понятия или заменой 1 — 3 из этих признаков второстепенными;
- ошибки при снятии показаний с измерительных приборов, не связанные с определением цены деления шкалы;
- ошибки, вызванные несоблюдением условий проведения опыта, наблюдения, условий работы прибора, оборудования;
- ошибки в условных обозначениях на схемах, неточность графика;
- нерациональный метод решения задачи, выполнения части практической работы, недостаточно продуманный план устного ответа (нарушение логики изложения, подмена отдельных основных вопросов второстепенными);
- нерациональные методы работы со справочной литературой;
- неумение решать задачи, выполнять задания в общем виде.
Недочётам и являются:
- нерациональные приёмы вычислений и преобразований, выполнения опытов, наблюдений, практических заданий;
- арифметические ошибки в вычислениях;
- небрежное выполнение записей, чертежей, схем, графиков, таблиц;
- орфографические и пунктационные ошибки.
2. Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении;
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок;
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала:
для теста из пяти вопросов
• нет ошибок — оценка «5»;
• одна ошибка — оценка «4»;
• две ошибки — оценка «З»;
• три ошибки — оценка «2».
Для теста из 30 вопросов:
• 25-З0 правильных ответов — оценка «5»;
• 19-24 правильных ответов — оценка «4»;
• 13-18 правильных ответов — оценка «З»;
• меньше 12 правильных ответов — оценка «2».
6. Оценка реферата.
Реферат оценивается по следующим критериям:
• соблюдение требований к его оформлению;
• необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;
• умение обучающегося свободно излагать основные идеи, отраженные в реферате;
• способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них.
Учебно-методическое обеспечение
Программа: Габриелян О.С. Программы общеобразовательных учреждений. – М.: Дрофа, 2010.
Учебники:
Габриелян О.С. Химия. 8 класс. – М.: Дрофа, 2010.
Габриелян О.С. Химия. 9 класс. – М.: Дрофа, 2010.
Учебные пособия:
Габриелян О.С. Химия: методическое пособие. 8 класс. – М.: Дрофа, 2001.
Габриелян О.С. Химия: методическое пособие. 9 класс. – М.: Дрофа
, 2001
Габриелян О.С. Настольная книга учителя химии. 8 класс. – М.: Блик и К, 2001.
Габриелян О.С. Настольная книга учителя химии. 9 класс. – М.: Блик и К, 2001.
Материально-техническое обеспечение
Таблицы по химии:
Серия 1
НАЧАЛА ХИМИИ
1.1 Химические знаки и атомные массы важнейших элементов.
1.2 Распространенность химических элементов.
1.3 Формы существования химических элементов.
1.4 Вещества молекулярного и немолекулярного строения.
1.5 Структурные изменения веществ.
1.6 Способы разделения смесей.
1.7 Химические знаки и формулы.
1.8 Составление формул по валентности.
1.9 Моль – единица количества вещества.
1.10 Физические величины выражения порций вещества.
1.11 Признаки и условия течения химических реакций.
1.12 Типы химических реакций.
1.13Воздух. Кислород. Горение.
1.14 Строение пламени.
1.15 Составление формул солей.
1.16 Генетическая связь классов неорганических веществ.
Серия 2
СТРОЕНИЕ ВЕЩЕСТВА. ХИМИЧЕСКАЯ СВЯЗЬ.
2.1 Исторические модели строения атома.
2.2 Строение атома.
2.3 Электронное строение атомов элементов II периода.
2.4 Модели строения веществ.
2.5 Атомные радиусы элементов I-IV периодов.
2.6 Относительная электроотрицательность элементов.
2.7 Степени окисления элементов.
2.8 Ковалентная связь.
2.9 Валентные углы в молекулах.
2.10 Ионная связь.
2.11 Водородная связь.
2.12 Донорно-акцепторная связь.
2.13 Соотношение видов связи.
2.14 Металлическая связь.
2.15 Виды кристалов.
2.16 Валентность и степень окисления.
Серия 3
РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
3.1 Дисперсные системы.
3.2 Свойства воды.
3.3 Кривые растворимости веществ.
3.4 Способы выражения концентрации растворов.
3.5 Электролиты.
3.6 Гидратация ионов.
3.7 Растворение веществ с ионной связью.
3.8 Растворение веществ с коваленной полдярной связью.
3.9 Кислотно-основные реакции.
3.10 Реакции ионного обмена.
3.11 Гидролиз водных растворов солей.
3.12 Иониты.
Серия 4
ХИМИЧЕСКИЕ РЕАКЦИИ.
4.1 Виды энергии.
4.2 Тепловой эффект химической реакции.
4.3 Законы сохранения массы и энергии.
4.4 Измерение теплового эффекта реакции.
4.5 Скорость химической реакции.
4.6 Зависимость скорости химической реакции от условий.
4.7 Обратимые реакции.
4.8 Динамический характер химического равновесия.
4.9 Смещение химического равновесия.
4.10 Катализ
4.11 Гетерогенный катализ.
4.12 Окислительно-восстановительные реакции.
4.13 Многообразие окислительно-восстановительных реакций.
4.14 Классификация химическихреакций.
Cерия 5
НЕМЕТАЛЛЫ.
5.1 Галогены.
5.2 Химия галогенов.
5.3 Сера. Аллотропия.
5.4 Химия серы.
5.5 Химия азота.
5.6 Оксиды азота.
5.7 Азотная кислота – окислитель.
5.8 Фосфор. Аллотропия.
5.9 Классификация минеральных удобрений.
5.10 Распознавание минеральных удобрений.
5.11 Углерод. Аллотропия.
5.12 Адсорбиция.
5.13 Оксид кремния.
5.14 Силикаты.
5.15 Применение кремния и его соединения.
5.16 Инертные газы.
Серия 6.
МЕТАЛЛЫ.
6.1 Щелочные металлы.
6.2 Химия щелочных металлов.
6.3 Элементы IIА группы.
6.4 Жесткость воды.
6.5 Алюминий.
6.6 Применение алюминия.
6.7 Железо.
6.8 Виды коррозии.
6.9 Методы защиты от коррозии.
6.10 Общие свойства металлов.
Серия 7.
СТРОЕНИЕ ВЕЩЕСТВА.
7.1 Строение атома.
7.2 Электронная орбиталь.
7.3 Модели атомов некоторых элементов.
7.4 Кристаллы.
7.5 Валентность.
7.6 Степень окисления.
7.7 Изомерия часть 1.
7.8 Изомерия часть 2.
7.9 Гомология.
Серия 8.
8.1 Закономерность изменения свойств соединений элементов главных подгрупп.
8.2 Степень окисления.
8.3 Закономерность изменения свойств соединений химических элементов главных подгрупп.
8.4 Характеристика химического элемента по его положению в п. с. х. э.
8.5 Основания.
8.6 Типы химических реакций.
8.7 Окислительно-восстановительные реакции.
8.8 Переработка нефти.
8.9 Производство серной кислоты.
Серия 9.
СЕРИЯ УЧЕБНЫХ ТАБЛИЦ ПО ХИМИИ.
9.1 Классификация неорганических веществ (односторонняя)
9.2 Химические реакции.
9.3 Зависимость силы кислот и оснований от заряда и радиуса иона образующего их элемента.
9..4 Качественные реакци на катионы.
9.5 Качественные реакции на анионы.
9.6 Гибридизация атомных орбиталей.
9.7 Схемы образования и характеристика химических связей в молекулах некоторых углеводородов(метан, этан, этилен, ацетилен)
9.8 Схемы образования и характеристика химических связей в молекулах некоторых углеводородов(бутадиен, бензол)
9.9 Классификация органических соединений по структуре углеродного скелета.
9.10 Функциональные группыы и соответствующие им классы органических соединений.
9.11 Галогенирование алканов.
9.12 Геометрическая изомерия.
9.13 Важнейшие реакции алкенов.
9.14 Качественные реакции органических соединений(углеводороды и функциональные соединения.)
9.15 Качественные реакции органических соединений (функциональные соединения)
I. Справочные таблицы (постоянная экспозиция кабинета химии).
П.с.х.э. Менделеева.
Растворимость кислот, оснований, солей в воде.
Окраска индикаторов в различных средах.
Электрохимический ряд напряжения металлов.
Практикум. Инструктивные таблицы.
Нагревательные приборы. Нагревание.
П 1 Спиртовка.
П 2 Газовая горелка.
П 3 Электронагреватели.
П 4 Нагревание.
П 5 Приемы обращения с лабораторным штативом.
П 6 Получение и собирание газов.
Правила обращения с различными веществами.
П 7 Обращение с твердыми веществами.
П 8 Обращение с жидкими веществами.
Основные химические операции.
П 9 Взвешивание.
П 10 Приготовление растворов.
П 11 Фильтрование.
П 12 Перегонка.
П 13 Титрование.
.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии для 8-х классов (34.9 КB)
Рабочая программа по химии для 8-х классов (34.9 КB)
 0
0 506
506 11
11 Нравится
0
Нравится
0


