Муниципальное казенное общеобразовательное учреждение
Сарыбалыкская средняя общеобразовательная школа
| ПРИНЯТО решением методического объединения учителей естественного цикла протокол от 27.05.2015 № 5 | СОГЛАСОВАНО Заместитель директора по УВР ___________________ Е.В.Думенко 28.05.2015г. |
Рабочая программа
предмета «Химия»
для основного общего образования
|
|
Составитель: Захарова С.Г. учитель химии
|
2015
Пояснительная записка
Рабочая программа предмета «Химия» обязательной предметной области «Естесственно – научные предметы» для основного общего образования разработана на основе нормативных документов:
1. Федеральный закон от 29 декабря 2012 г. № 273- ФЗ «Об образовании в Российской Федерации».
2. Об утверждении СанПин 2.4.2.2821-10 «Санитарно – эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях»: постановление Главного государственного санитарного врача Российской Федерации от 29 декабря 2010 г. №189, г. Москва; зарегистрировано в Минюсте 3 марта 2011 г.
3.Об утверждении федеральных перечней учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих образовательные программы общего образования и имеющих государственную аккредитацию, на 2014\15 учебный год: приказ Министерства образования и науки Российской Федерации от 31 марта 2014 г. № 253 г. Москва.
4. Примерная основная образовательная программа образовательного учреждения: письмо департамента общего образования Министерства образования науки Российской Федерации от 01 ноября 2011 г. № 03-776.
5. Федеральный государственный образовательный стандарт основного общего образования: приказ Минобрнауки России от 17 декабря 2010 г. № 1897.
6. Основная образовательная программа основного общего образования муниципального казенного общеобразовательного учреждения Сарыбалыкской средней общеобразовательной школы.
- информационно – методических материалов:
1.. Авторская программа: Гара Н.Н. Программы общеобразовательных учреждений. Химия. Предметная линия учебников Г.Е. Рудзитиса, Ф.Г.Фельдмана- М.: Просвещение, 2011.
2.. Примерные программы по учебным предметам. Химия. 8-9 классы. – 2-е изд., дораб. - М. Просвещение, 2011 – 44 с. – (Стандарты второго поколения).
Цели изучения предмета с точки зрения формирования личностных, метапредметных и предметных результатов.
— обеспечение планируемых результатов по достижению выпускником целевых установок, знаний, умений, навыков, компетенций и компетентностей, определяемых личностными, семейными, общественными, государственными потребностями и возможностями обучающегося среднего школьного возраста, индивидуальными особенностями его развития и состояния здоровья;
— становление и развитие личности в её индивидуальности, самобытности, уникальности, неповторимости.
В основе реализации основной образовательной программы лежит системно-деятельностный подход.
Цель реализации основной образовательной программы основного общего образования — обеспечение выполнения требований Стандарта.
Достижение поставленной цели при разработке и реализации образовательным учреждением основной образовательной программы основного общего образования предусматривает решение следующих основных задач:
— формирование общей культуры, духовно-нравственное, гражданское, социальное, личностное и интеллектуальное развитие, самосовершенствование обучающихся, обеспечивающие их социальную успешность, развитие творческих способностей, сохранение и укрепление здоровья;
— обеспечение планируемых результатов по достижению выпускником целевых установок, знаний, умений, навыков, компетенций и компетентностей, определяемых личностными, семейными, общественными, государственными потребностями и возможностями обучающегося среднего школьного возраста, индивидуальными особенностями его развития и состояния здоровья;
— становление и развитие личности в её индивидуальности, самобытности, уникальности и неповторимости;
— обеспечение преемственности начального общего, основного общего, среднего (полного) общего образования;
— обеспечение доступности получения качественного основного общего образования, достижение планируемых результатов освоения основной образовательной программы основного общего образования всеми обучающимися, в том числе детьми-инвалидами и детьми с ограниченными возможностями здоровья;
— установление требований к воспитанию и социализации обучающихся как части образовательной программы и соответствующему усилению воспитательного потенциала школы, обеспечению индивидуализированного психолого-педагогического сопровождения каждого обучающегося, формированию образовательного базиса, основанного не только на знаниях, но и на соответствующем культурном уровне развития личности, созданию необходимых условий для её самореализации;
— обеспечение эффективного сочетания урочных и внеурочных форм организации образовательного процесса, взаимодействия всех его участников;
— взаимодействие образовательного учреждения при реализации основной образовательной программы с социальными партнёрами;
— выявление и развитие способностей обучающихся, в том числе одарённых детей, детей с ограниченными возможностями здоровья и инвалидов, их профессиональных склонностей через систему клубов, секций, студий и кружков, организацию общественно полезной деятельности, в том числе социальной практики, с использованием возможностей образовательных учреждений дополнительного образования детей;
— организация интеллектуальных и творческих соревнований, научно-технического творчества, проектной и учебно-исследовательской деятельности;
— участие обучающихся, их родителей (законных представителей), педагогических работников и общественности в проектировании и развитии внутришкольной социальной среды, школьного уклада;
— включение обучающихся в процессы познания и преобразования внешкольной социальной среды (населённого пункта, района, города) для приобретения опыта реального управления и действия;
— социальное и учебно-исследовательское проектирование, профессиональная ориентация обучающихся при поддержке педагогов, психологов, социальных педагогов, сотрудничестве с базовыми предприятиями, учреждениями профессионального образования, центрами профессиональной работы;
— сохранение и укрепление физического, психологического и социального здоровья обучающихся, обеспечение их безопасности.
Рабочая программа предмета «Химия» для основного общего образования формируется с учётом психолого-педагогических особенностей развития детей 14-15 лет.
Второй этап подросткового развития (14—15 лет, 8—9 классы) характеризуется:
1) бурным, скачкообразным характером развития, т. е. происходящими за сравнительно короткий срок многочисленными качественными изменениями прежних особенностей, интересов и отношений ребёнка, появлением у подростка значительных субъективных трудностей и переживаний;
2) стремлением подростка к общению и совместной деятельности со сверстниками;
3) особой чувствительностью к морально-этическому «кодексу товарищества», в котором заданы важнейшие нормы социального поведения взрослого мира;
4) процессом перехода от детства к взрослости, отражающимся в его характеристике как «переходного», «трудного» или «критического»;
5) обострённой, в связи с возникновением чувства взрослости, восприимчивостью к усвоению норм, ценностей и способов поведения, которые существуют в мире взрослых и в их отношениях, порождающей интенсивное формирование на данном возрастном этапе нравственных понятий и убеждений, выработку принципов, моральное развитие личности;
6) сложными поведенческими проявлениями, вызванными противоречием между потребностью в признании их взрослыми со стороны окружающих и собственной неуверенностью в этом (нормативный кризис с его кульминационной точкой подросткового кризиса независимости, проявляющегося в разных формах непослушания, сопротивления и протеста);
7) изменением социальной ситуации развития — ростом информационных перегрузок и изменением характера и способа общения и социальных взаимодействий — объёмы и способы получения информации (СМИ, телевидение, Интернет).
Учёт особенностей подросткового возраста, успешность и своевременность формирования новообразований познавательной сферы, качеств и свойств личности связывается с активной позицией учителя, а также с адекватностью построения образовательного процесса и выбора условий и методик обучения.
Основные задачи обучения:
Обеспечение соответствия основной образовательной программы требованиям ФГОС;
Обеспечение преемственности образования;
Обеспечение доступности получения качественного образования;
Достижение планируемых результатов освоения основной образовательной программы, в том числе детьми с ограниченными возможностями;
Обеспечение индивидуализированного психолого-педагогического сопровождения каждого учащегося;
Организация внеурочной работы, интеллектуальных и творческих мероприятий;
Профессиональная ориентация;
Сохранение и укрепление физического, психологического и социального здоровья обучающихся.
В системе естественнонаучного образования химия, как учебный предмет, занимает важное место в познании законов природы, в материальной жизни общества, в решении глобальных проблем человечества, в формировании научной картины мира, а также в воспитании экологической культуры людей.
Химия вносит существенный вклад в научное миропонимание, в воспитание и развитие учащихся; призвана вооружить учащихся основами химических знаний, необходимых для повседневной жизни, заложить фундамент для дальнейшего совершенствования химических знаний, а также правильно сориентировать поведение учащихся в окружающей среде.
Изучение химии в основной школе направлено:
на освоение важнейших знаний об основных понятиях и законах химии, химической символике;
на овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
на развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
на воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
на применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Цели обучения химии:
освоение знаний основных понятий и законов химии, химической символики; выдающихся открытиях в химической науке; роли химической науки в формировании современной естественнонаучной картины мира; методах научного познания;
овладение умениями наблюдать химические явления; проводить химический эксперимент; производить расчеты на основе химических формул веществ и уравнений химических реакций; обосновывать место и роль химических знаний в практической деятельности людей, развитии современных технологий;
развитие познавательных интересов, интеллектуальных и творческих способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникшими жизненными потребностями.
Задачи обучения химии:
-обеспечить усвоение учащимися знаний основ химической науки: важнейших факторов, понятий, химических законов и теорий, языка науки, доступных обобщений мировоззренческого характера в соответствии со стандартом химического образования;
-способствовать формированию у школьников предметных умений и навыков: умения работать с химическим оборудованием, наблюдать и описывать химические явления, сравнивать их, ставить несложные химические опыты, вести наблюдения через систему лабораторных, практических работ и экскурсии;
- продолжить развивать у обучающихся общеучебные умения и навыки: особое внимание уделить развитию умения пересказывать текст, аккуратно вести записи в тетради и делать рисунки.
- слуховой и зрительной памяти, внимания, мышления, воображения;
-эстетических эмоций;
-положительного отношения к учебе;
-умения ставить цели через учебный материал каждого урока, использование на уроках красивых наглядных пособий, музыкальных фрагментов, стихов, загадок, определение значимости любого урока для каждого ученика.
способствовать воспитанию совершенствующихся социально-успешных личностей;
формирование у учащихся коммуникативной и валеологической компетентностей;
формирование гуманистических отношений и экологически целесообразного поведения в быту и в процессе трудовой деятельности;
воспитание ответственного отношения к природе, бережного отношения к учебному оборудованию, умение жить в коллективе (общаться и сотрудничать) через учебный материал каждого урока.
В рабочей программе нашли отражение цели и задачи изучения химии на ступени полного общего образования, изложенные в пояснительной записке авторской программы по химии. В ней так же заложены возможности предусмотренного стандартом формирования у обучающихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В авторской программе по химии имеется резерв свободного времени. В курсе химии 8 класса 4 часа резервного времени выделяются на повторение курса химии 8 класса. В курсе химии 9 класса 6 часов резервного времени выделяются на повторение курса химии 9 класса
Данная рабочая программа учитывает образовательные потребности детей с ограниченными возможностями здоровья (ОВЗ), поэтому проводится коррекционная работа с учащимися в классе, имеющим задержку психического развития (ЗПР).
Цель: создание психолого-педагогических условий для усвоения программы детьми с ОВЗ, с учетом их индивидуальных психофизических особенностей развития.
Задачи: осуществлять индивидуальный и дифференцированный подход к детям с ОВЗ в процессе реализации программы.
Формы организации учебного процесса:
уроки изучения нового материала;
комбинированные уроки;
уроки закрепления знаний;
урок – игра, урок – практикум;
урок-лекция;
урок- исследование, урок-практикум.
Основной формой организации учебного процесса является урок.
Виды деятельности на уроке:
Основные виды деятельности на уроке:
Наблюдение
Эксперимент
Работа с книгой
Систематизация знаний
Решение познавательных задач (проблем)
Построение графиков
работа с учебно-научными текстами, справочной литературой и другими источниками информации, включая СМИ, компьютерные диски и программы, ресурсы Интернета;
создание портфолио для подготовки
I - виды деятельности со словесной (знаковой) основой:
Слушание объяснений учителя.
Слушание и анализ выступлений своих товарищей.
Самостоятельная работа с учебником.
Работа с научно-популярной литературой;
Отбор и сравнение материала по нескольким источникам.
Написание рефератов и докладов.
Вывод и доказательство формул.
Анализ формул.
Решение текстовых количественных и качественных задач.
Выполнение заданий по разграничению понятий.
Систематизация учебного материала.
II - виды деятельности на основе восприятия элементов действительности:
Наблюдение за демонстрациями учителя.
Просмотр учебных фильмов.
Анализ графиков, таблиц, схем.
Объяснение наблюдаемых явлений.
Изучение устройства приборов по моделям и чертежам.
Анализ проблемных ситуаций.
III - виды деятельности с практической (опытной) основой:
Решение экспериментальных задач.
Работа с раздаточным материалом.
Постановка опытов для демонстрации классу.
Постановка фронтальных опытов.
Выполнение фронтальных лабораторных работ.
Выполнение работ практикума.
Сборка приборов из готовых деталей и конструкций.
Выявление и устранение неисправностей в приборах.
Выполнение заданий по усовершенствованию приборов.
Разработка новых вариантов опыта.
Построение гипотезы на основе анализа имеющихся данных.
Разработка и проверка методики экспериментальной работы.
Проведение исследовательского эксперимента.
Моделирование и конструирование.
Технологии:
технология интенсификации обучения на основе схемных знаковых моделей изучения материала;
игровая технология;
здоровье - сберегающие и информационно - коммуникативные технологии;
технология дифференцированного и индивидуального обучения;
технология проблемного обучения;
теория и технология развивающего обучения;
гуманно- личностная технология.
Формы контроля знаний: устная и письменная.
Методы контроля знаний:
групповой;
фронтальный;
текущий;
тематический;
итоговый.
Кроме выше перечисленных основных форм контроля, будут осуществляться тестовые работы в рамках каждой темы в виде фрагментов урока.
Методы и приёмы обучения:
репродуктивный метод,
метод проблемного изложения,
частично-поисковый, или эвристический, метод,
исследовательский метод.
использование для познания окружающего мира различных методов (наблюдения, измерения, опыты, эксперимент); проведение практических и лабораторных работ, несложных экспериментов и описание их результатов;
использование для решения познавательных задач различных источников информации; соблюдение норм и правил поведения в химических лабораториях, в окружающей среде, а также правил здорового образа жизни
Общая характеристика учебного предмета
Особенности содержания обучения химии в основной школе обусловлены спецификой химии как науки и поставленными задачами. Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, получение веществ с заданными свойствами, исследование закономерностей химических реакций и путей управления ими в целях получения веществ, материалов, энергии. Поэтому в программе по химии нашли отражение основные содержательные линии:
•вещество — знания о составе и строении веществ, их важнейших физических и
химических свойствах, биологическом действии;
•химическая реакция — знания об условиях, в которых проявляются химические свойства
веществ, способах управления химическими процессами;
• применение веществ — знания и опыт практической деятельности с веществами, которые наиболее часто употребляются в повседневной жизни, широко используются в промышленности, сельском хозяйстве, на транспорте;
•язык химии — система важнейших понятий химии и терминов, в которых они
описываются, номенклатура неорганических веществ, т. е. их названия (в том числе и тривиальные), химические формулы и уравнения, а также правила перевода информации с естественного языка на язык химии и обратно.
Поскольку основные содержательные линии школьного курса химии тесно переплетены, в примерной программе содержание представлено не по линиям, а по блокам: «Основные понятия химии (уровень атомно-молекулярных представлений)», «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества», «Многообразие химических реакций», «Многообразие веществ».
Содержание программы направлено на освоение учащимися базовых знаний, формирование базовых компетентностей и УУД, что соответствует требованиям ФГОС к освоению обучающимися ООП. В программу включены все темы, предусмотренные примерной программой учебного курса
Место учебного предмета «Химия» в учебном плане
.
| Год обучения | Количество часов в неделю | Количество учебных недель | Всего часов |
| 8 класс | 2 | 36 | 72 |
| 9 класс | 2 | 34 | 68 |
| Итого |
|
| 140 |
Личностные, метапредметные и предметные результаты освоения учебного предмета «Химия»
8-й класс
Личностными результатами изучения предмета «Химия» являются следующие умения:
Осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки.
Постепенно выстраивать собственное целостное мировоззрение:
осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы;
оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья;
оценивать экологический риск взаимоотношений человека и природы.
Формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды - гаранта жизни и благополучия людей на Земле.
Метапредметными результатами изучения курса «Химия» является формирование универсальных учебных действий (УУД).
Регулятивные УУД:
Самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности, выбирать тему проекта.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
Составлять (индивидуально или в группе) план решения проблемы (выполнения проекта).
Работая по плану, сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно.
В диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Познавательные УУД:
Анализировать, сравнивать, классифицировать и обобщать факты и явления. Выявлять причины и следствия простых явлений.
Осуществлять сравнение, сериацию и классификацию, самостоятельно выбирая основания и критерии для указанных логических операций; строить классификацию на основе дихотомического деления (на основе отрицания).
Строить логическое рассуждение, включающее установление причинно-следственных связей.
Создавать схематические модели с выделением существенных характеристик объекта.
Составлять тезисы, различные виды планов (простых, сложных и т.п.). Преобразовывать информацию из одного вида в другой (таблицу в текст и пр.).
Вычитывать все уровни текстовой информации.
Уметь определять возможные источники необходимых сведений, производить поиск информации, анализировать и оценивать её достоверность.
Коммуникативные УУД:
организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом и т.д.).
Средством формирования коммуникативных УУД служат технология проблемного диалога (побуждающий и подводящий диалог) и работа в малых группах, также использование на уроках элементов технологии продуктивного чтения.
Предметными результатами изучения предмета «Химия» являются следующие умения:
– осознание роли веществ:
- определять роль различных веществ в природе и технике;
- объяснять роль веществ в их круговороте.
– рассмотрение химических процессов:
- приводить примеры химических процессов в природе;
- находить черты, свидетельствующие об общих признаках химических процессов и их различиях.
– использование химических знаний в быту:
– объяснять значение веществ в жизни и хозяйстве человека.
– объяснять мир с точки зрения химии:
– перечислять отличительные свойства химических веществ;
– различать основные химические процессы;
- определять основные классы неорганических веществ;
- понимать смысл химических терминов.
– овладение основами методов познания, характерных для естественных наук:
- характеризовать методы химической науки (наблюдение, сравнение, эксперимент, измерение) и их роль в познании природы;
- проводить химические опыты и эксперименты и объяснять их результаты.
– умение оценивать поведение человека с точки зрения химической безопасности по отношению к человеку и природе:
- использовать знания химии при соблюдении правил использования бытовых химических препаратов;
– различать опасные и безопасные вещества.
Восьмиклассник научится:
•описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки;
• характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
• раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», используя знаковую систему химии;
• изображать состав простейших веществ с помощью химических формул и сущность химических реакций с помощью химических уравнений;
• вычислять относительную молекулярную и молярную массы веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости;
• сравнивать по составу оксиды, основания, кислоты, соли;
• классифицировать оксиды и основания по свойствам, кислоты и соли по составу;
• описывать состав, свойства и значение (в природе и практической деятельности человека) простых веществ — кислорода и водорода;
• давать сравнительную характеристику химических элементов и важнейших соединений естественных семейств щелочных металлов и галогенов;
• пользоваться лабораторным оборудованием и химической посудой;
• проводить несложные химические опыты и наблюдения за изменениями свойств веществ в процессе их превращений; соблюдать правила техники безопасности при проведении наблюдений и опытов;
• различать экспериментально кислоты и щёлочи, пользуясь индикаторами; осознавать необходимость соблюдения мер безопасности при обращении с кислотами и щелочами.
• классифицировать химические элементы на металлы, неметаллы, элементы, оксиды и гидроксиды которых амфотерны, и инертные элементы (газы) для осознания важности упорядоченности научных знаний;
• раскрывать смысл периодического закона Д. И. Менделеева;
• описывать и характеризовать табличную форму периодической системы химических элементов;
• характеризовать состав атомных ядер и распределение числа электронов по электронным слоям атомов химических элементов малых периодов периодической системы, а также калия и кальция;
• различать виды химической связи: ионную, ковалентную полярную, ковалентную неполярную и металлическую;
• изображать электронно-ионные формулы веществ, образованных химическими связями разного вида;
• выявлять зависимость свойств веществ от строения их кристаллических решёток: ионных, атомных, молекулярных, металлических;
• характеризовать химические элементы и их соединения на основе положения элементов в периодической системе и особенностей строения их атомов;
• описывать основные этапы открытия Д. И. Менделеевым периодического закона и периодической системы химических элементов, жизнь и многообразную научную деятельность учёного;
• характеризовать научное и мировоззренческое значение периодического закона и периодической системы химических элементов Д. И. Менделеева;
• осознавать научные открытия как результат длительных наблюдений, опытов, научной полемики, преодоления трудностей и сомнений.
Восьмиклассник получит возможность научиться:
грамотно обращаться с веществами в повседневной жизни;
• осознавать необходимость соблюдения правил экологически безопасного поведения в окружающей природной среде;
• понимать смысл и необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.;
• использовать приобретённые ключевые компетентности при выполнении исследовательских проектов по изучению свойств, способов получения и распознавания веществ;
• развивать коммуникативную компетентность, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы;
• объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации, недобросовестной рекламе, касающейся использования различных веществ.
• осознавать значение теоретических знаний для практической деятельности человека;
• описывать изученные объекты как системы, применяя логику системного анализа;
• применять знания о закономерностях периодической системы химических элементов для объяснения и предвидения свойств конкретных веществ;
• развивать информационную компетентность посредством углубления знаний об истории становления химической науки, её основных понятий, периодического закона как одного из важнейших законов природы, а также о современных достижениях науки и техники.
9-й класс
Личностными результатами изучения предмета «Химия» являются следующие умения:
Постепенно выстраивать собственное целостное мировоззрение:
– осознавать современное многообразие типов мировоззрения, общественных, религиозных, атеистических, культурных традиций, которые определяют разные объяснения происходящего в мире;
– с учётом этого многообразия постепенно вырабатывать свои собственные ответы на основные жизненные вопросы, которые ставит личный жизненный опыт;
– учиться признавать противоречивость и незавершённость своих взглядов на мир, возможность их изменения.
Учиться использовать свои взгляды на мир для объяснения различных ситуаций, решения возникающих проблем и извлечения жизненных уроков.
Осознавать свои интересы, находить и изучать в учебниках по разным предметам материал (из максимума), имеющий отношение к своим интересам.
Использовать свои интересы для выбора индивидуальной образовательной траектории, потенциальной будущей профессии и соответствующего профильного образования.
Приобретать опыт участия в делах, приносящих пользу людям.
Учиться самостоятельно выбирать стиль поведения, привычки, обеспечивающие безопасный образ жизни и сохранение здоровья – своего, а также близких людей и окружающих.
Учиться самостоятельно противостоять ситуациям, провоцирующим на поступки, которые угрожают безопасности и здоровью.
Выбирать поступки, нацеленные на сохранение и бережное отношение к природе, особенно живой, избегая противоположных поступков, постепенно учась и осваивая стратегию рационального природопользования.
Учиться убеждать других людей в необходимости овладения стратегией рационального природопользования.
Использовать экологическое мышление для выбора стратегии собственного поведения в качестве одной из ценностных установок.
Средством развития личностных результатов служат учебный материал и продуктивные задания учебника, нацеленные на 6-ю линию развития – умение оценивать поведение человека с точки зрения химической безопасности по отношению к человеку и природе.
Метапредметными результатами изучения курса «Химия» является формирование универсальных учебных действий (УУД).
Регулятивные УУД:
Самостоятельно обнаруживать и формулировать проблему в классной и индивидуальной учебной деятельности.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
Составлять (индивидуально или в группе) план решения проблемы (выполнения проекта).
Подбирать к каждой проблеме (задаче) адекватную ей теоретическую модель.
Работая по предложенному и самостоятельно составленному плану, использовать наряду с основными и дополнительные средства (справочная литература, сложные приборы, компьютер).
Планировать свою индивидуальную образовательную траекторию.
Работать по самостоятельно составленному плану, сверяясь с ним и целью деятельности, исправляя ошибки, используя самостоятельно подобранные средства (в том числе и Интернет).
Свободно пользоваться выработанными критериями оценки и самооценки, исходя из цели и имеющихся критериев, различая результат и способы действий.
В ходе представления проекта давать оценку его результатам.
Самостоятельно осознавать причины своего успеха или неуспеха и находить способы выхода из ситуации неуспеха.
Уметь оценить степень успешности своей индивидуальной образовательной деятельности.
Давать оценку своим личностным качествам и чертам характера («каков я»), определять направления своего развития («каким я хочу стать», «что мне для этого надо сделать»).
Средством формирования регулятивных УУД служат технология проблемного диалога на этапе изучения нового материала и технология оценивания образовательных достижений (учебных успехов).
Познавательные УУД:
Анализировать, сравнивать, классифицировать и обобщать понятия:
- давать определение понятиям на основе изученного на различных предметах учебного материала;
- осуществлять логическую операцию установления родо-видовых отношений;
- обобщать понятия – осуществлять логическую операцию перехода от понятия с меньшим объёмом к понятию с большим объёмом.
Строить логическое рассуждение, включающее установление причинно-следственных связей.
Создавать модели с выделением существенных характеристик объекта, преобразовывать модели с целью выявления общих законов, определяющих данную предметную область.
Представлять информацию в виде конспектов, таблиц, схем, графиков.
Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации. Представлять информацию в оптимальной форме в зависимости от адресата.
Понимая позицию другого, различать в его речи: мнение (точку зрения), доказательство (аргументы), факты; гипотезы, аксиомы, теории. Для этого самостоятельно использовать различные виды чтения (изучающее, просмотровое, ознакомительное, поисковое), приемы слушания.
Самому создавать источники информации разного типа и для разных аудиторий, соблюдать информационную гигиену и правила информационной безопасности.
Уметь использовать компьютерные и коммуникационные технологии как инструмент для достижения своих целей. Уметь выбирать адекватные задаче инструментальные программно-аппаратные средства и сервисы.
Средством формирования познавательных УУД служат учебный материал и продуктивные задания учебника, нацеленные на 1–4-й линии развития:
- осознание роли веществ (1-я линия развития);
- рассмотрение химических процессов (2-я линия развития);
- использование химических знаний в быту (3-я линия развития);
- объяснение мира с точки зрения химии (4-я линия развития);
- овладение основами методов естествознания (6-я линия развития).
Коммуникативные УУД:
Отстаивая свою точку зрения, приводить аргументы, подтверждая их фактами.
В дискуссии уметь выдвинуть контраргументы, перефразировать свою мысль (владение механизмом эквивалентных замен).
Учиться критично относиться к своему мнению, с достоинством признавать ошибочность своего мнения (если оно таково) и корректировать его.
Понимая позицию другого, различать в его речи: мнение (точку зрения), доказательство (аргументы), факты; гипотезы, аксиомы, теории.
Уметь взглянуть на ситуацию с иной позиции и договариваться с людьми иных позиций.
Средством формирования коммуникативных УУД служат технология проблемного диалога (побуждающий и подводящий диалог) и работа в малых группах, также использование на уроках элементов технологии продуктивного чтения.
Девятиклассник научится:
• объяснять суть химических процессов и их принципиальное отличие от физических;
• называть признаки и условия протекания химических реакций;
• устанавливать принадлежность химической реакции к определённому типу по одному из классификационных признаков: 1) по числу и составу исходных веществ и продуктов реакции (реакции соединения, разложения, замещения и обмена); 2) по выделению или поглощению теплоты (реакции экзотермические и эндотермические); 3) по изменению степеней окисления химических элементов (реакции окислительно-восстановительные); 4) по обратимости процесса (реакции обратимые и необратимые);
• называть факторы, влияющие на скорость химических реакций;
• называть факторы, влияющие на смещение химического равновесия;
• составлять уравнения электролитической диссоциации кислот, щелочей, солей; полные и сокращённые ионные уравнения реакций обмена; уравнения окислительно-восстановительных реакций;
• прогнозировать продукты химических реакций по формулам/названиям исходных веществ; определять исходные вещества по формулам/названиям продуктов реакции;
• составлять уравнения реакций, соответствующих последовательности («цепочке») превращений неорганических веществ различных классов;
• выявлять в процессе эксперимента признаки, свидетельствующие о протекании химической реакции;
• приготовлять растворы с определённой массовой долей растворённого вещества;
• определять характер среды водных растворов кислот и щелочей по изменению окраски индикаторов;
• проводить качественные реакции, подтверждающие наличие в водных растворах веществ отдельных катионов и анионов.
• определять принадлежность неорганических веществ к одному из изученных классов/групп: металлы и неметаллы, оксиды, основания, кислоты, соли;
• составлять формулы веществ по их названиям;
• определять валентность и степень окисления элементов в веществах;
• составлять формулы неорганических соединений по валентностям и степеням окисления элементов, а также зарядам ионов, указанным в таблице растворимости кислот, оснований и солей;
• объяснять закономерности изменения физических и химических свойств простых веществ (металлов и неметаллов) и их высших оксидов, образованных элементами второго и третьего периодов;
• называть общие химические свойства, характерные для групп оксидов: кислотных, оснóвных, амфотерных;
• называть общие химические свойства, характерные для каждого из классов неорганических веществ: кислот, оснований, солей;
• приводить примеры реакций, подтверждающих химические свойства неорганических веществ: оксидов, кислот, оснований и солей;
• определять вещество-окислитель и вещество-восстановитель в окислительно-восстановительных реакциях;
• составлять окислительно-восстановительный баланс (для изученных реакций) по предложенным схемам реакций;
• проводить лабораторные опыты, подтверждающие химические свойства основных классов неорганических веществ;
• проводить лабораторные опыты по получению и собиранию газообразных веществ: водорода, кислорода, углекислого газа, аммиака; составлять уравнения соответствующих реакций.
Девятиклассник получит возможность научиться:
• составлять молекулярные и полные ионные уравнения по сокращённым ионным уравнениям;
• приводить примеры реакций, подтверждающих существование взаимосвязи между основными классами неорганических веществ;
• прогнозировать результаты воздействия различных факторов на изменение скорости химической реакции;
• прогнозировать результаты воздействия различных факторов на смещение химического равновесия.
• прогнозировать химические свойства веществ на основе их состава и строения;
• прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав;
• выявлять существование генетической взаимосвязи между веществами в ряду: простое вещество — оксид — гидроксид — соль;
• характеризовать особые свойства концентрированных серной и азотной кислот;
• приводить примеры уравнений реакций, лежащих в основе промышленных способов получения аммиака, серной кислоты, чугуна и стали;
• описывать физические и химические процессы, являющиеся частью круговорота веществ в природе;
• организовывать, проводить ученические проекты по исследованию свойств веществ, имеющих важное практическое значение.
Содержание программы учебного предмета
8—9 классы
Раздел 1. Основные понятия химии (уровень атомно-молекулярных представлений)
Предмет химии. Химия как часть естествознания. Вещества и их свойства. Методы познания в химии: наблюдение, эксперимент. Приёмы безопасной работы с оборудованием и веществами. Строение пламени.
Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография. Физические и химические явления. Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций.
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения. Кристаллические решётки: ионная, атомная и молекулярная. Кристаллические и аморфные вещества. Зависимость свойств веществ от типа кристаллической решётки. Качественный и количественный состав вещества. Простые и сложные вещества. Металлы и неметаллы. Химический элемент. Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава веществ.
Атомная единица массы. Относительная атомная и молекулярная массы. Количество вещества, моль. Молярная масса.
Валентность химических элементов. Определение валентности элементов по формуле бинарных соединений. Составление химических формул бинарных соединений по валентности.
Атомно-молекулярное учение. Закон сохранения массы веществ. Химические уравнения. Классификация химических реакций по числу и составу исходных и полученных веществ. Жизнь и деятельность М. В. Ломоносова.
Кислород. Нахождение в природе. Физические и химические свойства. Озон. Получение и применение кислорода. Круговорот кислорода в природе. Горение. Оксиды. Воздух и его состав. Медленное окисление. Защита атмосферного воздуха от загрязнений.
Водород. Нахождение в природе. Физические и химические свойства. Водород как восстановитель. Меры безопасности при работе с водородом. Получение, применение.
Вода. Методы определения состава воды — анализ и синтез. Физические и химические свойства воды. Вода в природе и способы её очистки. Аэрация воды. Вода как растворитель. Растворимость веществ в воде. Определение массовой доли растворённого вещества.
Оксиды. Состав. Классификация. Основные и кислотные оксиды. Номенклатура. Физические и химические свойства. Получение. Применение.
Основания. Состав. Классификация. Номенклатура. Физические и химические свойства. Реакция нейтрализации. Получение. Применение.
Кислоты. Состав. Классификация. Номенклатура. Физические и химические свойства. Вытеснительный ряд металлов. Применение.
Соли. Состав. Классификация. Номенклатура. Физические свойства солей. Растворимость солей в воде. Химические свойства солей. Способы получения солей.
Генетическая связь между основными классами неорганических соединений.
Раздел 2. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов. Изменение физических свойств щелочных металлов с увеличением относительной атомной массы. Изменение химической активности щелочных металлов в реакциях с кислородом и водой.
Галогены — самые активные неметаллы. Изменение физических свойств галогенов с увеличением относительной атомной массы. Изменение химической активности галогенов в реакциях с водородом и металлами. Вытеснение галогенами друг друга из растворов их солей.
Основания классификации химических элементов Д. И. Менделеева. Периодическая система как естественнонаучная классификация химических элементов. Табличная форма представления классификации химических элементов. Структура таблицы «Периодическая система химических элементов Д. И. Менделеева» (короткая форма): А - и Б-группы, периоды. Физический смысл порядкового (атомного) элемента, номера периода, номера группы (для элементов А-групп).
Строение атома: ядро и электронная оболочка. Ядерная (планетарная) модель строения атома. Состав атомных ядер: протоны и нейтроны. Изотопы. Заряд атомного ядра, массовое число, относительная атомная масса. Современная формулировка понятия «химический элемент».
Электронная оболочка атома: понятие об электронном слое, его ёмкости. Заполнение электронных слоев у атомов элементов I—III периодов.
Современная формулировка периодического закона.
Жизнь и деятельность Д. И. Менделеева.
Раздел 3. Строение вещества
Электроотрицательность химических элементов. Основные виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Валентность элементов в свете электронной теории. Степень окисления. Правила определения степени окисления элементов.
Закон Авогадро. Молярный объём газов. Относительная плотность газов. Объёмные отношения газов при химических реакциях.
Раздел 4. Многообразие химических реакций
Классификация химических реакций. Реакции соединения, разложения, замещения, обмена, экзотермические, эндотермические, окислительно-восстановительные, необратимые, обратимые.
Скорость химических реакций. Факторы, влияющие на скорость химических реакций. Первоначальные представления о катализе.
Окислительно-восстановительные реакции. Окислитель, восстановитель, окисление, восстановление с точки зрения изменения степеней окисления атомов.
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Ионы. Катионы и анионы. Гидратная теория растворов. Электролитическая диссоциация кислот, щелочей и солей. Слабые и сильные электролиты. Степень диссоциации. Реакции ионного обмена. Условия течения реакций ионного обмена до конца.
Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях.
Раздел 5. Многообразие веществ
Естественные семейства химических элементов.
Общая характеристика неметаллов по их положению в периодической системе химических элементов Д. И. Менделеева. Закономерности изменения в периодах и группах физических и химических свойств простых веществ, высших оксидов и кислородсодержащих кислот, образованных неметаллами II—III периодов.
Положение галогенов в периодической системе элементов и строение их атомов. Физические и химические свойства галогенов. Сравнительная характеристика галогенов. Применение галогенов. Хлороводород. Получение. Физические свойства. Соляная кислота и её соли. Распознавание хлоридов, бромидов и иодидов.
Положение кислорода и серы в периодической системе элементов, строение их атомов. Сера. Аллотропия серы. Физические и химические свойства. Нахождение в природе. Применение серы. Оксид серы (IV). Сероводородная и сернистая кислоты и их соли. Оксид серы (IV). Серная кислота и её соли. Окислительные свойства концентрированной серной кислоты.
Положение азота и фосфора в периодической системе элементов, строение их атомов. Азот, физические и химические свойства, получение и применение. Круговорот азота в природе. Аммиак. Физические и химические свойства аммиака, получение и применение. Соли аммония. Оксид азота(II) и оксид азота (IV). Азотная кислота и её соли. Окислительные свойства азотной кислоты.
Фосфор. Аллотропия фосфора. Физические и химические свойства фосфора. Оксид фосфора(V)- Ортофосфорная кислота и её соли.
Положение углерода и кремния в периодической системе элементов, строение их атомов. Углерод, его аллотропные модификации, физические и химические свойства. Угарный газ, его свойства и физиологическое действие. Углекислый газ, угольная кислота и её соли. Живой мир — мир углерода. Круговорот углерода в природе.
Кремний. Оксид кремния(1V). Кремниевая кислота и её соли. Стекло. Цемент.
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая связь. Физические и химические свойства металлов. Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов.
Щелочные металлы. Положение щелочных металлов в периодической системе и строение атомов. Нахождение в природе. Физические и химические свойства. Применение щелочных металлов и их соединений.
Щелочноземельные металлы. Положение щелочноземельных металлов в периодической системе и строение атомов. Нахождение в природе. Кальций и его соединения. Жёсткость воды и способы её устранения.
Алюминий. Положение алюминия в периодической системе элементов и строение его атома. Нахождение в природе. Физические и химические свойства алюминия. Амфотерность оксида и гидроксида алюминия.
Железо. Положение железа в периодической системе элементов и строение его атома. Нахождение в природе. Физические и химические свойства железа. Оксиды, гидроксиды и соли железа(II) и железа (III).
8 класс
Раздел 1. Основные понятия химии (уровень атомно-молекулярных представлений) (44 ч)
Предмет химии (7 ч)
Предмет химии. Химия как часть естествознания. Вещества и
их свойства.
Методы познания в химии: наблюдение, эксперимент.
Практическая работа 1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени.
Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография.
Практическая работа 2. Очистка загрязнённой поваренной
соли. Физические и химические явления.
Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций.
Демонстрации. Лабораторное оборудование и приёмы безопасной работы с ним. Способы очистки веществ: кристаллизация, дистилляция, хроматография. Нагревание сахара. Нагревание парафина. Горение парафина. Взаимодействие растворов: карбоната натрия и соляной кислоты, сульфата меди(II) и гидроксида натрия. Взаимодействие свежеосаждённого гидроксида меди(II) с раствором глюкозы при обычных условиях и при нагревании.
Лабораторные опыты. Рассмотрение веществ с различными физическими свойствами. Разделение смеси с помощью магнита. Примеры физических и химических явлений. Реакции, иллюстрирующие основные признаки характерных реакций
Первоначальные химические понятия (15 ч)
Атомы, молекулы и ионы.
Вещества молекулярного и немолекулярного строения. Кристаллические решётки.
Простые и сложные вещества. Химический элемент.
Язык химии. Знаки химических элементов. Относительная атомная масса.
Закон постоянства состава веществ.
Относительная молекулярная масса. Химические формулы. Качественный и количественный состав вещества.
Массовая доля химического элемента в соединении.
Валентность химических элементов. Определение валентности элементов по формуле бинарных соединений.
Составление химических формул бинарных соединений по валентности.
Закон сохранения массы веществ. Химические уравнения.
Атомно-молекулярное учение. Жизнь и деятельность М. В. Ломоносова.
Классификация химических реакций по числу и составу исходных и полученных веществ.
Моль — единица количества вещества. Молярная масса.
Решение расчётных задач по химическим уравнениям реакций.
Контрольная работа по теме.
Демонстрации. Примеры простых и сложных веществ в разных агрегатных состояниях. Шаростержневые модели молекул метана, аммиака, воды, хлороводорода, оксида углерода (IV). Модели кристаллических решёток. Опыты, подтверждающие закон сохранения массы веществ. Химические соединения количеством вещества 1 моль.
Лабораторные опыты. Ознакомление с образцами простых (металлы и неметаллы) и сложных веществ, минералов и горных пород.
Расчётные задачи. Вычисление относительной молекулярной массы вещества по его формуле. Вычисление массовой доли элемента в химическом соединении. Установление простейшей формулы вещества по массовым долям элементов. Вычисления по химическим уравнениям массы или количества вещества по известной массе или количеству одного из вступающих в реакцию или получающихся веществ
Кислород (5 ч)
Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства.
Химические свойства кислорода. Горение и медленное окисление. Оксиды. Применение кислорода.
Озон. Свойства и применение.
Практическая работа 3. Получение кислорода и изучение его свойств.
Воздух и его состав. Защита атмосферного воздуха от загрязнений.
Демонстрации. Физические свойства кислорода. Получение и собирание кислорода методом вытеснения воздуха и воды. Условия возникновения и прекращения горения. Определение состава воздуха
Лабораторные опыты. Ознакомление с образцами оксидов
Водород (3 ч)
Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства. Меры безопасности при работе с водородом.
Химические свойства водорода. Применение водорода.
Практическая работа 4. Получение водорода и изучение его свойств.
Демонстрации. Получение водорода в аппарате Киппа. Проверка водорода на чистоту. Горение водорода на воздухе и в кислороде. Собирание водорода методом вытеснения воздуха и воды.
Лабораторные опыты. Взаимодействие водорода с оксидом меди(II)
Вода. Растворы (6 ч)
Вода. Методы определения состава воды — анализ и синтез. Вода в природе и способы её очистки. Аэрация воды.
Физические и химические свойства воды.
Вода как растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде.
Массовая доля растворённого вещества.
Повторение и обобщение по темам 3—5. Приготовление растворов солей с определённой массовой долей растворённого вещества.
Контрольная работа по темам 3—5.
Демонстрации. Анализ воды. Синтез воды. Взаимодействие воды с натрием, кальцием, магнием, оксидом кальция, оксидом углерода (IV), оксидом фосфора (V) и испытание полученных растворов индикатором.
Расчётные задачи. Нахождение массовой доли растворённого вещества в растворе. Вычисление массы растворённого вещества и воды для приготовления раствора определённой концентрации
Основные классы неорганических соединений (9 ч)
Оксиды. Состав. Классификация. Номенклатура. Свойства.
Получение. Применение.
Основания. Классификация. Номенклатура. Получение.
Физические и химические свойства оснований. Реакция нейтрализации. Кислотно-основные индикаторы: фенолфталеин,
метиловый оранжевый, лакмус. Окраска индикаторов в щелочной, кислой и нейтральной средах.
Кислоты. Состав. Классификация. Номенклатура. Физические и химические свойства. Кислотно-основные индикаторы: метиловый оранжевый, лакмус. Окраска индикаторов в кислой и нейтральной средах.
Соли. Состав. Классификация. Номенклатура. Способы получения солей.
Физические и химические свойства солей. Растворимость солей в воде.
Генетическая связь между основными классами неорганических соединений.
Практическая работа 5. Решение экспериментальных задач по теме «Основные классы неорганических соединений».
Контрольная работа по теме 6.
Демонстрации. Образцы оксидов, кислот, оснований и солей. Нейтрализация щёлочи кислотой в присутствии индикатора. Лабораторные опыты. Опыты, подтверждающие химические свойства оксидов, кислот, оснований, солей
Раздел 2. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома (10 ч)
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома (10 ч)
Первые попытки классификации химических элементов. Амфотерные соединения
Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов. Изменение физических свойств щелочных металлов с увеличением относительной атомной массы. Изменение химической активности щелочных металлов в реакциях с кислородом и водой.
Галогены — самые активные неметаллы. Изменение физических свойств галогенов с увеличением относительной атомной массы. Изменение химической активности галогенов в реакциях с водородом и металлами. Вытеснение галогенами друг друга из растворов их солей.
Периодический закон Д. И. Менделеева.
Структура таблицы «Периодическая система химических элементов Д. И. Менделеева» (короткая форма): А- и Б-группы, периоды.
Строение атома. Состав атомных ядер. Химический элемент — вид атомов с одинаковым зарядом ядра. Изотопы.
Электронная оболочка атома: понятие об электронном слое, его ёмкости. Заполнение электронных слоев у атомов элементов I—III периодов. Современная формулировка периодического закона.
Периодическое изменение свойств химических элементов в периодах и А-группах.
Значение периодического закона. Жизнь и деятельность Д. И. Менделеева.
Практическая работа 6. Изучение кислотно-основных
свойств гидроксидов, образованных химическими элементами III периода.
Демонстрации. Физические свойства щелочных металлов. Взаимодействие натрия и калия с водой. Физические свойства галогенов. Взаимодействие алюминия с хлором, бромом и иодом.
Лабораторные опыты. Вытеснение галогенами друг друга из растворов солей. Взаимодействие гидроксида цинка с растворами кислот и щелочей
Раздел 3. Строение вещества (11 ч)
Химическая связь (7 ч)
Электроотрицательность химических элементов.
Ковалентная связь. Полярная и неполярная ковалентные связи.
Ионная связь.
Валентность в свете электронной теории.
Степень окисления. Правила определения степеней окисления элементов.
Повторение и обобщение по темам 7 и 8.
Контрольная работа по темам 7 и 8.
Демонстрации. Модели кристаллических решёток ковалентных и ионных соединений. Сопоставление физико-химических свойств соединений с ковалентными и ионными связями
Количественные отношения в химии (3 ч)
Закон Авогадро. Молярный объём газов. Относительная плотность газов. Объёмные отношения газов при химических реакциях.
Расчётные задачи. Объёмные отношения газов при химических реакциях
9 класс
(2 ч в неделю, всего 70 ч, из них 6 ч — резервное время)
Раздел 1. Многообразие химических реакций (19 ч)
Классификация химических реакций (7 ч)
Классификация химических реакций: реакции соединения, разложения, замещения, обмена.
Окислительно-восстановительные реакции.
Тепловой эффект химических реакций. Экзо- и эндотермические реакции.
Обратимые и необратимые реакции.
Скорость химических реакций. Первоначальные представления о катализе.
Понятие о химическом равновесии.
Решение задач.
Демонстрации. Примеры экзо- и эндотермических реакций. Взаимодействие цинка с соляной и уксусной кислотами. Взаимодействие гранулированного цинка и цинковой пыли с соляной кислотой. Взаимодействие оксида меди (II) с серной кислотой разной концентрации при разных температурах. Горение угля в концентрированной азотной кислоте. Горение серы в расплавленной селитре.
Лабораторные опыты. Примеры экзо- и эндотермических реакций. Изучение влияния условий проведения химической реакции на её скорость.
Расчётные задачи. Вычисления по термохимическим уравнениям реакций
Химические реакции в водных растворах (12 ч)
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах.
Электролитическая диссоциация кислот, щелочей и солей. Уравнения электролитической диссоциации.
Слабые и сильные электролиты. Степень диссоциации.
Реакции ионного обмена и условия их протекания
. Реакции ионного обмена и условия их протекания
Гидролиз солей.
Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях.
Практическая работа 1. Свойства кислот, оснований и солей как электролитов.
Обобщение по теме «Электролитическая диссоциация».
Контрольная работа по темам 1 и 2.
Демонстрации. Испытание растворов веществ на электрическую проводимость. Движение ионов в электрическом поле.
Лабораторные опыты. Реакции обмена между растворами электролитов
Раздел 2. Многообразие веществ (45 ч)
Неметаллы (2 ч)
Общая характеристика неметаллов по их положению в периодической системе химических элементов Д. И. Менделеева. Закономерности изменения в периодах и группах физических и химических свойств простых веществ, высших оксидов и кислородсодержащих кислот, образованных неметаллами I—III периодов.
Водородные соединения неметаллов. Изменение кислотно-основных свойств водородных соединений неметаллов в периодах и группах
Галогены (5 ч)
Положение галогенов в периодической системе и строение их атомов. Физические и химические свойства галогенов. Сравнительная характеристика галогенов. Применение галогенов. Хлороводород. Получение. Физические свойства. Соляная кислота и её соли.
Практическая работа 2. Получение хлороводорода и изучение его свойств.
Демонстрации. Физические свойства галогенов. Получение хлороводорода и растворение его в воде.
Лабораторные опыты. Распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода
Кислород и сера (8 ч)
Положение кислорода и серы в периодической системе химических элементов, строение их атомов.
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы. Сероводород. Сульфиды.
Сернистый газ. Сернистая кислота и её соли.
Оксид серы (VI). Серная кислота и её соли.
Окислительные свойства концентрированной серной кислоты.
Практическая работа 3. Решение экспериментальных задач по теме «Кислород и сера».
Решение задач.
Демонстрации. Аллотропия кислорода и серы. Образцы природных сульфидов и сульфатов.
Лабораторные опыты. Распознавание сульфид-, сульфит- и сульфат-ионов в растворе.
Расчётные задачи. Вычисления по химическим уравнениям массы, объёма и количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
Азот и фосфор (9 ч)
Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, его свойства и применение.
Аммиак. Физические и химические свойства. Получение и применение.
Практическая работа 4. Получение аммиака и изучение его свойств.
Соли аммония.
Оксид азота(II) и оксид азота (IV) .
Азотная кислота и её соли.
Окислительные свойства азотной кислоты.
Фосфор. Аллотропия фосфора. Свойства фосфора.
Оксид фосфора (V). Ортофосфорная кислота и её соли.
Демонстрации. Получение аммиака и его растворение в воде. Образцы природных нитратов и фосфатов.
Лабораторные опыты. Взаимодействие солей аммония со щелочами
Углерод и кремний (8 ч)
Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Аллотропные модификации углерода.
Химические свойства углерода. Адсорбция.
Угарный газ, свойства и физиологическое действие.
Углекислый газ. Угольная кислота и её соли.
Практическая работа 5. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Живой мир — мир углерода.
Кремний и его соединения. Стекло. Цемент.
Обобщение по теме «Неметаллы».
Контрольная работа по темам 3—7.
Демонстрации. Кристаллические решётки алмаза и графита. Образцы природных карбонатов и силикатов.
Лабораторные опыты. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. Качественные реакции на карбонат - и силикат-ионы
Металлы (14 ч)
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая связь. Физические свойства металлов.
Нахождение металлов в природе и общие способы их получения.
Химические свойства металлов. Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов.
Щелочные металлы. Нахождение в природе. Физические и химические свойства.
Оксиды и гидроксиды щелочных металлов. Применение щелочных металлов.
Щелочноземельные металлы. Нахождение в природе. Кальций и его соединения.
Жёсткость воды и способы её устранения.
Алюминий. Нахождение в природе. Свойства алюминия.
Амфотерность оксида и гидроксида алюминия.
Железо. Нахождение в природе. Свойства железа. Оксиды, гидроксиды и соли железа(II) и железа (III)
Практическая работа 6. Решение экспериментальных задач по теме «Металлы и их соединения».
Применение металлов и их соединений. Подготовка к контрольной работе.
Контрольная работа по теме 8.
Демонстрации. Образцы важнейших соединений натрия и калия, природных соединений магния, кальция и алюминия, железных руд. Взаимодействие щелочных, щелочноземельных металлов и алюминия с водой. Сжигание железа в кислороде и хлоре.
Лабораторные опыты. Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами. Получение гидроксидов железа(II) и железа(III) и взаимодействие их с кислотами и щелочами. Взаимодействие раствора гидроксида натрия с растворами кислот и солей.
Расчётные задачи. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
.
Тематическое планирование с определением основных видов учебной деятельности
8 класс
(2 ч в неделю, всего70 ч, из них 4 ч — резервное время)
| № п.п. | Тема | Виды деятельности обучающихся |
| Раздел 1. Основные понятия химии (уровень атомно-молекулярных представлений) (44 ч) Предмет химии (7 ч) |
|
| 1. Предмет химии. Химия как часть естествознания. Вещества и
их свойства. 2. Методы познания в химии: наблюдение, эксперимент. 3. Практическая работа 1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени. 4. Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография. 5. Практическая работа 2. Очистка загрязнённой поваренной
соли. Физические и химические явления. Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций. Демонстрации. Лабораторное оборудование и приёмы безопасной работы с ним. Способы очистки веществ: кристаллизация, дистилляция, хроматография. Нагревание сахара. Нагревание парафина. Горение парафина. Взаимодействие растворов: карбоната натрия и соляной кислоты, сульфата меди(II) и гидроксида натрия. Взаимодействие свежеосаждённого гидроксида меди (II) с раствором глюкозы при обычных условиях и при нагревании. Лабораторные опыты. Рассмотрение веществ с различными физическими свойствами. Разделение смеси с помощью магнита. Примеры физических и химических явлений. Реакции, иллюстрирующие основные признаки характерных реакций
| Различать предметы изучения естественных наук. Наблюдать свойства веществ и их изменения в ходе химических реакций. Учиться проводить химический эксперимент. Соблюдать правила техники безопасности. Уметь оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Знакомиться с лабораторным оборудованием. Изучать строение пламени, выдвигая гипотезы и проверяя их экспериментально. Уметь разделять смеси методами отстаивания, фильтрования и выпаривания. Определять признаки химических реакций - |
| Первоначальные химические понятия (15 ч)
|
|
| Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения. Кристаллические решётки. Простые и сложные вещества. Химический элемент. Язык химии. Знаки химических элементов. Относительная атомная масса. Закон постоянства состава веществ. Относительная молекулярная масса. Химические формулы. Качественный и количественный состав вещества. Массовая доля химического элемента в соединении. Валентность химических элементов. Определение валентности элементов по формуле бинарных соединений. Составление химических формул бинарных соединений по валентности.
Закон сохранения массы веществ. Химические уравнения. Атомно-молекулярное учение. Жизнь и деятельность М. В. Ломоносова. Классификация химических реакций по числу и составу исходных и полученных веществ. Моль — единица количества вещества. Молярная масса. Решение расчётных задач по химическим уравнениям реакций. Контрольная работа по теме. Демонстрации. Примеры простых и сложных веществ в разных агрегатных состояниях. Шаростержневые модели молекул метана, аммиака, воды, хлороводорода, оксида углерода(1V). Модели кристаллических решёток. Опыты, подтверждающие закон сохранения массы веществ. Химические соединения количеством вещества 1 моль. Лабораторные опыты. Ознакомление с образцами простых (металлы и неметаллы) и сложных веществ, минералов и горных пород. Расчётные задачи. Вычисление относительной молекулярной массы вещества по его формуле. Вычисление массовой доли элемента в химическом соединении. Установление простейшей формулы вещества по массовым долям элементов. Вычисления по химическим уравнениям массы или количества вещества по известной массе или количеству одного из вступающих в реакцию или получающихся веществ
| Различать понятия «атом», «молекула», «химический элемент», «ион», «элементарные частицы». Различать понятия «вещества молекулярного строения» и «вещества немолекулярного строения». Определять понятие «кристаллическая решётка». Определять валентность атомов в бинарных соединениях. Определять состав простейших соединений по их химическим формулам. Изображать простейшие химические реакции с помощью химических уравнений. Составлять формулы бинарных соединений по известной валентности элементов. Моделировать строение молекул метана, аммиака, водорода, хлороводорода. Рассчитывать относительную молекулярную массу вещества по его формуле. Рассчитывать массовую долю химического элемента в соединении. Рассчитывать молярную массу вещества. Устанавливать простейшие формулы веществ по массовым долям элементов. Вычислять по химическим уравнениям массу или количество вещества по известной массе или количеству одного из вступающих в реакцию или получающихся веществ. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме
|
| Кислород (5 ч)
|
|
| Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства. Химические свойства кислорода. Горение и медленное окисление. Оксиды. Применение кислорода. Озон. Свойства и применение. Практическая работа 3. Получение кислорода и изучение его свойств. Воздух и его состав. Защита атмосферного воздуха от загрязнений. Демонстрации. Физические свойства кислорода. Получение и собирание кислорода методом вытеснения воздуха и воды. Условия возникновения и прекращения горения. Определение состава воздуха Лабораторные опыты. Ознакомление с образцами оксидов
| Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Распознавать опытным путём кислород. Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов. Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Составлять формулы оксидов по известной валентности элементов. Записывать простейшие уравнения химических реакций. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме
|
| Водород (3 ч)
|
|
| Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства. Меры безопасности при работе с водородом. Химические свойства водорода. Применение водорода. Практическая работа 4. Получение водорода и изучение его свойств. Демонстрации. Получение водорода в аппарате Киппа. Проверка водорода на чистоту. Горение водорода на воздухе и в кислороде. Собирание водорода методом вытеснения воздуха и воды. Лабораторные опыты. Взаимодействие водорода с оксидом меди(II)
| Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента. Распознавать опытным путём водород. Соблюдать правила техники безопасности. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов. Записывать простейшие уравнения химических реакций. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме
|
| Вода. Растворы (6 ч)
|
|
| Вода. Методы определения состава воды — анализ и синтез. Вода в природе и способы её очистки. Аэрация воды. Физические и химические свойства воды. Вода как растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде. Массовая доля растворённого вещества. Повторение и обобщение по темам 3—5. Приготовление растворов солей с определённой массовой долей растворённого вещества. Контрольная работа по темам 3—5. Демонстрации. Анализ воды. Синтез воды. Взаимодействие воды с натрием, кальцием, магнием, оксидом кальция, оксидомуглерода (1V), оксидом фосфора(V) и испытание полученных растворов индикатором. Расчётные задачи. Нахождение массовой доли растворённого вещества в растворе. Вычисление массы растворённого вещества и воды для приготовления раствора определённой концентрации
| Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов. Записывать простейшие уравнения химических реакций. Вычислять массовую долю растворённого вещества в растворе, массу растворённого вещества и воды для приготовления раствора определённой концентрации. Готовить растворы с определённой массовой долей растворённого вещества. Пользоваться информацией из других источников для подготовки кратких сообщений |
| Основные классы неорганических соединений (9 ч) |
|
| 1. Оксиды. Состав. Классификация. Номенклатура. Свойства.
Получение. Применение. 2. Основания. Классификация. Номенклатура. Получение. 3. Физические и химические свойства оснований. Реакция нейтрализации. Кислотно-основные индикаторы: фенолфталеин,
метиловый оранжевый, лакмус. Окраска индикаторов в щелочной, кислой и нейтральной средах. 4. Кислоты. Состав. Классификация. Номенклатура. Физические
и химические свойства. Кислотно-основные индикаторы: метиловый оранжевый, лакмус. Окраска индикаторов в кислой и
нейтральной средах. Соли. Состав. Классификация. Номенклатура. Способы получения солей. Физические и химические свойства солей. Растворимость солей в воде. Генетическая связь между основными классами неорганических соединений. Практическая работа 5. Решение экспериментальных задач по теме «Основные классы неорганических соединений». Контрольная работа по теме 6. Демонстрации. Образцы оксидов, кислот, оснований и солей. Нейтрализация щёлочи кислотой в присутствии индикатора. Лабораторные опыты. Опыты, подтверждающие химические свойства оксидов, кислот, оснований, солей
| Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента. Соблюдать правила техники безопасности. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов. Классифицировать изучаемые вещества по составу и свойствам. Составлять формулы оксидов, кислот, оснований, солей. Характеризовать состав и свойства веществ основных классов неорганических соединений. Записывать простейшие уравнения химических реакций
|
| Раздел 2. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома (10 ч) Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома (10 ч)
|
|
| 1.Первые попытки классификации химических элементов. Амфотерные соединения Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов. Изменение физических свойств щелочных металлов с увеличением относительной атомной массы. Изменение химической активности щелочных металлов в реакциях с кислородом и водой. Галогены — самые активные неметаллы. Изменение физических свойств галогенов с увеличением относительной атомной массы. Изменение химической активности галогенов в реакциях с водородом и металлами. Вытеснение галогенами друг друга из растворов их солей. Периодический закон Д. И. Менделеева. Структура таблицы «Периодическая система химических элементов Д. И. Менделеева» (короткая форма): А - и Б-группы, периоды. Строение атома. Состав атомных ядер. Химический элемент — вид атомов с одинаковым зарядом ядра. Изотопы. Электронная оболочка атома: понятие об электронном слое, его ёмкости. Заполнение электронных слоев у атомов элементов I—III периодов. Современная формулировка периодического закона. Периодическое изменение свойств химических элементов в периодах и А-группах. Значение периодического закона. Жизнь и деятельность Д. И. Менделеева. 10. Практическая работа 6. Изучение кислотно-основных
свойств гидроксидов, образованных химическими элементами III периода. Демонстрации. Физические свойства щелочных металлов. Взаимодействие натрия и калия с водой. Физические свойства галогенов. Взаимодействие алюминия с хлором, бромом и иодом. Лабораторные опыты. Вытеснение галогенами друг друга из растворов солей. Взаимодействие гидроксида цинка с растворами кислот и щелочей | Классифицировать изученные химические элементы и их соединения Сравнивать свойства веществ, принадлежащих к разным классам; химические элементы разных групп. Устанавливать внутри- и межпредметные связи. Формулировать периодический закон Д. И. Менделеева и раскрывать его смысл. Описывать и характеризовать структуру таблицы «Периодическая система химических элементов Д. И. Менделеева» (короткая форма). Различать периоды, группы, А - и Б-группы. Определять понятия «химический элемент», «порядковый номер», «массовое число», «изотоп», «относительная атомная масса», «электронная оболочка», «электронный слой». Объяснять физический смысл порядкового номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д. И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и А-групп. Определять число протонов, нейтронов, электронов у атомов химических элементов, используя периодическую таблицу. Моделировать строение атома, используя компьютер. Составлять схемы строения атомов первых 20 элементов периодической системы элементов. Характеризовать химические элементы на основе их положения в периодической системе и особенностей строения их атомов. Делать умозаключения о характере изменения свойств химических элементов с увеличением зарядов атомных ядер. Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе эксперимента Участвовать в совместном обсуждении результатов опытов. Делать выводы из результатов проведенных химических опытов |
| Раздел 3. Строение вещества (11 ч) Химическая связь (7 ч)
|
|
| Электроотрицательность химических элементов. Ковалентная связь. Полярная и неполярная ковалентные связи. Ионная связь. Валентность в свете электронной теории. Степень окисления. Правила определения степеней окисления элементов. Повторение и обобщение по темам 7 и 8. Контрольная работа по темам 7 и 8. Демонстрации. Модели кристаллических решёток ковалентных и ионных соединений. Сопоставление физико-химических свойств соединений с ковалентными и ионными связями
| Конкретизировать понятия «химическая связь», «кристаллическая решётка». Определять понятия «ковалентная неполярная связь», «ковалентная полярная связь», «ионная связь», «степень окисления». Моделировать строение веществ с кристаллическими решётками разного типа. Определять тип химической связи в соединениях на основании химической формулы. Определять степень окисления элементов в соединениях. Составлять формулы веществ по известным степеням окисления элементов. Устанавливать внутри - и межпредметные связи. Составлять сравнительные и обобщающие таблицы, схемы
|
| Количественные отношения в химии (3 ч) |
|
| 1. Закон Авогадро. Молярный объём газов. 2. Относительная плотность газов. 3. Объёмные отношения газов при химических реакциях.
Расчётные задачи. Объёмные отношения газов при химических реакциях | Использовать внутри - и межпредметные связи. Вычислять молярный объём газов, относительную плотность газов, объёмные отношения газов при химических реакциях. Использовать приведённые в учебниках и задачниках алгоритмы решения задач |
9 класс
(2 ч в неделю, всего 70 ч, из них 6 ч — резервное время)
| № п.п. | Тема | Виды деятельности обучающихся |
| Раздел 1. Многообразие химических реакций (19 ч) Классификация химических реакций (7 ч)
|
|
| Классификация химических реакций: реакции соединения, разложения, замещения, обмена. Окислительно-восстановительные реакции. Тепловой эффект химических реакций. Экзо - и эндотермические реакции. Обратимые и необратимые реакции. Скорость химических реакций. Первоначальные представления о катализе. Понятие о химическом равновесии. Решение задач. Демонстрации. Примеры экзо - и эндотермических реакций. Взаимодействие цинка с соляной и уксусной кислотами. Взаимодействие гранулированного цинка и цинковой пыли с соляной кислотой. Взаимодействие оксида меди (II) с серной кислотой разной концентрации при разных температурах. Горение угля в концентрированной азотной кислоте. Горение серы в расплавленной селитре. Лабораторные опыты. Примеры экзо - и эндотермических реакций. Изучение влияния условий проведения химической реакции на её скорость. Расчётные задачи. Вычисления по термохимическим уравнениям реакций
| Классифицировать химические реакции. Приводить примеры реакций каждого типа. Распознавать окислительно-восстановительные реакции по уравнениям реакций. Определять по уравнению реакции окислитель, восстановитель, процесс окисления, восстановления. Наблюдать и описывать химические реакции с помощью естественного языка и языка химии. Исследовать условия, влияющие на скорость химической реакции. Описывать условия, влияющие на скорость химической реакции. Проводить групповые наблюдения во время проведения лабораторных опытов. Участвовать в обсуждении результатов опытов. Составлять термохимические уравнения реакций. Вычислять тепловой эффект реакции по термохимическому уравнению
|
| Химические реакции в водных растворах (12 ч)
|
|
| 1—2. Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Электролитическая диссоциация кислот, щелочей и солей. Уравнения электролитической диссоциации. Слабые и сильные электролиты. Степень диссоциации. Реакции ионного обмена и условия их протекания . Реакции ионного обмена и условия их протекания Гидролиз солей. 8—9. Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях. Практическая работа 1. Свойства кислот, оснований и солей как электролитов. Обобщение по теме «Электролитическая диссоциация». Контрольная работа по темам 1 и 2. Демонстрации. Испытание растворов веществ на электрическую проводимость. Движение ионов в электрическом поле. Лабораторные опыты. Реакции обмена между растворами электролитов
| Обобщать знания о растворах. Проводить наблюдения за поведением веществ в растворах, за химическими реакциями, протекающими в растворах. Давать определения понятий «электролит», неэлектролит», «электролитическая диссоциация». Конкретизировать понятие «ион». Обобщать понятия «катион», «анион». Исследовать свойства растворов электролитов. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать правила техники безопасности. Характеризовать условия течения реакций в растворах электролитов до конца. Определять возможность протекания реакций ионного обмена. Проводить групповые наблюдения во время проведения лабораторных опытов. Соблюдать правила техники безопасности. Обсуждать в группах результаты опытов. Объяснять сущность реакций ионного обмена. Распознавать реакции ионного обмена по уравнениям реакций. Составлять ионные уравнения реакций. Составлять сокращённые ионные уравнения реакций |
| Раздел 2. Многообразие веществ (45 ч) Неметаллы (2 ч)
|
|
| Общая характеристика неметаллов по их положению в периодической системе химических элементов Д. И. Менделеева. Закономерности изменения в периодах и группах физических и химических свойств простых веществ, высших оксидов и кислородсодержащих кислот, образованных неметаллами I—III периодов. Водородные соединения неметаллов. Изменение кислотно-основных свойств водородных соединений неметаллов в периодах и группах
| Объяснять закономерности изменения свойств неметаллов в малых периодах и А-групп ах. Характеризовать химические элементы на основе их положения в периодической системе и особенностей строения их атомов. Делать умозаключения о характере изменения свойств химических элементов с увеличением зарядов атомных ядер. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме
|
| Галогены (5 ч) |
|
| Положение галогенов в периодической системе и строение их атомов. Физические и химические свойства галогенов. Сравнительная характеристика галогенов. Применение галогенов. Хлороводород. Получение. Физические свойства. Соляная кислота и её соли. Практическая работа 2. Получение хлороводорода и изучение его свойств. Демонстрации. Физические свойства галогенов. Получение хлороводорода и растворение его в воде. Лабораторные опыты. Распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода
| Характеризовать галогены на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств галогенов с увеличением атомного номера. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать технику безопасности. Распознавать опытным путём соляную кислоту и её соли, а также бромиды и иод иды. Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде. Вычислять массовую долю растворённого вещества в растворе
|
| Кислород и сера (8 ч)
|
|
| Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы. Сероводород. Сульфиды. Сернистый газ. Сернистая кислота и её соли. Оксид серы (VI). Серная кислота и её соли. Окислительные свойства концентрированной серной кислоты. Практическая работа 3. Решение экспериментальных задач по теме «Кислород и сера». Решение задач. Демонстрации. Аллотропия кислорода и серы. Образцы природных сульфидов и сульфатов. Лабораторные опыты. Распознавание сульфид-, сульфит- и сульфат-ионов в растворе. Расчётные задачи. Вычисления по химическим уравнениям массы, объёма и количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей | Характеризовать элементы VI А-группы (подгруппы кислорода) на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств элементов IVA-группы. Характеризовать аллотропию кислорода и серы как одну из причин многообразия веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать технику безопасности. Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Определять принадлежность веществ к определённому классу соединений. Сопоставлять свойства разбавленной и концентрированной серной кислоты. Записывать уравнения реакций в электронно-ионном виде. Распознавать опытным путём растворы кислот, сульфиды, сульфиты, сульфаты. Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде. Вычислять по химическим уравнениям массу, объём и количество вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей. Готовить компьютерные презентации по теме
|
| Азот и фосфор (9 ч)
|
|
| Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, его свойства и применение. Аммиак. Физические и химические свойства. Получение и применение. Практическая работа 4. Получение аммиака и изучение его свойств. Соли аммония. Оксид азота(II) и оксид азота(1V). Азотная кислота и её соли. Окислительные свойства азотной кислоты. Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора (V). Ортофосфорная кислота и её соли. Демонстрации. Получение аммиака и его растворение в воде. Образцы природных нитратов и фосфатов. Лабораторные опыты. Взаимодействие солей аммония со щелочами
| Характеризовать элементы VA-группы (подгруппы азота) на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств элементов VA-группы. Характеризовать аллотропию фосфора как одну из причин многообразия веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного экспериментов. Соблюдать технику безопасности. Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Устанавливать принадлежность веществ к определённому классу соединений. Сопоставлять свойства разбавленной и концентрированной азотной кислоты. Составлять уравнения ступенчатой диссоциации на примере молекулы фосфорной кислоты. Записывать уравнения реакций в электронно-ионном виде. Распознавать опытным путём аммиак, растворы кислот, нитрат - и фосфат-ионы, ион аммония. Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и мате риалами и экологически грамотного поведения в окружающей среде. Вычислять массовую долю растворённого вещества в растворе. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить компьютерные презентации по теме -
|
| Углерод и кремний (8 ч)
|
|
| Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Аллотропные модификации углерода. Химические свойства углерода. Адсорбция. Угарный газ, свойства и физиологическое действие. Углекислый газ. Угольная кислота и её соли. Практическая работа 5. Получение оксида углерода(1V) и изучение его свойств. Распознавание карбонатов. Живой мир — мир углерода. Кремний и его соединения. Стекло. Цемент. Обобщение по теме «Неметаллы». Контрольная работа по темам 3—7. Демонстрации. Кристаллические решётки алмаза и графита. Образцы природных карбонатов и силикатов. Лабораторные опыты. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. Качественные реакции на карбонат - и силикат-ионы
| Характеризовать элементы IVA-группы (подгруппы углерода) на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств элементов IVA-группы. Характеризовать аллотропию углерода как одну из причин многообразия веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать технику безопасности. Сопоставлять свойства оксидов углерода и кремния, объяснять причину их различия. Устанавливать по химической формуле принадлежность веществ к определённому классу соединений. Доказывать кислотный характер высших оксидов углерода и кремния. Записывать уравнения реакций в электронно-ионном виде. Осуществлять взаимопревращения карбонатов и гидрокарбонатов. Распознавать опытным путём углекислый газ, карбонат - и силикат-ионы. Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде
|
| Металлы (14) |
|
| Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая связь. Физические свойства металлов. Нахождение металлов в природе и общие способы их получения. Химические свойства металлов. Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов. Щелочные металлы. Нахождение в природе. Физические и химические свойства. Оксиды и гидроксиды щелочных металлов. Применение щелочных металлов. Щелочноземельные металлы. Нахождение в природе. Кальций и его соединения. Жёсткость воды и способы её устранения. Алюминий. Нахождение в природе. Свойства алюминия. Амфотерность оксида и гидроксида алюминия. Железо. Нахождение в природе. Свойства железа. Оксиды, гидроксиды и соли железа (II) и железа(III). Практическая работа 6. Решение экспериментальных задач по теме «Металлы и их соединения». Применение металлов и их соединений. Подготовка к контрольной работе. Контрольная работа по теме 8. Демонстрации. Образцы важнейших соединений натрия и калия, природных соединений магния, кальция и алюминия, железных руд. Взаимодействие щелочных, щелочноземельных металлов и алюминия с водой. Сжигание железа в кислороде и хлоре. Лабораторные опыты. Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами. Получение гидрок-сидов железа(II) и железа(III) и взаимодействие их с кислотами и щелочами. Взаимодействие раствора гидроксида натрия с растворами кислот и солей. Расчётные задачи. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
| Характеризовать металлы на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств металлов по периоду и в А-группах. Исследовать свойства изучаемых веществ. Объяснять зависимость физических свойств металлов от вида химической связи между их атомами. Наблюдать и описывать химические реакции с помощью естественного языка и языка химии. Наблюдать демонстрируемые и самостоятельно проводимые опыты. Описывать свойства изучаемых веществ на основе наблюдений за их превращениями. Доказывать амфотерный характер оксидов и гидроксидов алюминия и железа. Сравнивать отношение изучаемых металлов и оксидов металлов к воде. Сравнивать отношение гидроксидов натрия и алюминия к растворам кислот и щелочей. Распознавать опытным путём гидроксид-ионы, ионы Fe2+ и Fe3+. Соблюдать технику безопасности, правильно обращаться с химической посудой и лабораторным оборудованием. Записывать уравнения реакций в электронно-ионном виде. Обобщать знания и делать выводы о закономерностях изменений свойств металлов в периодах и группах. Прогнозировать свойства неизученных элементов и их соединений на основе знаний о периодическом законе. Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде Вычислять по химическим уравнениям массу, объём или количество вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить компьютерные презентации по теме
|
Описание учебно-методического и материально-технического обеспечения образовательного процесса
| Класс | № учебника в ФП учебников 2012-2013 уч.г. | Предметная область | Предмет | Авторы учебника | Издательство |
| 8 класс | 1.2.4.3.7.1 | «Естественно – научные предметы» | химия | Рудзитис Г.Е., Фельдман Ф.Г. | Просвещение. 2011 |
| 9 класс | 1.2.4.3.7.2 | «Естественно – научные предметы» | химия | Рудзитис Г.Е., Фельдман Ф.Г. | Просвещение 2011 |
Объекты и средства материально – технического обеспечения
| № п./п. | Наименование объектов и средств материально – технического обеспечения |
| 1 | Печатные пособия Комплект портретов ученых-химиков |
| 2 | Серия справочных таблиц по химии («Периодическая система химических элементов Д.И. Менделеева», «Растворимость солей, кислот и оснований в воде», «Электрохимический ряд напряжений металлов», «Окраска индикаторов в различных средах»). |
| 3 | Серия инструктивных таблиц по химии |
| 4 | Серия таблиц по неорганической химии |
|
1 | III. Информационно-коммуникативные средства Мультимедийные программы (обучающие, тренинговые, контролирующие) по всем разделам курса химии |
| 2 | Электронные библиотеки по курсу химии |
|
| Технические средства обучения |
| 1 | Компьютер |
| 2 | Мультимедийный проектор |
| 3 | Экран проекционный |
|
| Учебно-практическое и учебно-лабораторное оборудование Приборы, наборы посуды и лабораторных принадлежностей для химического эксперимента Общего назначения |
| 1 | Весы электронные |
| 2 | Нагревательные приборы: - электроплитки лабораторные с открытой спиралью - спиртовки - электронагреватели для пробирок НП-1 - нагреватель для колб учебный НКУ |
| 3 | Доска для сушки посуды |
| 4 | Комплект электроснабжения кабинета химии |
|
1 | Демонстрационные Набор посуды и принадлежностей для демонстрационных опытов по химии |
|
2 | Набор деталей для монтажа установок, иллюстрирующих химические производства |
| 3 | Столик подъемный |
| 4 | Штатив для демонстрационных пробирок ПХ-21 |
| 5 | Штатив металлический ШЛБ |
| 6 | Экран фоновый черно-белый (двусторонний) |
| 7 | Набор флаконов (250 – 300 мл для хранения растворов реактивов) |
|
1 | Специализированные приборы и аппараты Аппарат (прибор) для получения газов (Киппа) |
| 2 | Озонатор |
| 3 | Прибор для демонстрации светового эффекта реакций |
| 4 | Прибор для определения состава воздуха |
| 5 | Воронка делительная для работы с вредными веществами |
| 6 | Воронка делительная общего назначения |
|
1 | Комплекты для лабораторных опытов и практических занятий по химии Весы механические лабораторные |
| 2 | Весы электронные учебные лабораторные ВУЛ-50 ЭМ |
| 3 | Набор банок для хранения твердых реактивов (30 – 50 мл) |
| 4 | Набор склянок (флаконов) для хранения растворов реактивов |
| 5 | Набор пробирок (ПХ-14, ПХ-16) |
| 6 | Прибор для получения газов |
| 7 | Комплекты для монтажа химического оборудования МБ |
| 8 | Цилиндры мерные стеклянные |
| 9 | Кристаллизатор |
| 1
| Модели Набор кристаллических решеток: алмаза, графита, поваренной соли |
| 2 | Набор моделей – аппликаций для иллюстрации типов химических реакций |
| 3 | Набор для моделирования электронного строения атомов элементов |
|
| VIII.Натуральные объекты, коллекции |
| 1 | Топливо |
|
| Реактивы (по норме) |
|
| Набор № 1 ОС «Кислоты» Кислота серная 4,800 кг Кислота соляная 2,500 кг |
|
| Набор № 2 ОС «Кислоты» Кислота азотная 0,300 кг Кислота ортофосфорная 0,050 кг |
|
| Набор № 3 ОС «Гидроксиды» Калия гидроксид 0,200 кг Кальция гидроксид 0,500 кг Натрия гидроксид 0,500 кг |
|
| Набор № 4 ОС «Оксиды металлов» Алюминия оксид 0,100 кг Бария оксид 0,100 кг Железа (III) оксид 0,050 кг Кальция оксид 0,100 кг Магния оксид 0,100 кг Меди (II) оксид (гранулы) 0,200 кг Калия оксид 0,100 кг Цинка оксид 0,100 кг |
|
| Набор № 5 ОС «Металлы» Алюминий (гранулы) 0,100 кг Алюминий (стружка) 0,050 кг Железо восстановленное (порошок) 0,050 кг Магний (опилки) 0,050 кг Медь (гранулы, опилки) 0,050 кг Цинк (гранулы) 0,500 кг |
|
| Набор № 6 ОС «Щелочные и щелочноземельные металлы» Литий 5 ампул Натрий 20 ампул |
|
| Набор № 7 ОС «Огнеопасные вещества» Сера (порошок) 0,050 кг |
|
| Набор № 9 ОС «Галогениды» Бария хлорид 0,100 кг Железа (III) хлорид 0,100 кг Калия хлорид 0,050 кг Кальция хлорид 0,100 кг Магния хлорид 0,100 кг Меди (II) хлорид 0,100 кг Натрия хлорид 0,100 кг Цинка хлорид 0,050 кг Калия иодид 0,050 кг Калия бромид 0,050 кг |
|
| Набор № 10 ОС «Сульфаты. Сульфиты. Сульфиды» Алюминия сульфат 0,100 кг Железа (II) сульфат 0,100 кг Калия сульфат 0,050 кг Кальция сульфат 0,200 кг Магния сульфат 0,050 кг Меди (II) сульфат безводный 0,050 кг Меди (II) сульфат 5-ти водный 0,100 кг Натрия сульфид 0,050 кг Натрия сульфат 0,050 кг Цинка сульфат 0,200 кг |
|
| Набор № 11 ОС «Карбонаты» Калия карбонат (поташ) 0,050 кг Меди (II) карбонат основной 0,100 кг Натрия карбонат 0,100 кг Натрия гидрокарбонат 0,100 кг Кальция карбонат 0,200 кг Магния карбонат 0,200 кг |
|
| Набор № 12 ОС «Фосфаты. Силикаты» Натрия силикат 9-ти водный 0,050 кг Натрия ортофосфат трехзамещенный 0,100 кг |
|
| Набор № 14 ОС «Соединения марганца» Калия перманганат (калий марганцевокислый) 0,500 кг |
|
| Набор № 16 ОС «Нитраты» Алюминия нитрат 0,050 кг Калия нитрат 0,050 кг Кальция нитрат 0,050 кг Меди (II) нитрат 0,050 кг Натрия нитрат 0,050 кг Серебра нитрат 0, 020 кг |
|
| Набор № 17 ОС «Индикаторы» Лакмоид 0,020 кг Метиловый оранжевый 0,020 кг Фенолфталеин 0,020 кг |
Состав учебно-методического комплекта:
Рудзитис Г.Е. Химия: 8 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Химия: 8 кл.: электронное приложение к учебнику.
Рудзитис Г.Е. Химия: 9 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Химия: 9 кл.: электронное приложение к учебнику.
Гара Н.Н. Химия: задачник с «помощником»: 8-9 классы / Н.Н. Гара. – М.: Просвещение.
Гара Н.Н. Химия. Рабочие программы. Предметная линия учебников Г.Е. Рудзитиса, Ф.Г. Фельдмана. 8-9 классы/ Н.Н. Гара. – М.: Просвещение.
Радецкий А.М. Химия: дидактический материал: 8-9 кл. / А.М. Радецкий. – М.: Просвещение.
Гара Н.Н. Химия. Уроки: 8 кл. / Н.Н. Гара. – М.: Просвещение.
Гара Н.Н. Химия. Уроки: 9 кл. / Н.Н. Гара. – М.: Просвещение.
Список литературы для учащихся:
Учебники:
Рудзитис Г.Е. Химия: 8 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Рудзитис Г.Е. Химия: 9 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Гара Н.Н. Химия: задачник с «помощником»: 8-9 классы / Н.Н. Гара. – М.: Просвещение.
Рабочие тетради:
Габрусева Н.И. Химия: рабочая тетрадь: 8 кл. / Н.И. Габрусева. – М.: Просвещение.
Габрусева Н.И. Химия: рабочая тетрадь: 9 кл. / Н.И. Габрусева. – М.: Просвещение.
Список литературы для педагогов:
Рудзитис Г.Е. Химия: 8 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Химия: 8 кл.: электронное приложение к учебнику.
Рудзитис Г.Е. Химия: 9 кл.: учеб. для общеобразоват. Учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение.
Химия: 9 кл.: электронное приложение к учебнику.
Гара Н.Н. Химия: задачник с «помощником»: 8-9 классы / Н.Н. Гара. – М.: Просвещение.
Гара Н.Н. Химия. Рабочие программы. Предметная линия учебников Г.Е. Рудзитиса, Ф.Г. Фельдмана. 8-9 классы/ Н.Н. Гара. – М.: Просвещение.
Радецкий А.М. Химия: дидактический материал: 8-9 кл. / А.М. Радецкий. – М.: Просвещение.
Гара Н.Н. Химия. Уроки: 8 кл. / Н.Н. Гара. – М.: Просвещение.
Гара Н.Н. Химия. Уроки: 9 кл. / Н.Н. Гара. – М.: Просвещение.
Боровских Т.А. Тесты по химии. Первоначальные химические понятия. Кислород. Водород. Вода, растворы. Основные классы неорганичесих соединений: 8 кл.: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс». – М.: Издательство «Экзамен», 2010.
Боровских Т.А. Тесты по химии. Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. 9 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 9 класс». – М.: Издательство «Экзамен», 2011.
Перечень цифровых информационных ресурсов Интернета:
http://ege.yandex.ru/chemistry/
http://chem.reshuege.ru/
http://himege.ru/
http://pouchu.ru/
http://enprophil.ucoz.ru/index/egeh_alkeny_alkadieny/0-358
http://ximozal.ucoz.ru/_ld/12/1241___4_.pdf
http://mirhim.ucoz.ru/index/khimija_8_3/0-41
Состав медиатеки:
Открытая химия. Версия 2.6. (Полный интерактивный курс химии для учащихся школ, лицеев, гимназий, колледжей, студентов технических вузов). ООО «Физикон» 2005.
CD-ROM Виртуальная школа Кирилла и Мефодия. Уроки химии. 8-9 классы. -М.: ООО «Кирилл и Мефодий», 2002г.
CD-ROM Учебное электронное издание Химия (8-11 класс) Виртуальная лаборатория. МарГТУ, Лаборатория систем мультимедия, 2004г.
CD-ROM Электронная библиотека «Просвещение». Мультимедийное пособие нового образца. 8 класс. М.: Просвещение, 2005г
Планируемые результаты изучения учебного предмета «Химия»
В сфере развития личностных универсальных учебных действий приоритетное внимание уделяется формированию:
• основ гражданской идентичности личности (включая когнитивный, эмоционально-ценностный и поведенческий компоненты);
• основ социальных компетенций (включая ценностно-смысловые установки и моральные нормы, опыт социальных и межличностных отношений, правосознание);
• готовности и способности к переходу к самообразованию на основе учебно-познавательной мотивации, в том числе готовности к выбору направления профильного образования.
В частности, формированию готовности и способности к выбору направления профильного образования способствуют:
• целенаправленное формирование интереса к изучаемым областям знания и видам деятельности, педагогическая поддержка любознательности и избирательности интересов;
• реализация уровневого подхода как в преподавании (на основе дифференциации требований к освоению учебных программ и достижению планируемых результатов), так и в оценочных процедурах (на основе дифференциации содержания проверочных заданий и/или критериев оценки достижения планируемых результатов на базовом и повышенных уровнях);
• формирование навыков взаимо- и самооценки, навыков рефлексии на основе использования критериальной системы оценки;
• организация системы проб подростками своих возможностей (в том числе предпрофессиональных проб) за счёт использования дополнительных возможностей образовательного процесса, в том числе: факультативов, вводимых образовательным учреждением1; программы формирования ИКТ-компетентности школьников; программы учебно-исследовательской и проектной деятельности; программы внеурочной деятельности; программы профессиональной ориентации; программы экологического образования; программы дополнительного образования, иных возможностей образовательного учреждения;
• целенаправленное формирование в курсе технологии представлений о рынке труда и требованиях, предъявляемых различными массовыми востребованными профессиями к подготовке и личным качествам будущего труженика;
• приобретение практического опыта пробного проектирования жизненной и профессиональной карьеры на основе соотнесения своих интересов, склонностей, личностных качеств, уровня подготовки с требованиями профессиональной деятельности.
В сфере развития регулятивных универсальных учебных действий приоритетное внимание уделяется формированию действий целеполагания, включая способность ставить новые учебные цели и задачи, планировать их реализацию, в том числе во внутреннем плане, осуществлять выбор
эффективных путей и средств достижения целей, контролировать и оценивать свои действия, как по результату, так и по способу действия, вносить соответствующие коррективы в их выполнение.
Ведущим способом решения этой задачи является формирование способности к проектированию.
В сфере развития коммуникативных универсальных учебных действий приоритетное внимание уделяется:
• формированию действий по организации и планированию учебного сотрудничества с учителем и сверстниками, умений работать в группе и приобретению опыта такой работы, практическому освоению морально-этических и психологических принципов общения и сотрудничества;
• практическому освоению умений, составляющих основу коммуникативной компетентности: ставить и решать многообразные коммуникативные задачи; действовать с учётом позиции другого и уметь согласовывать свои действия; устанавливать и поддерживать необходимые контакты с другими людьми; удовлетворительно владеть нормами и техникой общения; определять цели коммуникации, оценивать ситуацию, учитывать намерения и способы коммуникации партнёра, выбирать адекватные стратегии коммуникации;
• развитию речевой деятельности, приобретению опыта использования речевых средств для регуляции умственной деятельности, приобретению опыта регуляции собственного речевого поведения как основы коммуникативной компетентности.
В сфере развития познавательных универсальных учебных действий приоритетное внимание уделяется:
• практическому освоению обучающимися основ проектно-исследовательской деятельности;
• развитию стратегий смыслового чтения и работе с информацией;
• практическому освоению методов познания, используемых в различных областях знания и сферах культуры, соответствующего им инструментария и понятийного аппарата, регулярному обращению в учебном процессе к использованию общеучебных умений, знаково-символических средств, широкого спектра логических действий и операций.
При изучении учебных предметов обучающиеся усовершенствуют приобретённые на первой ступени навыки работы с информацией и пополнят их. Они смогут работать с текстами, преобразовывать и интерпретировать содержащуюся в них информацию, в том числе:
• систематизировать, сопоставлять, анализировать, обобщать и интерпретировать информацию, содержащуюся в готовых информационных объектах;
• выделять главную и избыточную информацию, выполнять смысловое свёртывание выделенных фактов, мыслей; представлять информацию в сжатой словесной форме (в виде плана или тезисов) и в наглядно-символической форме (в виде таблиц, графических схем и диаграмм, карт понятий — концептуальных диаграмм, опорных конспектов);
• заполнять и дополнять таблицы, схемы, диаграммы, тексты.
Обучающиеся усовершенствуют навык поиска информации в компьютерных и некомпьютерных источниках информации, приобретут навык формулирования запросов и опыт использования поисковых машин. Они научатся осуществлять поиск информации в Интернете, школьном информационном пространстве, базах данных и на персональном компьютере с использованием поисковых сервисов, строить поисковые запросы в зависимости от цели запроса и анализировать результаты поиска.
Обучающиеся приобретут потребность поиска дополнительной информации для решения учебных задач и самостоятельной познавательной деятельности; освоят эффективные приёмы поиска, организации и хранения информации на персональном компьютере, в информационной среде учреждения и в Интернете; приобретут первичные навыки формирования и организации собственного информационного пространства.
Они усовершенствуют умение передавать информацию в устной форме, сопровождаемой аудиовизуальной поддержкой, и в письменной форме гипермедиа (т. е. сочетания текста, изображения, звука, ссылок между разными информационными компонентами).
Обучающиеся смогут использовать информацию для установления причинно-следственных связей и зависимостей, объяснений и доказательств фактов в различных учебных и практических ситуациях, ситуациях моделирования и проектирования.
Выпускники получат возможность научиться строить умозаключения и принимать решения на основе самостоятельно полученной информации, а также освоить опыт критического отношения к получаемой информации на основе её сопоставления с информацией из других источников и с имеющимся жизненным опытом.
Планируемые результаты освоения учебных и междисциплинарных программ
Формирование универсальных учебных действий
Личностные универсальные учебные действия
В рамках когнитивного компонента будут сформированы:
• историко-географический образ, включая представление о территории и границах России, её географических особенностях; знание основных исторических событий развития государственности и общества; знание истории и географии края, его достижений и культурных традиций;
• образ социально-политического устройства — представление о государственной организации России, знание государственной символики (герб, флаг, гимн), знание государственных праздников;
• знание положений Конституции РФ, основных прав и обязанностей гражданина, ориентация в правовом пространстве государственно-общественных отношений;
• знание о своей этнической принадлежности, освоение национальных ценностей, традиций, культуры, знание о народах и этнических группах России;
• освоение общекультурного наследия России и общемирового культурного наследия;
• ориентация в системе моральных норм и ценностей и их иерархизация, понимание конвенционального характера морали;
• основы социально-критического мышления, ориентация в особенностях социальных отношений и взаимодействий, установление взаимосвязи между общественными и политическими событиями;
• экологическое сознание, признание высокой ценности жизни во всех её проявлениях; знание основных принципов и правил отношения к природе; знание основ здорового образа жизни и здоровьесберегающих технологий; правил поведения в чрезвычайных ситуациях.
В рамках ценностного и эмоционального компонентов будут сформированы:
• гражданский патриотизм, любовь к Родине, чувство гордости за свою страну;
• уважение к истории, культурным и историческим памятникам;
• эмоционально положительное принятие своей этнической идентичности;
• уважение к другим народам России и мира и принятие их, межэтническая толерантность, готовность к равноправному сотрудничеству;
• уважение к личности и её достоинству, доброжелательное отношение к окружающим, нетерпимость к любым видам насилия и готовность противостоять им;
• уважение к ценностям семьи, любовь к природе, признание ценности здоровья, своего и других людей, оптимизм в восприятии мира;
• потребность в самовыражении и самореализации, социальном признании;
• позитивная моральная самооценка и моральные чувства — чувство гордости при следовании моральным нормам, переживание стыда и вины при их нарушении.
В рамках деятельностного (поведенческого) компонента будут сформированы:
• готовность и способность к участию в школьном самоуправлении в пределах возрастных компетенций (дежурство в школе и классе, участие в детских и молодёжных общественных организациях, школьных и внешкольных мероприятиях);
• готовность и способность к выполнению норм и требований школьной жизни, прав и обязанностей ученика;
• умение вести диалог на основе равноправных отношений и взаимного уважения и принятия; умение конструктивно разрешать конфликты;
• готовность и способность к выполнению моральных норм в отношении взрослых и сверстников в школе, дома, во внеучебных видах деятельности;
• потребность в участии в общественной жизни ближайшего социального окружения, общественно полезной деятельности;
• умение строить жизненные планы с учётом конкретных социально-исторических, политических и экономических условий;
• устойчивый познавательный интерес и становление смыслообразующей функции познавательного мотива;
• готовность к выбору профильного образования.
Выпускник получит возможность для формирования:
• выраженной устойчивой учебно-познавательной мотивации и интереса к учению;
• готовности к самообразованию и самовоспитанию;
• адекватной позитивной самооценки и Я-концепции;
• компетентности в реализации основ гражданской идентичности в поступках и деятельности;
• морального сознания на конвенциональном уровне, способности к решению моральных дилемм на основе учёта позиций участников дилеммы, ориентации на их мотивы и чувства; устойчивое следование в поведении моральным нормам и этическим требованиям;
• эмпатии как осознанного понимания и сопереживания чувствам других, выражающейся в поступках, направленных на помощь и обеспечение благополучия.
Регулятивные универсальные учебные действия
Выпускник научится:
• целеполаганию, включая постановку новых целей, преобразование практической задачи в познавательную;
• самостоятельно анализировать условия достижения цели на основе учёта выделенных учителем ориентиров действия в новом учебном материале;
• планировать пути достижения целей;
• устанавливать целевые приоритеты;
• уметь самостоятельно контролировать своё время и управлять им;
• принимать решения в проблемной ситуации на основе переговоров;
• осуществлять констатирующий и предвосхищающий контроль по результату и по способу действия; актуальный контроль на уровне произвольного внимания;
• адекватно самостоятельно оценивать правильность выполнения действия и вносить необходимые коррективы в исполнение, как в конце действия, так и по ходу его реализации;
• основам прогнозирования как предвидения будущих событий и развития процесса.
Выпускник получит возможность научиться:
• самостоятельно ставить новые учебные цели и задачи;
• построению жизненных планов во временно2й перспективе;
• при планировании достижения целей самостоятельно, полно и адекватно учитывать условия и средства их достижения;
• выделять альтернативные способы достижения цели и выбирать наиболее эффективный способ;
• основам саморегуляции в учебной и познавательной деятельности в форме осознанного управления своим поведением и деятельностью, направленной на достижение поставленных целей;
• осуществлять познавательную рефлексию в отношении действий по решению учебных и познавательных задач;
• адекватно оценивать объективную трудность как меру фактического или предполагаемого расхода ресурсов на решение задачи;
• адекватно оценивать свои возможности достижения цели определённой сложности в различных сферах самостоятельной деятельности;
• основам саморегуляции эмоциональных состояний;
• прилагать волевые усилия и преодолевать трудности и препятствия на пути достижения целей.
Коммуникативные универсальные учебные действия
Выпускник научится:
• учитывать разные мнения и стремиться к координации различных позиций в сотрудничестве;
• формулировать собственное мнение и позицию, аргументировать и координировать её с позициями партнёров в сотрудничестве при выработке общего решения в совместной деятельности;
• устанавливать и сравнивать разные точки зрения, прежде чем принимать решения и делать выбор;
• аргументировать свою точку зрения, спорить и отстаивать свою позицию не враждебным для оппонентов образом;
• задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнёром;
• осуществлять взаимный контроль и оказывать в сотрудничестве необходимую взаимопомощь;
• адекватно использовать речь для планирования и регуляции своей деятельности;
• адекватно использовать речевые средства для решения различных коммуникативных задач; владеть устной и письменной речью; строить монологическое контекстное высказывание;
• организовывать и планировать учебное сотрудничество с учителем и сверстниками, определять цели и функции участников, способы взаимодействия; планировать общие способы работы;
• осуществлять контроль, коррекцию, оценку действий партнёра, уметь убеждать;
• работать в группе — устанавливать рабочие отношения, эффективно сотрудничать и способствовать продуктивной кооперации; интегрироваться в группу сверстников и строить продуктивное взаимодействие со сверстниками и взрослыми;
• основам коммуникативной рефлексии;
• использовать адекватные языковые средства для отображения своих чувств, мыслей, мотивов и потребностей;
• отображать в речи (описание, объяснение) содержание совершаемых действий, как в форме громкой социализированной речи, так и в форме внутренней речи.
Выпускник получит возможность научиться:
• учитывать и координировать отличные от собственной позиции других людей в сотрудничестве;
• учитывать разные мнения и интересы и обосновывать собственную позицию;
• понимать относительность мнений и подходов к решению проблемы;
• продуктивно разрешать конфликты на основе учёта интересов и позиций всех участников, поиска и оценки альтернативных способов разрешения конфликтов; договариваться и приходить к общему решению в совместной деятельности, в том числе в ситуации столкновения интересов;
• брать на себя инициативу в организации совместного действия (деловое лидерство);
• оказывать поддержку и содействие тем, от кого зависит достижение цели в совместной деятельности;
• осуществлять коммуникативную рефлексию как осознание оснований собственных действий и действий партнёра;
• в процессе коммуникации достаточно точно, последовательно и полно передавать партнёру необходимую информацию как ориентир для построения действия;
• вступать в диалог, а также участвовать в коллективном обсуждении проблем, участвовать в дискуссии и аргументировать свою позицию, владеть монологической и диалогической формами речи в соответствии с грамматическими и синтаксическими нормами родного языка;
• следовать морально-этическим и психологическим принципам общения и сотрудничества на основе уважительного отношения к партнёрам, внимания к личности другого, адекватного межличностного восприятия, готовности адекватно реагировать на нужды других, в частности оказывать помощь и эмоциональную поддержку партнёрам в процессе достижения общей цели совместной деятельности;
• устраивать эффективные групповые обсуждения и обеспечивать обмен знаниями между членами группы для принятия эффективных совместных решений;
• в совместной деятельности чётко формулировать цели группы и позволять её участникам проявлять собственную энергию для достижения этих целей.
Познавательные универсальные учебные действия
Выпускник научится:
• основам реализации проектно-исследовательской деятельности;
• проводить наблюдение и эксперимент под руководством учителя;
• осуществлять расширенный поиск информации с использованием ресурсов библиотек и Интернета;
• создавать и преобразовывать модели и схемы для решения задач;
• осуществлять выбор наиболее эффективных способов решения задач в зависимости от конкретных условий;
• давать определение понятиям;
• устанавливать причинно-следственные связи;
• осуществлять логическую операцию установления родовидовых отношений, ограничение понятия;
• обобщать понятия — осуществлять логическую операцию перехода от видовых признаков к родовому понятию, от понятия с меньшим объёмом к понятию с большим объёмом;
• осуществлять сравнение, сериацию и классификацию, самостоятельно выбирая основания и критерии для указанных логических операций;
• строить классификацию на основе дихотомического деления (на основе отрицания);
• строить логическое рассуждение, включающее установление причинно-следственных связей;
• объяснять явления, процессы, связи и отношения, выявляемые в ходе исследования;
• основам ознакомительного, изучающего, усваивающего и поискового чтения;
• структурировать тексты, включая умение выделять главное и второстепенное, главную идею текста, выстраивать последовательность описываемых событий;
• работать с метафорами — понимать переносный смысл выражений, понимать и употреблять обороты речи, построенные на скрытом уподоблении, образном сближении слов.
Выпускник получит возможность научиться:
• основам рефлексивного чтения;
• ставить проблему, аргументировать её актуальность;
• самостоятельно проводить исследование на основе применения методов наблюдения и эксперимента;
• выдвигать гипотезы о связях и закономерностях событий, процессов, объектов;
• организовывать исследование с целью проверки гипотез;
• делать умозаключения (индуктивное и по аналогии) и выводы на основе аргументации.
Фиксация изображений и звуков
Выпускник научится:
• осуществлять фиксацию изображений и звуков в ходе процесса обсуждения, проведения эксперимента, природного процесса, фиксацию хода и результатов проектной деятельности;
• учитывать смысл и содержание деятельности при организации фиксации, выделять для фиксации отдельные элементы объектов и процессов, обеспечивать качество фиксации существенных элементов;
• выбирать технические средства ИКТ для фиксации изображений и звуков в соответствии с поставленной целью;
• проводить обработку цифровых фотографий с использованием возможностей специальных компьютерных инструментов, создавать презентации на основе цифровых фотографий;
• проводить обработку цифровых звукозаписей с использованием возможностей специальных компьютерных инструментов, проводить транскрибирование цифровых звукозаписей;
• осуществлять видеосъёмку и проводить монтаж отснятого материала с использованием возможностей специальных компьютерных инструментов.
Выпускник получит возможность научиться:
• различать творческую и техническую фиксацию звуков и изображений;
• использовать возможности ИКТ в творческой деятельности, связанной с искусством;
• осуществлять трёхмерное сканирование.
Создание, восприятие и использование гипермедиасообщений
Выпускник научится:
• организовывать сообщения в виде линейного или включающего ссылки представления для самостоятельного просмотра через браузер;
• работать с особыми видами сообщений: диаграммами (алгоритмические, концептуальные, классификационные, организационные, родства и др.), картами (географические, хронологические) и спутниковыми фотографиями, в том числе в системах глобального позиционирования;
• проводить деконструкцию сообщений, выделение в них структуры, элементов и фрагментов;
• использовать при восприятии сообщений внутренние и внешние ссылки;
• формулировать вопросы к сообщению, создавать краткое описание сообщения; цитировать фрагменты сообщения;
• избирательно относиться к информации в окружающем информационном пространстве, отказываться от потребления ненужной информации.
Выпускник получит возможность научиться:
• проектировать дизайн сообщений в соответствии с задачами и средствами доставки;
• понимать сообщения, используя при их восприятии внутренние и внешние ссылки, различные инструменты поиска, справочные источники (включая двуязычные).
Коммуникация и социальное взаимодействие
Выпускник научится:
• выступать с аудиовидеоподдержкой, включая выступление перед дистанционной аудиторией;
• участвовать в обсуждении (аудиовидеофорум, текстовый форум) с использованием возможностей Интернета;
• использовать возможности электронной почты для информационного обмена;
• вести личный дневник (блог) с использованием возможностей Интернета;
• осуществлять образовательное взаимодействие в информационном пространстве образовательного учреждения (получение и выполнение заданий, получение комментариев, совершенствование своей работы, формирование портфолио);
• соблюдать нормы информационной культуры, этики и права; с уважением относиться к частной информации и информационным правам других людей.
Выпускник получит возможность научиться:
• взаимодействовать в социальных сетях, работать в группе над сообщением (вики);
• участвовать в форумах в социальных образовательных сетях;
• взаимодействовать с партнёрами с использованием возможностей Интернета (игровое и театральное взаимодействие).
Поиск и организация хранения информации
Выпускник научится:
• использовать различные приёмы поиска информации в Интернете, поисковые сервисы, строить запросы для поиска информации и анализировать результаты поиска;
• использовать приёмы поиска информации на персональном компьютере, в информационной среде учреждения и в образовательном пространстве;
• использовать различные библиотечные, в том числе электронные, каталоги для поиска необходимых книг;
• искать информацию в различных базах данных, создавать и заполнять базы данных, в частности использовать различные определители;
• формировать собственное информационное пространство: создавать системы папок и размещать в них нужные информационные источники, размещать информацию в Интернете.
Выпускник получит возможность научиться:
• создавать и заполнять различные определители;
• использовать различные приёмы поиска информации в Интернете в ходе учебной деятельности.
Анализ информации, математическая обработка данных в исследовании
Выпускник научится:
• вводить результаты измерений и другие цифровые данные для их обработки, в том числе статистической и визуализации;
• строить математические модели;
• проводить эксперименты и исследования в виртуальных лабораториях по естественным наукам, математике и информатике.
Выпускник получит возможность научиться:
• проводить естественно-научные и социальные измерения, вводить результаты измерений и других цифровых данных и обрабатывать их, в том числе статистически и с помощью визуализации;
• анализировать результаты своей деятельности и затрачиваемых ресурсов.
Основы учебно-исследовательской и проектной деятельности
Выпускник научится:
• планировать и выполнять учебное исследование и учебный проект, используя оборудование, модели, методы и приёмы, адекватные исследуемой проблеме;
• выбирать и использовать методы, релевантные рассматриваемой проблеме;
• распознавать и ставить вопросы, ответы на которые могут быть получены путём научного исследования, отбирать адекватные методы исследования, формулировать вытекающие из исследования выводы;
• использовать такие математические методы и приёмы, как абстракция и идеализация, доказательство, доказательство от противного, доказательство по аналогии, опровержение, контрпример, индуктивные и дедуктивные рассуждения, построение и исполнение алгоритма;
• использовать такие естественно-научные методы и приёмы, как наблюдение, постановка проблемы, выдвижение «хорошей гипотезы», эксперимент, моделирование, использование математических моделей, теоретическое обоснование, установление границ применимости модели/теории;
• использовать некоторые методы получения знаний, характерные для социальных и исторических наук: постановка проблемы, опросы, описание, сравнительное историческое описание, объяснение, использование статистических данных, интерпретация фактов;
• ясно, логично и точно излагать свою точку зрения, использовать языковые средства, адекватные обсуждаемой проблеме;
• отличать факты от суждений, мнений и оценок, критически относиться к суждениям, мнениям, оценкам, реконструировать их основания;
• видеть и комментировать связь научного знания и ценностных установок, моральных суждений при получении, распространении и применении научного знания.
Выпускник получит возможность научиться:
• самостоятельно задумывать, планировать и выполнять учебное исследование, учебный и социальный проект;
• использовать догадку, озарение, интуицию;
• использовать такие математические методы и приёмы, как перебор логических возможностей, математическое моделирование;
• использовать такие естественно-научные методы и приёмы, как абстрагирование от привходящих факторов, проверка на совместимость с другими известными фактами;
• использовать некоторые методы получения знаний, характерные для социальных и исторических наук: анкетирование, моделирование, поиск исторических образцов;
• использовать некоторые приёмы художественного познания мира: целостное отображение мира, образность, художественный вымысел, органическое единство общего особенного (типичного) и единичного, оригинальность;
• целенаправленно и осознанно развивать свои коммуникативные способности, осваивать новые языковые средства;
• осознавать свою ответственность за достоверность полученных знаний, за качество выполненного проекта.
Стратегии смыслового чтения и работа с текстом
Работа с текстом: поиск информации и понимание прочитанного
Выпускник научится:
• ориентироваться в содержании текста и понимать его целостный смысл:
— определять главную тему, общую цель или назначение текста;
— выбирать из текста или придумать заголовок, соответствующий содержанию и общему смыслу текста;
— формулировать тезис, выражающий общий смысл текста;
— предвосхищать содержание предметного плана текста по заголовку и с опорой на предыдущий опыт;
— объяснять порядок частей/инструкций, содержащихся в тексте;
— сопоставлять основные текстовые и внетекстовые компоненты: обнаруживать соответствие между частью текста и его общей идеей, сформулированной вопросом, объяснять назначение карты, рисунка, пояснять части графика или таблицы и т. д.;
• находить в тексте требуемую информацию (пробегать текст глазами, определять его основные элементы, сопоставлять формы выражения информации в запросе и в самом тексте, устанавливать, являются ли они тождественными или синонимическими, находить необходимую единицу информации в тексте);
• решать учебно-познавательные и учебно-практические задачи, требующие полного и критического понимания текста:
— определять назначение разных видов текстов;
— ставить перед собой цель чтения, направляя внимание на полезную в данный момент информацию;
— различать темы и подтемы специального текста;
— выделять не только главную, но и избыточную информацию;
— прогнозировать последовательность изложения идей текста;
— сопоставлять разные точки зрения и разные источники информации по заданной теме;
— выполнять смысловое свёртывание выделенных фактов и мыслей;
— формировать на основе текста систему аргументов (доводов) для обоснования определённой позиции;
— понимать душевное состояние персонажей текста, сопереживать им.
Выпускник получит возможность научиться:
• анализировать изменения своего эмоционального состояния в процессе чтения, получения и переработки полученной информации и её осмысления.
Работа с текстом: преобразование и интерпретация информации
Выпускник научится:
• структурировать текст, используя нумерацию страниц, списки, ссылки, оглавление; проводить проверку правописания; использовать в тексте таблицы, изображения;
• преобразовывать текст, используя новые формы представления информации: формулы, графики, диаграммы, таблицы (в том числе динамические, электронные, в частности в практических задачах), переходить от одного представления данных к другому;
• интерпретировать текст:
— сравнивать и противопоставлять заключённую в тексте информацию разного характера;
— обнаруживать в тексте доводы в подтверждение выдвинутых тезисов;
— делать выводы из сформулированных посылок;
— выводить заключение о намерении автора или главной мысли текста.
Выпускник получит возможность научиться:
• выявлять имплицитную информацию текста на основе сопоставления иллюстративного материала с информацией текста, анализа подтекста (использованных языковых средств и структуры текста).
Работа с текстом: оценка информации
Выпускник научится:
• откликаться на содержание текста:
— связывать информацию, обнаруженную в тексте, со знаниями из других источников;
— оценивать утверждения, сделанные в тексте, исходя из своих представлений о мире;
— находить доводы в защиту своей точки зрения;
• откликаться на форму текста: оценивать не только содержание текста, но и его форму, а в целом — мастерство его исполнения;
• на основе имеющихся знаний, жизненного опыта подвергать сомнению достоверность имеющейся информации, обнаруживать недостоверность получаемой информации, пробелы в информации и находить пути восполнения этих пробелов;
• в процессе работы с одним или несколькими источниками выявлять содержащуюся в них противоречивую, конфликтную информацию;
• использовать полученный опыт восприятия информационных объектов для обогащения чувственного опыта, высказывать оценочные суждения и свою точку зрения о полученном сообщении (прочитанном тексте).
Выпускник получит возможность научиться:
• критически относиться к рекламной информации;
• находить способы проверки противоречивой информации;
• определять достоверную информацию в случае наличия противоречивой или конфликтной ситуации.
Основные понятия химии (уровень атомно-молекулярных представлений)
Выпускник научится:
• описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки;
• характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
• раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», используя знаковую систему химии;
• изображать состав простейших веществ с помощью химических формул и сущность химических реакций с помощью химических уравнений;
• вычислять относительную молекулярную и молярную массы веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости;
• сравнивать по составу оксиды, основания, кислоты, соли;
• классифицировать оксиды и основания по свойствам, кислоты и соли по составу;
• описывать состав, свойства и значение (в природе и практической деятельности человека) простых веществ — кислорода и водорода;
• давать сравнительную характеристику химических элементов и важнейших соединений естественных семейств щелочных металлов и галогенов;
• пользоваться лабораторным оборудованием и химической посудой;
• проводить несложные химические опыты и наблюдения за изменениями свойств веществ в процессе их превращений; соблюдать правила техники безопасности при проведении наблюдений и опытов;
• различать экспериментально кислоты и щёлочи, пользуясь индикаторами; осознавать необходимость соблюдения мер безопасности при обращении с кислотами и щелочами.
Выпускник получит возможность научиться:
• грамотно обращаться с веществами в повседневной жизни;
• осознавать необходимость соблюдения правил экологически безопасного поведения в окружающей природной среде;
• понимать смысл и необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.;
• использовать приобретённые ключевые компетентности при выполнении исследовательских проектов по изучению свойств, способов получения и распознавания веществ;
• развивать коммуникативную компетентность, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы;
• объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации, недобросовестной рекламе, касающейся использования различных веществ.
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества
Выпускник научится:
• классифицировать химические элементы на металлы, неметаллы, элементы, оксиды и гидроксиды которых амфотерны, и инертные элементы (газы) для осознания важности упорядоченности научных знаний;
• раскрывать смысл периодического закона Д. И. Менделеева;
• описывать и характеризовать табличную форму периодической системы химических элементов;
• характеризовать состав атомных ядер и распределение числа электронов по электронным слоям атомов химических элементов малых периодов периодической системы, а также калия и кальция;
• различать виды химической связи: ионную, ковалентную полярную, ковалентную неполярную и металлическую;
• изображать электронно-ионные формулы веществ, образованных химическими связями разного вида;
• выявлять зависимость свойств веществ от строения их кристаллических решёток: ионных, атомных, молекулярных, металлических;
• характеризовать химические элементы и их соединения на основе положения элементов в периодической системе и особенностей строения их атомов;
• описывать основные этапы открытия Д. И. Менделеевым периодического закона и периодической системы химических элементов, жизнь и многообразную научную деятельность учёного;
• характеризовать научное и мировоззренческое значение периодического закона и периодической системы химических элементов Д. И. Менделеева;
• осознавать научные открытия как результат длительных наблюдений, опытов, научной полемики, преодоления трудностей и сомнений.
Выпускник получит возможность научиться:
• осознавать значение теоретических знаний для практической деятельности человека;
• описывать изученные объекты как системы, применяя логику системного анализа;
• применять знания о закономерностях периодической системы химических элементов для объяснения и предвидения свойств конкретных веществ;
• развивать информационную компетентность посредством углубления знаний об истории становления химической науки, её основных понятий, периодического закона как одного из важнейших законов природы, а также о современных достижениях науки и техники.
Многообразие химических реакций
Выпускник научится:
• объяснять суть химических процессов и их принципиальное отличие от физических;
• называть признаки и условия протекания химических реакций;
• устанавливать принадлежность химической реакции к определённому типу по одному из классификационных признаков: 1) по числу и составу исходных веществ и продуктов реакции (реакции соединения, разложения, замещения и обмена); 2) по выделению или поглощению теплоты (реакции экзотермические и эндотермические); 3) по изменению степеней окисления химических элементов (реакции окислительно-восстановительные); 4) по обратимости процесса (реакции обратимые и необратимые);
• называть факторы, влияющие на скорость химических реакций;
• называть факторы, влияющие на смещение химического равновесия;
• составлять уравнения электролитической диссоциации кислот, щелочей, солей; полные и сокращённые ионные уравнения реакций обмена; уравнения окислительно-восстановительных реакций;
• прогнозировать продукты химических реакций по формулам/названиям исходных веществ; определять исходные вещества по формулам/названиям продуктов реакции;
• составлять уравнения реакций, соответствующих последовательности («цепочке») превращений неорганических веществ различных классов;
• выявлять в процессе эксперимента признаки, свидетельствующие о протекании химической реакции;
• приготовлять растворы с определённой массовой долей растворённого вещества;
• определять характер среды водных растворов кислот и щелочей по изменению окраски индикаторов;
• проводить качественные реакции, подтверждающие наличие в водных растворах веществ отдельных катионов и анионов.
Выпускник получит возможность научиться:
• составлять молекулярные и полные ионные уравнения по сокращённым ионным уравнениям;
• приводить примеры реакций, подтверждающих существование взаимосвязи между основными классами неорганических веществ;
• прогнозировать результаты воздействия различных факторов на изменение скорости химической реакции;
• прогнозировать результаты воздействия различных факторов на смещение химического равновесия.
Многообразие веществ
Выпускник научится:
• определять принадлежность неорганических веществ к одному из изученных классов/групп: металлы и неметаллы, оксиды, основания, кислоты, соли;
• составлять формулы веществ по их названиям;
• определять валентность и степень окисления элементов в веществах;
• составлять формулы неорганических соединений по валентностям и степеням окисления элементов, а также зарядам ионов, указанным в таблице растворимости кислот, оснований и солей;
• объяснять закономерности изменения физических и химических свойств простых веществ (металлов и неметаллов) и их высших оксидов, образованных элементами второго и третьего периодов;
• называть общие химические свойства, характерные для групп оксидов: кислотных, оснóвных, амфотерных;
• называть общие химические свойства, характерные для каждого из классов неорганических веществ: кислот, оснований, солей;
• приводить примеры реакций, подтверждающих химические свойства неорганических веществ: оксидов, кислот, оснований и солей;
• определять вещество-окислитель и вещество-восстановитель в окислительно-восстановительных реакциях;
• составлять окислительно-восстановительный баланс (для изученных реакций) по предложенным схемам реакций;
• проводить лабораторные опыты, подтверждающие химические свойства основных классов неорганических веществ;
• проводить лабораторные опыты по получению и собиранию газообразных веществ: водорода, кислорода, углекислого газа, аммиака; составлять уравнения соответствующих реакций.
Выпускник получит возможность научиться:
• прогнозировать химические свойства веществ на основе их состава и строения;
• прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав;
• выявлять существование генетической взаимосвязи между веществами в ряду: простое вещество — оксид — гидроксид — соль;
• характеризовать особые свойства концентрированных серной и азотной кислот;
• приводить примеры уравнений реакций, лежащих в основе промышленных способов получения аммиака, серной кислоты, чугуна и стали;
• описывать физические и химические процессы, являющиеся частью круговорота веществ в природе;
• организовывать, проводить ученические проекты по исследованию свойств веществ, имеющих важное практическое значение.
1
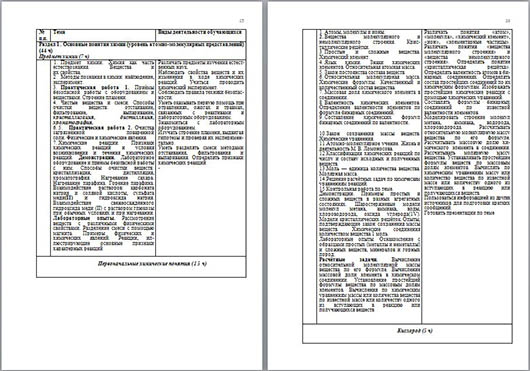

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (8-9 класс, ФГОС) (0.15 MB)
Рабочая программа по химии (8-9 класс, ФГОС) (0.15 MB)
 0
0 8777
8777 2320
2320 Нравится
0
Нравится
0



