Муниципальное общеобразовательное учреждение
«Сретенская средняя общеобразовательная школа № 1»
|
Рассмотрено на заседании Методического совета школы протокол № ___ от «___»___________2018г.
| СОГЛАСОВАНО Руководитель ШМО Кузнецова И.С. ______________ дата__________ Заместитель директора по УВР Зимина В.И. ______________ дата _________
| ___________УТВЕРЖДАЮ Директор МОУ «Сретенская СОШ №1» Гусевский Е.В. Приказ № ___ от «____»____________2018г.
|
Рабочая программа
предмета «Химия»
профильный уровень
для 11 класса
на 2018 – 2019 учебный год
Составитель:
Деревцова Татьяна Александровна,
учитель биологии, химии
Сретенск, 2018
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ УСВОЕНИЯ УЧЕБНОГО ПРЕДМЕТА
В результате изучения химии на профильном уровне ученик должен
знать/понимать
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-основные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в неорганической и органической химии;
основные законы химии: закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро, закон Гесса, закон действующих масс в кинетике и термодинамике;
основные теории химии: строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических соединений (включая стереохимию), химическую кинетику и химическую термодинамику;
классификацию и номенклатуру неорганических и органических соединений;
природные источники углеводородов и способы их переработки;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, стекло, цемент, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
уметь
называть изученные вещества по «тривиальной» и международной номенклатурам;
определять: валентность и степень окисления химических элементов, заряд иона, тип химической связи, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам органических соединений, характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
характеризовать: s-, p- и d-элементы по их положению в периодической системе Д. И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов и кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения; природу и способы образования химической связи; зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
выполнять химический эксперимент по: распознаванию важнейших неорганических и органических веществ; получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций;
осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
объяснения химических явлений, происходящих в природе, быту и на производстве;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
безопасной работы с веществами в лаборатории, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
распознавания и идентификации важнейших веществ и материалов;
оценки качества питьевой воды и отдельных пищевых продуктов;
критической оценки достоверности химической информации, поступающей из различных источников.
СОДЕРЖАНИЕ УЧЕБНОГО ПРЕДМЕТА
Тема 1. Строение атома (9 часов)
А т о м — с л о ж н а я ч а с т и ц а. Атом — сложная частица. Доказательства сложности строения атома: катодные и рентгеновские лучи, фотоэффект, радиоактивность. Открытие электрона, протона и нейтрона. Модели строения атома (Томсона, Резерфорда, Бора). Макромир и микромир. Квантово-механические представления о строении атома.
С о с т о я н и е э л е к т р о н о в в а т о м е. Нуклоны: протоны и нейтроны. Нуклиды. Изобары и изотопы. Квантово-механические представления о природе электрона. Понятие об электронной орбитали и электронном облаке. Квантовые числа: главное, орбитальное (побочное), магнитное и спиновое. Правила заполнения энергетических уровней и орбиталей электронами. Принцип минимума энергии, запрет Паули, правило Хунда, правило Клечковского. Электронные конфигурации атомов и ионов. Особенности электронного строения атомов хрома, меди, серебра и др.
В а л е н т н ы е в о з м о ж н о с т и а т о м о в х и м и ч ес к и х э л е м е н т о в. Валентные электроны. Валентные возможности атомов химических элементов, обусловленные различными факторами. Сравнение понятий «валентность» и «степень окисления».
П е р и о д и ч е с к и й з а к о н и П е р и о д и ч е с к а я с и с т е м а х и м и ч е с к и х э л е м е н т о в Д. И. М е н д е л ее в а и с т р о е н и е а т о м а. Предпосылки открытия Периодического закона. Открытие закона. Первая формулировка Периодического закона. Структура Периодической системы элементов. Современные представления о химическом элементе. Вторая формулировка Периодического закона. Периодическая система и строение атома. Физический смысл порядкового номера элемента, номеров группы и периода. Периодическое изменение свойств элементов: радиуса атома, электроотрицательности. Причины изменения металлических и неметаллических свойств элементов в группах и периодах, в том числе и в больших и сверхбольших. Особенности строения атомов актиноидов и лантаноидов. Третья формулировка Периодического закона. Значение Периодического закона и Периодической системы для развития науки и понимания химической картины мира.
Демонстрации
Фотоэффект.
Катодные лучи (электроннолучевые трубки), модели электронных облаков (орбиталей) различной формы.
Различные варианты таблиц Периодической системы химических элементов Д. И. Менделеева. Образцы простых веществ, оксидов и гидроксидов элементов 3-го периода и демонстрация их свойств.
Тема 2. Строение вещества. Дисперсные системы (15 часов)
Х и м и ч е с к а я с в я з ь. Е д и н а я п р и р о д а х им и ч е с к о й с в я з и. Понятие о химической связи как процессе взаимодействия атомов с образованием молекул, ионов и радикалов. Виды химической связи. Аморфные и кристаллические вещества. Ионная химическая связь. Дипольный момент связи. Свойства веществ с ионной кристаллической решеткой.
Ковалентная связь. Метод валентных связей в образовании ковалентной связи. Электроотрицательность и разновидности ковалентной связи по этому признаку: полярная и неполярная. Способ перекрывания электронных орбиталей и классификация ковалентных связей по этому признаку: - и - связи. Кратность ковалентных связей и их классификация по этому признаку: одинарная, двойная и т. д. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Основные свойства ковалентной связи: насыщаемость, направленность, дипольный момент. Полярность связи и полярность молекулы. Кристаллическое строение веществ с этим типом связи, их физические свойства.
Металлическая связь и ее особенности. Физические свойства металлов как функция металлической связи и металлической кристаллической решетки.
Водородная связь и механизм ее образования. Межмолекулярная и внутримолекулярная водородные связи. Физические свойства веществ с водородной связью. Биологическая роль водородной связи в организации структур биополимеров.
Ван-дер-ваальсово взаимодействие. Ориентационное, индукционное и дисперсионное взаимодействие между молекулами. Условность разделения веществ по типам связи, единая природа химической связи.
Г и б р и д и з а ц и я о р б и т а л е й и г е о м е т р и я м ол е к у л. Теория гибридизации и отталкивания валентных пар. Типы гибридизации электронных орбиталей и геометрия органических и неорганических молекул.
Т е о р и я с т р о е н и я х и м и ч е с к и х с о е д и н е н и й.
Предпосылки создания теории строения химических соединений: работы предшественников А. М. Бутлерова (Ж. Б. Дюма, Ф. Велер, Ш. Ф. Жерар, Ф. А. Кекуле), съезд естествоиспытателей в г. Шпейере. Личностные качества А. М. Бутлерова. Основные положения теории химического строения органических соединений и современной теории строения. Изомерия в органической и неорганической химии. Взаимное влияние атомов в молекулах органических и неорганических веществ.
Основные направления развития теории строения органических соединений (зависимость свойств веществ не только от химического, но и от их электронного и пространственного строения). Индукционный и мезомерный эффекты. Стереорегулярность.
Д и а л е к т и ч е с к и е о с н о в ы о б щ н о с т и д в у х в е д у щ и х т е о р и й х и м и и. Диалектические основы общности Периодического закона Д. И. Менделеева и теории строения А. М. Бутлерова в становлении (работы предшественников, накопление фактов, участие в съездах, русский менталитет), предсказании (новые элементы — Ga, Se, Ge и новые вещества — изомеры) и развитии (три формулировки).
П о л и м е р ы о р г а н и ч е с к и е и н е о р г а н и ч ес к и е. Полимеры. Основные понятия химии высокомолекулярных соединений: «мономер», «полимер», «макромолекула», «структурное звено», «степень полимеризации», «молекулярная масса». Способы получения полимеров: реакции полимеризации и поликонденсации. Строение полимеров: геометрическая форма макромолекул, кристалличность и аморфность, стереорегулярность. Полимеры органические и неорганические. Каучуки. Пластмассы. Волокна. Биополимеры: белки и нуклеиновые кислоты. Неорганические полимеры атомного строения (аллотропные модификации углерода, кристаллический кремний, селен и теллур цепочечного строения, диоксид кремния и др.) и молекулярного строения (сера пластическая и др.).
Д и с п е р с н ы е с и с т е м ы. Чистые вещества и смеси. Классификация химических веществ по чистоте. Состав смесей. Растворы. Растворимость веществ. Классификация растворов в зависимости от состояния растворенного вещества (молекулярные, молекулярно-ионные, ионные). Типы растворов по содержанию растворенного вещества. Концентрация растворов.
Понятие «дисперсная система». Классификация дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а также по размеру частиц. Грубодисперсные системы: эмульсии и суспензии. Тонкодисперсные коллоидные системы: золи и гели. Эффект Тиндаля. Коагуляция в коллоидных растворах. Синерезис в гелях.
Расчетные задачи. 1. Расчеты по химическим формулам. 2. Расчеты, связанные с понятиями «массовая доля» и «объемная доля» компонентов смеси. 3. Вычисление молярной концентрации растворов.
Демонстрации. Модели кристаллических решеток веществ с различным типом связей. Модели молекул различной геометрии. Модели кристаллических решеток алмаза и графита. Модели молекул изомеров структурной и пространственной изомерии. Модели кристаллических решеток металлов. Модели из воздушных шаров, отражающие пространственное расположение sp3-, sp2-, sp-гибридных орбиталей в молекулах органических и неорганических веществ.
Коллекция пластмасс и волокон. Образцы неорганических полимеров: серы пластической, фосфора красного, кварца и др. Модели молекул белков и ДНК. Образцы различных систем с жидкой средой. Коагуляция. Синерезис. Эффект Тиндаля.
Лабораторные опыты
1. Знакомство с коллекциями пищевых, медицинских и биологических гелей и золей.
2. Получение коллоидного раствора хлорида железа (ІІІ).
Тема 3. Химические реакции (24 часа)
К л а с с и ф и к а ц и я х и м и ч е с к и х р е а к ц и й в о р г а н и ч е с к о й и н е о р г а н и ч е с к о й х и м и и. Понятие о химической реакции, отличие ее от ядерной реакции. Расщепление ядер, термоядерный синтез, ядерный обмен. Аллотропные и полиморфные превращения веществ.
Классификация реакций в неорганической химии по числу и составу реагирующих веществ (разложения, соединения, замещения, обмена).
Классификация химических реакций в органической химии (присоединения, замещения, отщепления, изомеризации).
Классификация реакций по тепловому эффекту, по фазовому составу, по участию катализатора. Обратимые и необратимые реакции. Типы реагентов и понятие о механизмах химических реакций (ионном и свободнорадикальном).
Окислительно-восстановительные реакции и реакции, идущие без изменения степеней окисления элементов. Межмолекулярные и внутримолекулярные окислительно-восстановительные реакции. Реакции диспропорционирования. Методы составления окислительно-восстановительных реакций: метод электронного баланса и метод полуреакций.
Основные понятия химической термодинамики. Первое начало термодинамики. Тепловой эффект химической реакции. Закон Гесса и следствия из него. Теплота (энтальпия) образования вещества. Термохимические расчеты.
Понятие энтропии. Второе начало термодинамики. Свободная энергия Гиббса. Расчеты самопроизвольного протекания химической реакции.
С к о р о с т ь х и м и ч е с к и х р е а к ц и й. Предмет химической кинетики. Понятие скорости химической реакции. Кинетическое уравнение реакции и константа скорости химической реакции. Факторы, влияющие на скорость химической реакции (природа реагирующих веществ, концентрация, температура, поверхность соприкосновения веществ).
Понятие о катализаторах и катализе. Гомогенный и гетерогенный катализ. Ферменты. Ферментативный катализ и его механизм. Промоторы. Каталитические яды. Ингибиторы. Механизм действия катализаторов.
О б р а т и м о с т ь х и м и ч е с к и х р е а к ц и й. Х и м ич е с к о е р а в н о в е с и е. Обратимые химические реакции, изменение энергии Гиббса в обратимом процессе. Химическое равновесие и его динамический характер. Константа химического равновесия. Принцип Ле Шателье. Смещение химического равновесия.
Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я. Электролиты и неэлектролиты. Электролитическая диссоциация, механизм диссоциации веществ с различными видами связи. Сильные и слабые электролиты. Степень диссоциации и ее зависимость от различных факторов. Константа диссоциации. Произведение растворимости. Ионное произведение воды. Понятие рН. Водородный показатель.
Г и д р о л и з. Гидролиз как обменный процесс. Обратимый и необратимый гидролиз органических и неорганических веществ. Гидролиз солей. Гидролиз органических соединений как химическая основа обмена веществ. Гидролиз АТФ как основа энергетического обмена в живых организмах. Гидролиз органических соединений в промышленности (омыление жиров, получение гидролизного спирта и т. д.). Усиление и подавление обратимого гидролиза. Значение гидролиза в промышленности и в быту.
Расчетные задачи. 1. Расчеты по термохимическим уравнениям. 2. Вычисление теплового эффекта реакции по теплоте образования реагирующих веществ и продуктов реакции. 3. Определение рН раствора заданной молярной концентрации. 4. Расчет средней скорости реакции по концентрациям реагирующих веществ. 5. Вычисления с использованием понятия «температурный коэффициент скорости реакции». 6. Нахождение константы равновесия реакции по равновесным концентрациям и определение исходных концентраций веществ.
Демонстрации
Аллотропные превращения серы и фосфора.
Реакции, идущие с образованием газа, осадка или воды.
Окислительно-восстановительные реакции в неорганической химии (взаимодействие цинка с растворами соляной кислоты и сульфата меди (ІІ)).
Окислительно-восстановительные реакции в органической химии (окисление альдегида в карбоновую кислоту — реакция «серебряного зеркала» или реакция с гидроксилом меди (ІІ), окисление этанола на медном катализаторе).
Изучение зависимости скорости химической реакции от концентрации веществ, температуры (взаимодействие тиосульфата натрия с серной кислотой), поверхности соприкосновения веществ (взаимодействие соляной кислоты с гранулами и порошками алюминия или цинка).
Проведение каталитических реакций разложения пероксида водорода, горения сахара, взаимодействия воды и алюминия.
Коррозия железа в водной среде с уротропином и без него.
Наблюдение смещения химического равновесия в системе:
FeCl3 + 3KSCN  Fe(SCN)3 + 3KCl.
Fe(SCN)3 + 3KCl.
Сравнение электропроводности растворов электролитов.
Смещение равновесия диссоциации слабых кислот. Индикаторы и изменение их окраски в разных средах.
Ионные реакции и условия их протекания.
Гидролиз карбонатов, сульфатов и силикатов щелочных металлов, нитрата свинца (ІІ) или цинка, хлорида аммония.
Сернокислый и ферментативный гидролиз углеводов.
Лабораторные опыты.
3. Разложение пероксида водорода с помощью оксида меди (ІІ) и каталазы.
4. Знакомство с коллекцией СМС, содержащих энзимы.
5. Реакции, идущие с образованием осадка, газа или воды для органических и неорганических электролитов.
6. Различные случаи гидролиза солей. Исследование среды растворов с помощью индикаторной бумаги.
Практические работы
Практическая работа № 1. Скорость химических реакций. Химическое равновесие.
Практическая работа № 2. Решение экспериментальных задач по теме «Гидролиз».
Тема 4. Вещества и их свойства (45 часов)
К л а с с и ф и к а ц и я н е о р г а н и ч е с к и х в е щ е с т в.
Вещества простые и сложные. Благородные газы. Сравнительная характеристика простых веществ: металлов и неметаллов, относительность этой классификации. Сложные вещества: бинарные соединения (оксиды, галогениды, сульфиды и т. д.), гидроксиды, соли.
Понятие о комплексном соединении. Основы координационной теории строения комплексных соединений А. Вернера. Донорно-акцепторное взаимодействие комплексообразователей и лигандов. Координационное число комплексообразователя. Внутренняя и внешняя сфера комплексов.
Диссоциация комплексных соединений. Применение комплексных соединений в химическом анализе и в промышленности, их роль в природе.
К л а с с и ф и к а ц и я о р г а н и ч е с к и х в е щ е с т в.
Классификация органических веществ по строению углеродной цепи (ациклические и циклические, насыщенные и ненасыщенные, карбоциклические и гетероциклические, ароматические углеводороды). Углеводороды (алканы, алкены, алкины, циклоалканы, алкадиены, арены, галогенопроизводные углеводородов). Функциональные группы (гидроксильная, карбонильная, карбоксильная, нитрогруппа, аминогруппа) и классификация веществ по этому признаку. Гетерофункциональные соединения. Гетероциклические соединения.
М е т а л л ы. Положение металлов в Периодической системе Д. И. Менделеева. Особенности строения атомов и кристаллов. Полиморфизм. Общие физические свойства металлов. Ферромагнетики, парамагнетики и диамагнетики.
Электрохимический ряд напряжений металлов. Стандартный водородный электрод. Стандартные электродные потенциалы. Общие химические свойства металлов: взаимодействие с неметаллами, водой, бинарными соединениями, кислотами, солями. Взаимодействие некоторых металлов с растворами щелочей. Взаимодействие активных металлов с органическими соединениями. Особенности реакций металлов с азотной и концентрированной серной кислотой.
К о р р о з и я м е т а л л о в. Понятие коррозии. Химическая и электрохимическая коррозия и способы защиты металлов от коррозии.
О б щ и е с п о с о б ы п о л у ч е н и я м е т а л л о в. Металлы в природе. Основные способы получения металлов (пирометаллургия, гидрометаллургия, электрометаллургия).
Электролиз как окислительно-восстановительный процесс. Электролиз расплавов электролитов. Электролиз растворов электролитов с инертными и активными электродами. Использование электролиза в промышленности. Гальванические элементы. Процессы на электродах в гальваническом элементе. Аккумулятор. Топливные элементы.
М е т а л л ы г л а в н ы х п о д г р у п п. Щелочные металлы, общая характеристика на основе положения в Периодической системе элементов Д. И. Менделеева и строения атомов. Получение, физические и химические свойства, применение щелочных металлов и их соединений. Бериллий, магний, щелочноземельные металлы, их общая характеристика на основе положения в Периодической системе элементов Д. И. Менделеева и строения атомов. Получение, физические и химические свойства, применение щелочноземельных металлов и их соединений. Алюминий, строение атома, физические и химические свойства, получение и применение.
М е т а л л ы п о б о ч н ы х п о д г р у п п. Характеристика металлов побочных подгрупп по их положению в Периодической системе элементов Д. И. Менделеева и строению атомов.
Медь: физические и химические свойства, получение и применение. Важнейшие соединения меди.
Физические и химические свойства, получение и применение цинка. Характеристика важнейших соединений (оксида и гидроксида цинка).
Физические и химические свойства, получение и применение хрома. Характеристика важнейших соединений (оксида и гидроксида хрома (ІІІ), дихроматов и хроматов щелочных металлов). Особенности восстановления дихроматов в зависимости от среды растворов.
Физические и химические свойства, получение и применение марганца. Характеристика важнейших соединений: оксидов, гидроксидов, солей. Особенности восстановления перманганатов в зависимости от среды растворов.
Н е м е т а л л ы. Положение неметаллов в Периодической системе Д. И. Менделеева. Особенности строения атомов и кристаллов. Аллотропия.
Благородные газы.
Окислительные и восстановительные свойства неметаллов. Общая характеристика водородных соединений неметаллов. Общая характеристика оксидов и гидроксидов неметаллов.
Галогены. Строение атомов галогенов, их сравнительная характеристика. Свойства простых веществ образованных галогенами. Окислительные свойства галогенов. Галогеноводороды, их свойства, сравнительная характеристика. Хлор и его соединения, нахождение в природе, получение, свойства, применение. Хлороводород и соляная кислота. Хлориды. Кислородные соединения хлора.
Халькогены. Нахождение кислорода и серы в природе, получение их в промышленности и лаборатории. Свойства кислорода и серы: аллотропия и физические свойства аллотропных модификаций; окислительные свойства кислорода и серы в реакциях с простыми веществами. Восстановительные свойства серы. Окисление кислородом сложных веществ. Окислительные свойства озона. Применение кислорода и озона. Применение серы. Сероводород, нахождение в природе, получение, строение молекулы и свойства: физические и химические. Сероводородная кислота и сульфиды. Оксид серы (ІV), его свойства. Сернистая кислота и ее соли. Серная кислота: промышленное производство, физические и химические свойства (окислительные и обменные). Применение серной кислоты. Соли серной кислоты.
Азот. Нахождение в природе, получение. Строение молекулы. Окислительные и восстановительные свойства азота. Применение азота. Аммиак: получение, строение молекулы, свойства (основные, реакции комплексообразования, восстановительные, окислительные, реакции с органическими веществами и с углекислым газом). Соли аммония и их применение. Оксиды азота, их строение и свойства. Азотная кислота: получение, строение молекулы и свойства. Нитраты, их термическое разложение. Распознавание нитратов и их применение.
Фосфор. Нахождение в природе, получение. Аллотропия и физические свойства модификаций. Окислительные свойства (реакции с металлами) и восстановительные свойства фосфора (реакции с галогенами, кислородом, концентрированной серной и азотной кислотами). Оксид фосфора (V). Фосфорные кислоты и их соли.
Углерод. Нахождение в природе. Аллотропия и физические свойства модификаций (повторение). Химические свойства углерода: восстановительные (взаимодействие с галогенами, кислородом, серой, азотом, водой, оксидом меди (ІІ), концентрированной серной и азотной кислотами) и окислительные (взаимодействие с металлами, водородом, кремнием, бором). Получение, свойства и применение оксидов углерода. Угольная кислота и ее соли.
Кремний. Нахождение кремния в природе и его получение. Аллотропия и свойства аллотропных модификаций кремния. Восстановительные (реакции с галогенами, кислородом, растворами щелочей) и окислительные свойства кремния (реакции с металлами). Применение кремния. Оксид кремния, кремниевая кислота и ее соли. Силикатная промышленность.
К и с л о т ы о р г а н и ч е с к и е и н е о р г а н и ч е с к и е.
Состав, классификация и номенклатура неорганических и органических кислот. Получение важнейших органических и неорганических кислот. Химические свойства (реакции с металлами, с оксидами металлов, с основаниями, с солями, со спиртами). Окислительно-восстановительные свойства кислот. Особенности свойств серной и азотной кислот, муравьиной и щавелевой кислот.
О с н о в а н и я о р г а н и ч е с к и е и н е о р г а н и ч ес к и е. Состав, классификация, номенклатура неорганических и органических оснований. Основные способы получения гидроксидов металлов (щелочей — реакциями металлов и их оксидов с водой, нерастворимых оснований — реакцией обмена). Получение аммиака и аминов. Химические свойства оснований: щелочей (реакции с кислотами, кислотными оксидами, растворами солей, с простыми веществами, с галоидопроизводными углеводородов, фенолом, жирами); нерастворимых оснований (реакции с кислотами, реакции разложения).
А м ф о т е р н ы е о р г а н и ч е с к и е и н е о р г а н и ч ес к и е с о е д и н е н и я. Способы получения амфотерных соединений (амфотерных оснований и аминокислот), их химические свойства. Относительность деления соединений на кислоты и основания.
Г е н е т и ч е с к а я с в я з ь м е ж д у к л а с с а м и о р г ан и ч е с к и х и н е о р г а н и ч е с к и х с о е д и н е н и й. Понятия «генетическая связь» и «генетический ряд». Основные признаки генетического ряда. Генетические ряды металлов (на примере кальция и железа) и неметаллов (на примере серы и кремния) и переходного элемента (на примере алюминия). Генетические ряды и генетическая связь в органической химии. Единство мира веществ.
Расчетные задачи
1. Вычисление массы или объема продуктов реакции по известной массе или объему исходного вещества, содержащего примеси.
2. Вычисление массы исходного вещества, если известен практический выход и массовая его доля от теоретически возможного.
3. Вычисления по химическим уравнениям реакций, если одно из реагирующих веществ дано в избытке. 4. Определение молекулярной формулы вещества по масcовым долям элементов.
5. Определение молекулярной формулы газообразного вещества по известной относительной плотности и массовым долям элементов.
6. Нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания.
7. Комбинированные задачи.
Демонстрации
Коллекция «Классификация неорганических веществ».
Получение комплексных органических и неорганических соединений.
Демонстрация сухих кристаллогидратов.
Коллекция «Классификация органических веществ».
Модели кристаллических решеток металлов.
Коллекция металлов с разными физическими свойствами.
Взаимодействие металлов с неметаллами (цинка с серой, алюминия с иодом), с растворами кислот и щелочей.
Горение металлов (цинка, железа, магния в кислороде).
Взаимодействие азотной и концентрированной серной кислот с медью.
Коррозия металлов в различных условиях и методы защиты от нее.
Коллекция руд.
Восстановление меди из оксида меди (ІІ) углем и водородом.
Алюминотермия.
Взаимодействия сульфата меди (ІІ) с железом.
Составление гальванических элементов.
Электролиз раствора сульфата меди (ІІ).
Образцы щелочных металлов.
Реакция окрашивания пламени солями щелочных металлов.
Взаимодействие лития и натрия с водой и этиловым спиртом.
Взаимодействие натрия с серой.
Образцы металлов IIA группы.
Взаимодействие кальция с водой.
Горение магния в воде и твердом углекислом газе.
Качественные реакции на катионы магния, кальция, бария.
Реакции окрашивания пламени солями металлов IIА группы.
Использование гидроксида меди (II) в качественных реакциях органических соединений.
Переход хромата в дихромат и обратно.
Получение и исследование свойств гидроксида хрома (ІІІ).
Окислительные свойства дихромата калия.
Окислительные свойства перманганата калия в реакциях с органическими и неорганическими соединениями.
Модели кристаллических решеток йода, алмаза, графита.
Взрыв смеси водорода с кислородом (гремучего газа).
Горение серы, фосфора и угля в кислороде.
Обесцвечивание бромной (йодной) воды этиленом.
Галогены (простые вещества).
Окислительные свойства хлорной воды.
Получение соляной кислоты и ее свойства.
Получение кислорода.
Получение оксидов горением простых и сложных веществ.
Взаимодействие серы с металлами (алюминием, цинком, железом).
Получение сероводорода и сероводородной кислоты, доказательство наличия сульфид-иона в растворе. Свойства серной кислоты.
Схема промышленной установки фракционной перегонки воздуха.
Получение и разложение хлорида аммония.
Получение оксида азота (ІV) реакцией взаимодействия меди с концентрированной азотной кислотой. Взаимодействие оксида азота (ІV) с водой.
Разложение нитрата натрия, горение черного пороха.
Горение фосфора, растворение оксида фосфора (V) в воде и исследование полученного раствора индикатором.
Коллекция природных соединений углерода.
Кристаллические решетки алмаза и графита.
Адсорбция оксида азота (ІV) активированным углем.
Переход карбоната в гидрокарбонат и обратно.
Коллекции природных силикатов и продукции силикатной промышленности.
Взаимодействие концентрированных азотной и серной кислот, а также разбавленной азотной кислоты с медью.
Реакция «серебряного зеркала» для муравьиной кислоты.
Взаимодействие аммиака и метиламина с хлороводородом и водой.
Взаимодействие раствора гидроксида натрия с амфотерным гидроксидом цинка или алюминия. Осуществление превращений:
Ca CaO Ca(OH)2


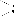
Ca3(PO4)2
P P2O5 H3PO4

Cu CuO CuSO4 Cu(OH)2 CuO Cu





С2Н5ОН

C2H4 CH3COH СH3COOH CH2OH CH2OH


CH2OH CH2OH
Лабораторные опыты
7. Ознакомление с образцами представителей разных классов неорганических веществ.
8. Взаимодействие многоатомных спиртов и глюкозы с фелинговой жидкостью.
9. Качественные реакции на ионы Fe2+ и Fe3+.
10. Ознакомление с образцами представителей разных классов органических веществ.
11. Взаимодействие металлов с растворами кислот и солей.
12. Ознакомление с коллекцией руд.
13. Ознакомление с коллекцией химических источников тока (батарейки, свинцовые аккумуляторы и т. д.).
14. Взаимодействие алюминия с растворами кислот и щелочей.
15. Получение и изучение свойств гидроксида алюминия.
16. Качественные реакции на катионы меди.
17. Разложение гидроксида меди (II).
18. Получение и исследование свойств гидроксида цинка.
19. Качественные реакции на галогенид-ионы.
20. Ознакомление с коллекцией природных соединений серы.
21. Качественные реакции на сульфид-, сульфит- и сульфат-анионы.
22. Качественная реакция на ион аммония.
23. Распознавание нитратов.
24. Качественная реакция на фосфат-анион.
25. Получение углекислого газа взаимодействием мрамора с соляной кислотой и исследование его свойств.
26. Качественная реакция на карбонат-анион.
27. Получение кремниевой кислоты взаимодействием раствора силиката натрия с сильной кислотой.
28. Растворение кремниевой кислоты в щелочи.
Практические работы
Практическая работа № 3. Получение газов и изучение их свойств.
Практическая работа № 4. Решение экспериментальных задач по органической химии.
Практическая работа № 5. Решение экспериментальных задач по неорганической химии.
Практическая работа № 6. Сравнение свойств неорганических и органических соединений.
Практическая работа № 7. Генетическая связь между классами неорганических и органических веществ.
Тема 5. Химия и общество (9 часов)
Х и м и я и п р о и з в о д с т в о. Химическая промышленность. Химическая технология. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. Защита окружающей среды и охрана труда при химическом производстве. Производство аммиака и метанола в сравнении. Биотехнология. Нанотехнология.
Х и м и я и с е л ь с к о е х о з я й с т в о. Основные направления химизации сельского хозяйства. Удобрения и их классификация. Химическая мелиорация почв. Пестициды и их классификация. Химизация животноводства.
Х и м и я и п р о б л е м ы о х р а н ы о к р у ж а ю щ е й с р е д ы. Основные факторы химического загрязнения окружающей среды. Охрана атмосферы, водных ресурсов, земельных ресурсов от химического загрязнения.
Х и м и я и п о в с е д н е в н а я ж и з н ь ч е л о в е к а. Лекарства. Моющие и чистящие средства. Химические средства гигиены и косметики. Международная символика по уходу за текстильными изделиями. Маркировка на упаковках пищевых продуктов и информация, которую она символизирует.
Демонстрации
Видеофрагменты по производству аммиака и метанола.
Слайды и другие видеоматериалы, иллюстрирующие био- и нанотехнологии.
Коллекция «Минеральные удобрения».
Коллекция пестицидов.
Видеофрагменты по химической мелиорации почв и химизации животноводства.
Видеофрагменты и слайды экологической тематики.
Домашняя, автомобильная аптечки и аптечка химического кабинета.
Коллекция моющих и чистящих средств.
Лабораторные опыты
29. Ознакомление с образцами средств бытовой химии и лекарственных препаратов, изучение инструкций к ним по правильному и безопасному применению.
30. Изучение международной символики по уходу за текстильными изделиями и маркировки на упаковках пищевых продуктов.
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
ХИМИЯ. 11 КЛАСС.
3 час в неделю: 102 часа
(профильный уровень)
| № п/п | тема урока
| кол-во часов | планируемая дата проведения | фактическая дата проведения | примечание |
| Строение атома (9 часов) | |||||
| | Строение атома. | 1 |
|
|
|
| | Строение атомного ядра. Изотопы. Ядерные реакции. | 1 |
|
|
|
| | Состояние электрона в атоме. Квантовые числа. | 1 |
|
|
|
| | Строение электронных оболочек атомов. Электронные и электроннографические формулы (конфигурации). | 1 |
|
|
|
| | Валентные возможности атомов химических элементов. | 1 |
|
|
|
| | Открытие Д. И. Менделеевым Периодического закона. | 1 |
|
|
|
| | Периодический закон и строение атома. | 1 |
|
|
|
| | Зависимость свойств элементов и соединений от их положения в Периодической системе. Значение Периодического закона. | 1 |
|
|
|
| | Контрольная работа по теме: «Строение атома». | 1 |
|
|
|
| Строение вещества. Дисперсные системы (15 часов) | |||||
| | Химическая связь. Ионная связь. | 2 |
|
|
|
| | Ковалентная связь. | 1 |
|
|
|
| | Металлическая связь. | 1 |
|
|
|
| | Водородная связь. | 1 |
|
|
|
| | Пространственное строение молекул. | 1 |
|
|
|
| | Теория строения химических соединений. | 1 |
|
|
|
| | Основные направления развития теории строения. | 1 |
|
|
|
| | Семинар «Диалектические основы общности двух ведущих теорий химии». | 1 |
|
|
|
| | Полимеры органические и неорганические. | 2 |
|
|
|
| | Чистые вещества и смеси. Растворы. | 1 |
|
|
|
| | Понятие о дисперсных системах, их классификация и значение. | 1 |
|
|
|
| | Обобщение и систематизация знаний по теме: «Строение вещества. Дисперсные системы и растворы». | 2 |
|
|
|
| | Контрольная работа № 2 по теме: «Строение вещества. Дисперсные системы и растворы». | 1 |
|
|
|
| Химические реакции (24 часа) | |||||
| | Классификация химических реакций по числу и составу реагирующих веществ и другим признакам. | 2 |
|
|
|
| | Классификация реакций по изменению степеней окисления атомов. | 2 |
|
|
|
| | Тепловые эффекты и причины протекания химических реакций. | 2 |
|
|
|
| | Скорость химической реакции. | 2 |
|
|
|
| | Катализ и катализаторы. | 1 |
|
|
|
| | Химическое равновесие. | 2 |
|
|
|
| | Решение расчетных задач. | 3 |
|
|
|
| | Практическая работа № 1 «Скорость химических реакций. Химическое равновесие». | 1 |
|
|
|
| | Электролитическая диссоциация. | 1 |
|
|
|
| | Свойства растворов электролитов. | 2 |
|
|
|
| | Гидролиз. | 2 |
|
|
|
| | Практическая работа № 2 «Решение экспериментальных задач по теме «Гидролиз»». | 1 |
|
|
|
| | Обобщение и систематизация знаний по теме: «Химические реакции». | 2 |
|
|
|
| | Контрольная работа № 3 по теме: «Химические реакции». | 1 |
|
|
|
| Вещества и их свойства (45 часов) | |||||
| | Классификация неорганических веществ. | 1 |
|
|
|
| | Классификация неорганических веществ. Комплексные соединения неорганические и органические. | 1 |
|
|
|
| | Классификация органических веществ. | 1 |
|
|
|
| | Общая характеристика металлов и их соединений. | 1 |
|
|
|
| | Химические свойства металлов. | 2 |
|
|
|
| | Коррозия металлов. | 1 |
|
|
|
| | Получение металлов. | 1 |
|
|
|
| | Электролиз. Химические источники тока. | 1 |
|
|
|
| | Щелочные металлы. | 1 |
|
|
|
| | Бериллий, магний и щелочноземельные металлы. | 1 |
|
|
|
| | Алюминий и его соединения. | 1 |
|
|
|
| | Металлы побочных подгрупп. Мед | 1 |
|
|
|
| | Цинк. | 1 |
|
|
|
| | Хром. | 2 |
|
|
|
| | Марганец. | 1 |
|
|
|
| | Общая характеристика неметаллов и их соединений. | 2 |
|
|
|
| | Общие химические свойства неметаллов. | 1 |
|
|
|
| | Галогены и их соединения. | 1 |
|
|
|
| | Халькогены - простые вещества. | 1 |
|
|
|
| | Соединения серы. | 2 |
|
|
|
| | Азот и его соединения. | 2 |
|
|
|
| | Фосфор и его соединения. | 1 |
|
|
|
| | Углерод и его соединения. | 2 |
|
|
|
| | Кремний и его соединения. | 1 |
|
|
|
| | Обобщение и систематизация знаний по химии элементов. | 2 |
|
|
|
| | Контрольная работа № 4 по теме: «Химия элементов». | 1 |
|
|
|
| | Кислоты органические и неорганические. | 1 |
|
|
|
| | Основания органические и неорганические. | 1 |
|
|
|
| | Амфотерные органические и неорганические соединения. | 1 |
|
|
|
| | Генетическая связь между классами органических и неорганических соединений. | 2 |
|
|
|
| | Практическая работа № 3 «Получение газов и изучение их свойств». | 1 |
|
|
|
| | Практическая работа № 4 «Решение экспериментальных задач по органической химии». | 1 |
|
|
|
| | Практическая работа № 5 «Решение экспериментальных задач по неорганической химии» | 1 |
|
|
|
| | Практическая работа № 6 «Сравнение свойств неорганических и органических соединений» | 1 |
|
|
|
| | Практическая работа № 7 «Генетическая связь между классами неорганических и органических соединений». | 1 |
|
|
|
| | Обобщение и систематизация знаний по теме: «Вещества и их свойства». | 1 |
|
|
|
| | Контрольная работа № 5 по теме: «Вещества и их свойства». | 1 |
|
|
|
| Химия и общество (9 часов) | |||||
| | Химия и производство. | 2 |
|
|
|
| | Химия и сельское хозяйство. | 2 |
|
|
|
| | Химия и проблемы охраны окружающей среды. | 2 |
|
|
|
| | Химия и повседневная жизнь человека. | 2 |
|
|
|
| | Конференция «Роль химии в моей жизни». | 1 |
|
|
|
| Итого | 102 |
| |||

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа по химии 11 класс (профильный уровень) (138.63 KB)
Рабочая программа по химии 11 класс (профильный уровень) (138.63 KB)
 0
0 1928
1928 153
153 Нравится
0
Нравится
0



