Краевой научно-практическая конференция
«Шаг в науку-2014»
Группа «ЮНИОР»
Секция «Химия и химические технологии»
Удивительный мир кристаллов
Российская Федерация, Забайкальский край
Агинский Бурятский округ
село Зугалай
Жадамбаева Аюра Жыгдэновна
МОУ «Зугалайская средняя общеобразовательная школа»
6 класс
Руководитель: Гармаева Бутит-Цыбжит Павловна
учитель химии
МОУ «Зугалайская средняя общеобразовательная школа»
с.Зугалай
Удивительный мир кристаллов
Жадамбаева Аюра Жыгдэновна
Российская Федерация, Забайкальский край, Агинский Бурятский округ, село Зугалай
МОУ «Зугалайская средняя общеобразовательная школа»
На любимый праздник – Новый год, учитель химии поставила в вазу чудесные еловые веточки, припорошенные снегом! Шли дни, а снег на веточках все не таял?! Она раскрыла секрет «Новогоднего инея»: – это кристаллы соли, – и обещала научить «колдовать», то есть выращивать кристаллы. Я узнала, что кристаллы получают в лаборатории, но бывают они и в природе. Например, снежинки, морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев (приложение1). Неужели из обычной соли, которая есть на каждом столе, в каждом доме, может получиться такая красота?
Гипотеза исследования:
Читая дополнительную литературу, я узнала, что кристаллы могут появляться при использовании разных способов выращивания и при создании определенных для них условий. Значит, если изменять условия кристаллизации и растворять различные вещества, то можно получать кристаллы разной формы и цвета?
Это я и решила проверить опытным путем. Поэтому, цель моей работы: изучение методики получения кристаллов и их исследование в лабораторных условиях.
Задачи:
изучить материал о процессе кристаллизации, о способах и методах получения кристаллов, их форме, видах, свойствах и областях применения;
апробировать опытно-экспериментальным путем способы получения кристаллов из растворов;
Объект исследования: кристаллы веществ
Предмет исследования: процесс кристаллизации
Методы исследования:
- Теоретические (анализ, сравнение, изучение специальной литературы);
- Эмпирические (наблюдение, сравнение);
- Исследовательские (проведение эксперимента).
Новизна работы состоит в том, что та позволила почувствовать себя в роли экспериментатора и самостоятельно получить образцы кристаллов. Данная работа может быть полезной для других. Здесь можно взять идеи по использованию самостоятельно выращенных кристаллов, продолжить изучение кристаллов при их нарастании и найти причины нетипичного поведения некоторых из них.
Прежде чем провести свои практические исследования, я должна узнать, что такое процесс кристаллизации, какие при этом кристаллы образуются и как влияют различные условия на процесс образования кристаллов. Поэтому я обратилась к теоретическим источникам в этой области. Для этого я использовала научно-методическую литературу и Интернет ресурсы.
Удивительный мир кристаллов
Жадамбаева Аюра Жыгдэновна
Российская Федерация, Забайкальский край, Агинский Бурятский округ, село Зугалай
МОУ «Зугалайская средняя общеобразовательная школа»
1.Литературный обзор
1.1. Кристаллическое и аморфное состояние твердого вещества
Твердые тела могут существовать в двух существенно различных состояниях, отличающихся своим внутренним строением и свойствами. Это кристаллическое и аморфное состояние твердых тел.
Кристаллы – твердые тела, атомы, ионы или молекулы которых образуют упорядоченную периодическую структуру (кристаллическую решетку). Причем этот пространственный порядок сохраняется на огромных «по атомным масштабам» расстояниях. Атомы, находящиеся на противоположных гранях монокристалла, могут быть удалены на десятки сантиметров, и в то же время они, будто чувствуя друг друга, располагаются параллельно. При этом между ними находятся миллиарды других атомов, так же четко взаимно расположенных. 3
Если весь кусок вещества представляет собой один кристалл, то такое тело называется монокристаллом или просто кристаллом. В других случаях тело представляет собой множество мелких кристалликов, причудливо сросшихся между собой, например, кусок рафинада. Такие тела называют поликристаллическими.
Кристаллическое состояние характеризуется наличием четко выделяемых естественных граней, образующих между собой определенные углы. Кристаллы могут иметь от четырех до нескольких сотен граней. Но при этом они обладают замечательным свойством –какими бы ни были размеры, форма и число граней одного и того же кристалла, все плоские грани пересекаются друг с другом под определенными углами. Углы между соответственными гранями всегда одинаковыми.
Кристаллы каменной соли, например, могут иметь форму куба, параллелепипеда,
призмы или тела более сложной формы, но всегда их грани пересекаются под прямыми
углами. Грани кварца имеют форму неправильных шестиугольников, но углы между гранями всегда одни и те же – 120°.
Закон постоянства углов, открытый в 1669 г. датчанином Николаем Стено, является
важнейшим законом науки о кристаллах — кристаллографии 5.
Второй вид твердого состояния – аморфное состояние. Ам́орфные веществ́а не имеют упорядоченной структуры и в отличие от кристаллов не расщепляются с образованием кристаллических граней; как правило они изотропны, то есть не обнаруживают различных свойств в разных направлениях, не имеют определённой точки плавления.
Некоторые вещества могут находиться в любом из этих двух состояний. Например, если расплавить кристаллический кварц (температура плавления около 1700° С), то при охлаждении он образует плавленый кварц, с другими физическими свойствами, одинаковыми по всем направлениям. Аморфное состояние - неустойчивое состояние твердых тел, которые стремятся со временем перейти в кристаллическую форму, хотя этот процесс может протекать достаточно долго.
1.2. Форма кристаллов
Приглядевшись к кристаллам внимательнее, можно увидеть еще одну характерную для них особенность: кристаллы разных веществ отличаются друг от друга своими формами. Кубики кристаллов каменной соли не спутаешь с игольчатыми кристаллами азотнокислого калия. Однако формы кристаллов различных веществ могут быть очень похожими. А главное не в этом. Ведь не всегда кристалл вырастает многогранником - это удается ему лишь при благоприятных условиях, когда ничто не мешает ему при росте. Каков же самый характерный, самый основной признак кристалла? Ответ такой. Самой характерной особенностью кристалла – является его атомная структура, правильное симметричное, закономерное расположение атомов.
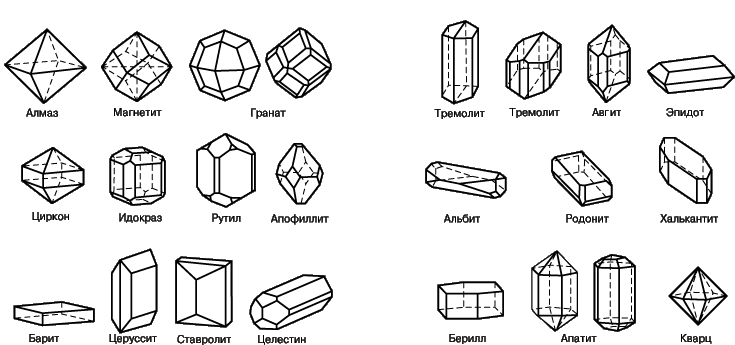 Некоторые кристаллы имеют довольно простую форму, но их комбинации могут создавать очень сложные многогранники. 4 Атомы могут выстраиваться в достаточно причудливые структуры, напоминающие тетраэдры, параллелепипеды, икосаэдры и прочие геометрические фигуры. В науке о кристаллах — кристаллографии — в зависимости от симметрии расположения атомов выделяют 6 кристаллических групп, которые распадаются на 32 класса.
Некоторые кристаллы имеют довольно простую форму, но их комбинации могут создавать очень сложные многогранники. 4 Атомы могут выстраиваться в достаточно причудливые структуры, напоминающие тетраэдры, параллелепипеды, икосаэдры и прочие геометрические фигуры. В науке о кристаллах — кристаллографии — в зависимости от симметрии расположения атомов выделяют 6 кристаллических групп, которые распадаются на 32 класса.
В результате получается несколько сотен различных форм макроорганизации кристаллических тел. Причем на форму монокристалла влияет не только форма элементарной атомной ячейки, но и те условия, в которых происходит рост кристалла.
1.3. Природные кристаллы
Как же растут кристаллы в природе? Например, при застывании магмы. Это процесс роста кристаллов из расплавов. Магма представляет собой смесь многих веществ, у которых различны температуры кристаллизации. Чем медленнее застывает магма, тем больше успевают вырасти кристаллические зерна составляющих ее минералов. Впрочем, величина кристалликов зависит еще и от многих других причин.
Самый известный кристалл в природе – это кристалл поваренной соли. Свыше пятисот лет назад древнерусские солевары научились извлекать соль из соляных источников. Вода в соленых источниках горько-соленая, в ней растворено много различных солей. Летом, когда под лучами палящего солнца вода озер быстро испаряется, из нее начинают выпадать кристаллы солей. Эти кристаллы плавают на поверхности озера и оседают на дне, на прибрежных камнях, на досках, на любом твердом предмете, попавшем в озеро. Даже рука, опущенная на несколько минут в озеро, покрывается тонким слоем соли. Сила кристаллизации соляных пластов столь велика, что, расширяясь, они выдавливаются из земли, становясь на ребро.
Обыкновенная столовая соль, хлористый натрий, без которого человек не может обойтись, представляет собой очень мелкие кристаллики, в земле же соль встречается иногда в виде очень больших кристаллов - так называемой каменной соли.
Особенно интересна кристаллизация подземных вод в пещерах. Капля за каплей просачиваются воды и падают со сводов пещеры вниз. Каждая капля при этом частично испаряется и оставляет на потолке пещеры вещество, которое было в ней растворено. Так постепенно образуется на потолке пещеры маленький бугорок, вырастающий затем в сосульку. Эти сосульки сложены из кристалликов. Навстречу им начинают расти вверх такие же длинные столбы сосулек со дна пещеры. Иногда сосульки, растущие сверху (сталактиты) и снизу (сталагмиты), встречаются, срастаются вместе и образуют колонны. Так возникают в подземных пещерах узорчатые, витые гирлянды, причудливые колоннады.
Кроме того, камни образуются и в организме человека: желчные камни в печени, камни в почках и мочевом пузыре, мельчайшие отложения в сосудистой оболочке глаза.
Некоторые живые организмы представляют собой настоящие “фабрики” кристаллов. Кораллы, например, образуют целые острова, сложенные из микроскопических мелких кристалликов углекислой извести.
Драгоценный камень жемчуг тоже построен из мелких кристаллов, которые вырабатывает моллюск жемчужница. Если в раковину жемчужницы попадает песчинка или камешек, то моллюск начинает откладывать перламутр вокруг пришельца. Слой за слоем нарастает на песчинке перламутр, образующий шарики жемчуга.
1.4. Искусственные кристаллы
Для многих отраслей науки и техники требуются кристаллы очень высокой химической чистоты с совершенной кристаллической структурой. Кристаллы, встречающиеся в природе, этим требованиям не удовлетворяют, так как они растут в условиях, весьма далеких от идеальных. Кроме того, потребность во многих кристаллах превышает запасы в природных месторождениях. Из более чем 3000 минералов, существующих в природе, искусственно удалось получить уже больше половины.
Искусственные кристаллы пробовали выращивать еще в XVI веке, но научились этому
делу только в середине XX столетия. Кристаллы соли, сахара и квасцов в счет, конечно, не
идут, поскольку водорастворимые химические соединения умеют превращаться в причудливые горы и леса с незапамятных времен. Сегодня растят не только то, что необходимо для промышленного применения, но и просто красивые камни для украшений, типа фианитов и изумрудов. Значение сверхчистых кристаллических материалов в нашей жизни огромно. Электроника использует особо чистый кристаллический кремний, сапфир, рубин и кварц, машиностроение — искусственные алмазы, корунд, рубин, нитевидный углерод. 3
Особый класс материалов составляют так называемые жидкие кристаллы. Эти уникальные вещества, сочетающие в себе подвижность жидкости и анизотропию твердого тела, по сути, кристаллами не являются и выглядят, как обычная мутная жидкость, если их налить в стакан. Но в виде тонкого слоя, заключенного между двумя стеклянными пластинами с токопроводящим покрытием, они превращаются в тот самый ЖК-дисплей, без которого не обходятся сегодня ни сотовые телефоны, ни персональные компьютеры.
2. ОБРАЗОВАНИЕ КРИСТАЛЛОВ
2.1. Кристаллизация
КРИСТАЛЛИЗА́ЦИЯ - процесс образования кристаллов из паров, растворов, расплавов, из вещества в другом кристаллическом или аморфном состоянии. Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пересыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. 6Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершенных атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.). В процессе кристаллизации неизбежно возникают различные дефекты.
2.2. Методы выращивания кристаллов
Основными методами получения совершенных кристаллов большого диаметра являются методы выращивания из расплава, из растворов и из паровой (газовой) фазы.
Выращивание монокристаллов из расплава
Наиболее распространенные способы выращивания монокристаллов. В настоящее время более половины технически важных кристаллов выращивают из расплава. Этими методами выращивают элементарные полупроводники и металлы, оксиды, галогениды и другие вещества. В ряде случаев из расплава выращиваются монокристаллы, в состав которых входит пять и более компонентов. Веществами, наиболее подходящими для выращивания из расплава, являются те, которые плавятся без разложения, не имеют полиморфных переходов и характеризуются низкой химической активностью.
Кристаллизация из паровой (газовой) фазы
Широко используется для выращивания как массивных кристаллов, так и эпитакси-альных пленок, тонких (поликристаллических или аморфных) покрытий, нитевидных и пластинчатых кристаллов. В методах выращивания, основанных на физической конденса-ции кристаллизуемого вещества, вещество поступает к растущему кристаллу в виде соб-ственного пара, состоящего из молекул их ассоциаций — димеров, тримеров и т.д.
Кристаллизация из растворов
Под кристаллизацией из растворов подразумевается рост кристалла соединения, химический состав которого заметно отличается от химического состава исходной жидкой фазы.
Кристаллизацию из растворов применяют при выращивании веществ, разлагающихся при температурах ниже температуры плавления или имеющих несколько полиморфных модификаций. Рост кристаллов осуществляется при температурах ниже температуры плавления, поэтому в выращенных такими методами кристаллах отсутствуют дефекты ,характерные для кристаллов, выращенных из расплава.
При выращивании кристаллов из низкотемпературных водных растворов проводят кристаллизацию путем изменения температуры раствора, пресыщение создается за счет
снижения температуры в зоне растущего кристалла.
Кристаллизация при химической реакции основана на выделении твердых продуктов в процессе взаимодействия растворенных компонентов. Такой способ кристаллизации воз-можен лишь в том случае, если растворимость получаемого кристалла будет ниже раство-римости исходных компонентов. Обычно химические реакции в растворе протекают сдостаточно большой скоростью, создаются высокие пересыщения и происходит массовоевыделение мелких кристаллов. Ограничение скорости достигается либо использованием слабо растворенных исходных продуктов, либо регулированием скорости поступления веществ в зону реакции.
2.3.Способы кристаллизации
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода кристаллизации: 1) охлаждение горячих насыщенных растворов и 2) удаление части растворителя путем выпаривания.
Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Этот способ также получил название политермической или изогидрической кристаллизации, поскольку при его осуществлении количество растворителя (например, воды) остается постоянным.
Перевод исходного раствора, в пересыщенное состояние можно осуществить и за счет частичного удаления растворителя при выпаривании раствора. Такой способ получил название изотермической кристаллизации, так как выпаривание насыщенного раствора происходит при постоянной температуре его кипения.7
Выбор того или иного метода кристаллизации зависит, в первую очередь, от характера изменения растворимости вещества при различной температуре. Для солей, растворимость которых резко уменьшается с понижением температуры, целесообразной является изогидрическая кристаллизация. В этом случае даже при сравнительно небольшом охлаждении раствора из него будет выделяться значительное количество соли. Именно изогидрической кристаллизацией получают большинство солей с резко выраженной прямой растворимостью (NaNO3, К2Сr2О7, NH4C1, CuS04-5H20 и др.). В тех случаях, когда растворимость соли почти не меняется при изменении температуры, кристаллизация охлаждением становится неэффективной и применяется изотермическая кристаллизация. Кривая растворимости, например NaCl, показывает, что при охлаждении насыщенного раствора из него выпадает лишь очень небольшое количество соли, поэтому кристаллизация NaCI проводится всегда выпариванием. (Приложение №1)
Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2S04, растворимость которого, начиная с 32,4° С, уменьшается с повышением температуры. Для кристаллизации солей с резко выраженной обратной растворимостью иногда используют просто нагревание раствора до высоких температур. Так, например, получают безводный кристаллический сульфит натрия Nа2S0з и сульфат марганца MnS04.
При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и кристаллизацию. Подобный метод кристаллизации получил название высаливания. 7
Вещества, добавляемые в раствор, обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами процессов высаливания являются: кристаллизация железного купороса из травильных растворов при добавлении в них концентрированной серной кислоты, высаливание NaCI из рассолов за счет введения в них хлористого магния или хлористого кальция; получение безводного сульфата натрия добавлением к его растворам NaCI; высаливание поваренной солью хлористого бария из гидросульфидных щелоков и др.
Высаливающее вещество лучше вводить в раствор в виде насыщенного раствора, так как при добавлении твердого высаливателя на нем может осаждаться кристаллизующаяся соль, что вызовет замедление или даже прекращение растворения осадителя. В некоторых случаях для выделения соли к раствору добавляют вещества, понижающие растворимость кристаллизуемой соли. Так, для высаливания сульфата натрия из водного раствора можно использовать аммиак, метиловый или этиловый спирты и др. Аналогично кристаллизуют железный купорос из травильных растворов при добавлении ацетона.
Кристаллизация в результате химической реакции, в том числе в результате химического осаждения. Пересыщение можно создать за счет проведения химических реакций. Образующееся в результате вещество выделяется в виде кристаллической фазы из раствора. 7
Удивительный мир кристаллов
Жадамбаева Аюра Жыгдэновна
Российская Федерация, Забайкальский край, Агинский Бурятский округ, село Зугалай
МОУ «Зугалайская средняя общеобразовательная школа»
3.Практическая часть
3.1. Выращивание кристаллов из поваренной соли
Этап1.Растворим соль, из которой будет расти кристалл, в подогретой воде (подогреть нужно для того, чтобы соль растворилось немного больше, чем может раствориться при комнатной температуре). Растворяем соль до тех пор, пока будем уверены, что соль уже больше не растворяется (раствор насыщен!)
Этап 2: Насыщенный раствор перельём в другую емкость, где можно производить выращивание кристаллов (с учётом того, что он будет увеличиваться). Раствор процедили через фильтровальную бумагу. Процеживать раствор обязательно, потому что соринки могут помешать росту красивых кристаллов.
Поставили раствор охлаждаться. Чем медленнее он будет остывать, тем крупнее получатся кристаллы. На этом этапе следим, чтобы раствор не особо остывал.
Этап 3: Привяжем на нитку кристаллик соли, нитку привяжем, например, к спичке и положите спичку на края стакана (ёмкости), где налит насыщенный раствор. Кристаллик опустим в насыщенный раствор.


Этап 4. Поставим оба стакана в такое место, чтобы не было сквозняков, вибрации и сильного света (выращивание кристаллов требует соблюдение этих условий).
Этап 5: Накроим чем-нибудь сверху ёмкость с кристалликом (например, бумагой) от попадания пыли и мусора. Оставьте раствор на пару дней.
Важно помнить!
1. Кристаллик нельзя (при росте) без особой причины вынимать из раствора
2. Не допускать попадания мусора в насыщенный раствор
3. Периодически (раз в неделю) менять или обновлять насыщенный раствор
4. Не следует раскрашивать раствор, где растёт Ваш кристалл, например красками или чем-нибудь подобным, - это лишь испортить сам раствор, а кристалл всё же не покрасит! Лучший способ получить цветные кристаллы - это подобрать нужную по цвету соль!


Кристаллы поваренной соли за 10 дней
В
 это же время был проведён ещё один опыт. Сравните! Более крупные кристаллы (1) выросли в растворе, который мы охлаждали медленно, а тонкие, очень хрупкие кристаллики (2) появились в банке, которую мы держали всю ночь возле неплотно закрытого окна.
это же время был проведён ещё один опыт. Сравните! Более крупные кристаллы (1) выросли в растворе, который мы охлаждали медленно, а тонкие, очень хрупкие кристаллики (2) появились в банке, которую мы держали всю ночь возле неплотно закрытого окна.



Из книг мы узнали, что вовремя роста можно корректировать рост кристаллов, удаляя некрасивые наросты. Это делали ножом, соскабливая лишнее. Образование граней можно прекратить, если смазать их вазелином. Когда же опять появится необходимость в росте, рост можно вызвать, удалив вазелин ацетоном.
Но и в данном опыте было не всё гладко.
Только на второй раз получился кристалл поваренной соли.
При очередном обновлении воды кристалл поваренной соли начал растворяться и в результате у нас глазах он полностью растворился. Причиной этому стала температура воды - она оказалось тёплой.
Первые кристаллы, которые мы достали из раствора, очень быстро подсохли, через час покрылись белым налетом соли, а через несколько дней разрушились.
После неудачного опыта мы стали осторожнее. Когда кристаллы приняли красивый вид, вынули их из раствора, дали подсохнуть, покрыли бесцветным лаком (можно лаком для волос), и они не разрушались.
Делая опыты с солью, мы пришли к следующим выводам:
кристалл соли растет за счет нарастания на него из водного раствора соли других кристаллов;
грани выросшего кристалла гладкие и блестящие, а углы между ними прямые, если росту кристалла ничто не мешает;
если погрузить кристалл в слабый солевой раствор, или в раствор, который не успел остыть, кристалл, к сожалению, разрушается!
П

 осле проведения опыта стенки стакана были покрыты слоем соли. Данный процесс в стакане является моделью того, что происходит в природе
осле проведения опыта стенки стакана были покрыты слоем соли. Данный процесс в стакане является моделью того, что происходит в природе
3.2 Кристаллизация медного купороса.
Взяли порошок медного купороса примерно 200г (оставим щепотку для затравки), и растворяем его полностью в горячей воде (0,5 л). Процедим раствор через чистую ткань.
Сделаем каркас рыбки из проволоки, нить (желательно толстую и шерстяную) обмакнем в этот раствор и обваляем в сухом оставленном порошке медного купороса; даем ей высохнуть.
Затем эту нить наматываем на каркас рыбки и опускаем в холодный раствор медного купороса, через 4-5 ч она покроется кристалликами, а если оставить ее еще часов на 10-20, получим прекрасные, неповторимой красоты кристаллы на модели рыбки.

3.3. Получение кристаллов солей из насыщенных растворов методом выпаривания (изотермическая кристаллизация)
Этим методом выпаривания мною были получены и исследованы с помощью цифрового микроскопа кристаллы поваренной соли NaCl, медного купороса CuSO4·5H2O, дихромата калия К2Сr2O7, хлорида меди (II) CuCl2·2H2O, перманганата калия KМnO4.
Для приготовления препарата кристаллов я использовала следующую методику:
1) Готовим в химическом стаканчике при нагревании насыщенный раствор исследуемой соли.
2) Тщательно очищаем предметное стекло от пыли и отпечатков пальцев.
3) Наносим на предметное стекло пипеткой раствор соли и немного нагреваем в пламени спиртовки до появления первых кристаллов.
Рассматривая препараты, я наблюдала процесс роста кристаллов, изучали форму
кристаллов солей под разным увеличением с помощью микроскопа и осуществляла фотосъёмку. Вот результаты эксперимента:
1)Поваренная соль NaCl
Бесцветные кристаллы поваренной соли имеют форму куба (рис.1). Многие кристаллы имеют внутри полости, заполненные раствором, из которого соль выкристаллизовалась (рис.2). Чем крупнее кристаллы, тем больше в них жидкости (рис.3). Поэтому даже совершенно сухая с виду поваренная соль, особенно крупная, трещит и «разбрызгивается», если её бросить нагорячую сковороду: вскипающая вода «взрывает» кристаллы. Одновременно с кубическими кристаллами мы обнаружили кристаллы,имеющие форму пирамид.(Рис.4)
Р
 ис.1 Рис2.
ис.1 Рис2.


Рис.3 Рис.4
2)Медный купорос CuSO4·5H2O
Медный купорос образует прекрасно оформленные кристаллы в форме косых па-раллелепипедов красивого ярко-синего цвета (рис 5). Мы наблюдали также сростки кристалловмедного купороса – друзы (рис 6).


Рис. 5 Рис.6
3)Дихромата калия К2Сr2O7
Кристаллы дихромата калия имеют форму ромба или вытянутых призм с ярко оранжевой окраской.(рис 7,8)


Рис.7 Рис.8
4)Хлорид меди (II) CuCl2·2H2O
Кристаллы хлорида меди (II) имеют красивую игольчатую форму, напоминающую
траву или хвою (рис 9). Кристаллы растут пучками: из одной точки растет сразу множество кристаллов (рис10).


Рис. 9 Рис. 10
5)Перманганат калия KМnO4
К ристаллы обычной марганцовки тоже имеют игольчатую форму (рис.11). Но в отличие откристаллов хлорида меди (II) они одиночные (рис.12
ристаллы обычной марганцовки тоже имеют игольчатую форму (рис.11). Но в отличие откристаллов хлорида меди (II) они одиночные (рис.12
Рис.11 Рис.12
ЗАКЛЮЧЕНИЕ
Кристаллическое состояние веществ является одним из самых распространенных в окружающем нас мире. Кристаллы – твердые тела, атомы, ионы или молекулы которых образуют упорядоченную периодическую структуру (кристаллическую решетку). Мир кристаллов удивительно разнообразен и красив. Все проделанные нами опыты просты в исполнении, результативны и не требуют больших затрат времени. Использование цифрового микроскопа при изучении кристаллов позволило мне не только наблюдать объекты исследования, но и изучать их в динамике, а также сохранять фотоизображения в цифровом формате.
Эта тема нам была очень интересна. Мир кристаллов оказался удивителен и разнообразен. В результате у меня возникли и другие вопросы, которые требуют дальнейшего более глубокого изучения. Поэтому я планирую и дальше заниматься изучением данной темы.
Список литературы и Интернет-ресурсов:
1. Леенсон И.А. Занимательная химия. 1 часть. М.: Дрофа, 1996
2. О. Ольгин, “Опыты без взрывов”, М.; “Химия”, 1995 г.;
3. Журнал «Вокруг света» статья «Феномен: Кристаллические премудрости», №3 2004 год
4. Журнал «Наука и жизнь» статья «Из чего все состоит» М. Каганова, №10, 2003 г.
5. Попов Г. М., Шафрановский И. И., Кристаллография, 5 изд., М., 1972.г.
6. Большая Советская энциклопедия, издательство «Советская энциклопедия» , 1990 г.
7. Матусевич Л.Н. Кристаллизация из растворов в химической промышленности. М. Химия.1968.
8. Шаскольская М. П.; «Кристаллы», М.: Наука, 1985 г.;
9. Шаскольская М. П.; «Очерки о свойствах кристаллов», М.: Наука, 1978 г.;
10. Журнал Химиков-Энтузиастов «Химия и Химики» № 7 2010
http://chemistry-chemists.com/Video1/Crystals-b.html
11. Журнале «Химия и жизнь» №3 1972 статья «Вырастим кристаллы меди»
http://himiklab.org.ua/cryst_cu.shtml
12. http://ru.wikipedia.org/wiki/кристаллы : Википедия
13. http://course-crystal.narod.ru/p31aa1.html : Мир кристаллов (дистанционный курс по физике).

 Получите свидетельство
Получите свидетельство Вход
Вход



 Некоторые кристаллы имеют довольно простую форму, но их комбинации могут создавать очень сложные многогранники. 4 Атомы могут выстраиваться в достаточно причудливые структуры, напоминающие тетраэдры, параллелепипеды, икосаэдры и прочие геометрические фигуры. В науке о кристаллах — кристаллографии — в зависимости от симметрии расположения атомов выделяют 6 кристаллических групп, которые распадаются на 32 класса.
Некоторые кристаллы имеют довольно простую форму, но их комбинации могут создавать очень сложные многогранники. 4 Атомы могут выстраиваться в достаточно причудливые структуры, напоминающие тетраэдры, параллелепипеды, икосаэдры и прочие геометрические фигуры. В науке о кристаллах — кристаллографии — в зависимости от симметрии расположения атомов выделяют 6 кристаллических групп, которые распадаются на 32 класса. 




 это же время был проведён ещё один опыт. Сравните! Более крупные кристаллы (1) выросли в растворе, который мы охлаждали медленно, а тонкие, очень хрупкие кристаллики (2) появились в банке, которую мы держали всю ночь возле неплотно закрытого окна.
это же время был проведён ещё один опыт. Сравните! Более крупные кристаллы (1) выросли в растворе, который мы охлаждали медленно, а тонкие, очень хрупкие кристаллики (2) появились в банке, которую мы держали всю ночь возле неплотно закрытого окна.




 осле проведения опыта стенки стакана были покрыты слоем соли. Данный процесс в стакане является моделью того, что происходит в природе
осле проведения опыта стенки стакана были покрыты слоем соли. Данный процесс в стакане является моделью того, что происходит в природе

 ис.1 Рис2.
ис.1 Рис2.







 ристаллы обычной марганцовки тоже имеют игольчатую форму (рис.11). Но в отличие откристаллов хлорида меди (II) они одиночные (рис.12
ристаллы обычной марганцовки тоже имеют игольчатую форму (рис.11). Но в отличие откристаллов хлорида меди (II) они одиночные (рис.12








 Проект по химии "Удивительный мир кристаллов" (1.36 MB)
Проект по химии "Удивительный мир кристаллов" (1.36 MB)
 0
0 2548
2548 100
100 Нравится
0
Нравится
0



