
Окислительно-восстановительные реакции

Цели урока:
- Закрепить умения и навыки по расставлению степеней окисления химических элементов в веществах;
- закрепить умения и навыки по составлению ОВР в части С1, С2, С3 КИМов;
- закрепить умения и навыки составления электронного баланса для органических и неорганических веществ

Понятие окислительно-восстановительных реакций
Химические реакции, протекающие
с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными

Окисление - процесс отдачи электронов атомом, молекулой или ионом.
- Атом превращается в положительно заряженный ион: Zn 0 – 2e → Zn 2+
- Отрицательно заряженный ион становится нейтральным атомом: 2Cl - -2e →Cl 2 0
S 2- -2e →S 0
- Величина положительно заряженного иона (атома) увеличивается соответственно числу отданных электронов: Fe 2+ -1e →Fe 3+
Mn +2 -2e →Mn +4

Восстановление - процесс присоединения электронов атомом, молекулой или ионом.
- Атом превращается в отрицательно заряженный ион
S 0 + 2e → S 2−
Br 2 0 + 2 e → 2 Br −
- Величина положительно заряженного иона (атома)
уменьшается соответственно числу присоединенных электронов: Mn +7 + 5e → Mn +2
S +6 + 2e → S +4
− или он может перейти в нейтральный атом:
2 Н + + е → Н 2 0
Cu 2+ + 2e → Cu 0

Восстановители - атомы, молекулы или
ионы, отдающие электроны. Они в процессе
ОВР окисляются
Типичные восстановители:
● атомы металлов с большими атомными радиусами ( I -А, II- А группы), а также Fe, Al, Zn
● простые вещества-неметаллы: водород, углерод, бор;
● отрицательно заряженные ионы: Cl − , Br − , I − , S 2− , N −3 . Не являются восстановителем фторид- ионы F − .
● ионы металлов в низшей с.о.: Fe 2+ ,Cu + ,Mn 2+ , Cr 3+ ;
● сложные ионы и молекулы, содержащие атомы с промежуточной с.о.: SO 3 2 − , NO 2 − ; СО, MnO 2 и др.

Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются
Типичные окислители:
● атомы неметаллов VII -А, VI- А , V-A группы в составе простых веществ
● ионы металлов и неметаллов в высшей с.о.:
Cu 2+ , Fe 3+ ,Ag + …
● сложные ионы и молекулы, содержащие атомы с высшей с.о.: SO 4 2 − , NO 3 − , MnO 4 − , С l О 3 − , Cr 2 O 7 2- , SO 3 , MnO 2 и др.

Определение степеней окисления атомов химических элементов
- С.о. атомов х\э в составе простого в-ва = 0
- Алгебраическая сумма с.о. всех элементов в составе иона равна заряду иона
- Алгебраическая сумма с.о. всех элементов в составе сложного вещества равна 0.
KMnO 4
K +1 MnO 4 -2
+
K +1 Mn + 7 O 4 -2
-
1
+
8
1
-
8
7

Классификация окислительно-восстановительных реакций
- Реакции межмолекулярного окисления
2Al 0 + 3Cl 2 0 → 2Al +3 Cl 3 -1
- Реакции внутримолекулярного окисления
2 KCl +5 O 3 -2 →2KCl -1 + O 2 0
- Реакции диспропорционирования, дисмутации
(самоокисления-самовосстановления):
6 Cl 2 0 + 12KOH (гор.) →2K Cl +5 O 3 +10K Cl -1 +6H 2 O
2 N +4 O 2 + H 2 O →H N +3 O 2 + H N +5 O 3

Это полезно знать
- Степени окисления элементов в составе аниона соли такие же, как и в кислоте, например: (NH 4 ) 2 Cr 2 + 6 O 7 и H 2 Cr 2 + 6 O 7
- Степень окисления кислорода в пероксидах
равна -1
- Степень окисления серы в некоторых соединениях -1, например: FeS 2
- Фтор- единственный неметалл, не имеющий в соединениях положительной степени окисления
- В соединениях NH 3 , CH 4 и др. знак электроположительного элемента водорода на втором месте

Окислительные свойства концентрированной серной кислоты
Продукты восстановления серы(+6):
- H 2 SO 4 + оч.акт. металл ( Mg, Li, Na…) → H 2 S
- H 2 SO 4 + акт. металл ( Mn, Fe, Zn…) → S
- H 2 SO 4 + неакт. металл ( Cu, Ag, Sb…) → SO 2
- H 2 SO 4 + HBr → SO 2
- H 2 SO 4 + неметаллы ( C, P, S…) → SO 2
Примечание: часто возможно образование смеси этих продуктов в различных пропорциях

Азотная кислота в окислительно-восстановительных реакциях
Продукты восстановления азота:
- Концентрированная HNO 3 : N +5 +1e → N +4 (NO 2 )
( Ni, Cu, Ag, Hg ; C, S, P, As, Se ) ; пассивирует с Fe, Al, Cr
- Разбавленная HNO 3 : N +5 +3e → N +2 (NO)
( Металлы в Al …Cu ; неметаллы S, P, As, Se )
- Разбавленная HNO 3 : N +5 +4e → N + 1 (N 2 O) Ca, Mg, Zn
- Разбавленная HNO 3 : N +5 + 5 e → N 0 (N 2 )
- Очень разбавленная: N +5 + 8e → N -3 (NH 4 NO 3 )
( активные металлы до Al)
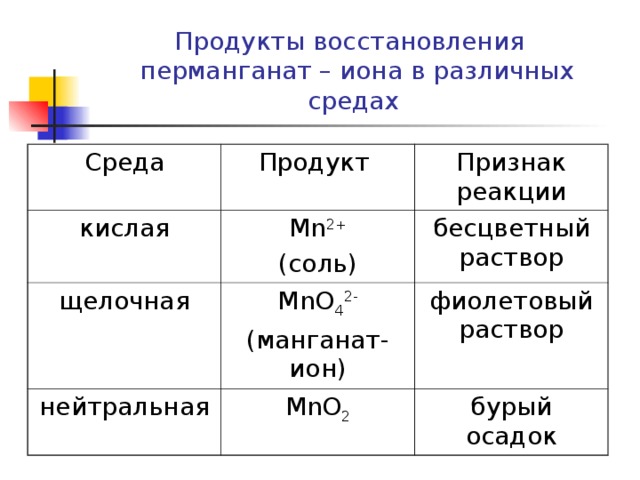
Продукты восстановления перманганат – иона в различных средах
Среда
Продукт
кислая
Признак реакции
Mn 2+
( соль)
щелочная
MnO 4 2-
( манганат-ион)
бесцветный раствор
нейтральная
фиолетовый раствор
MnO 2
бурый осадок
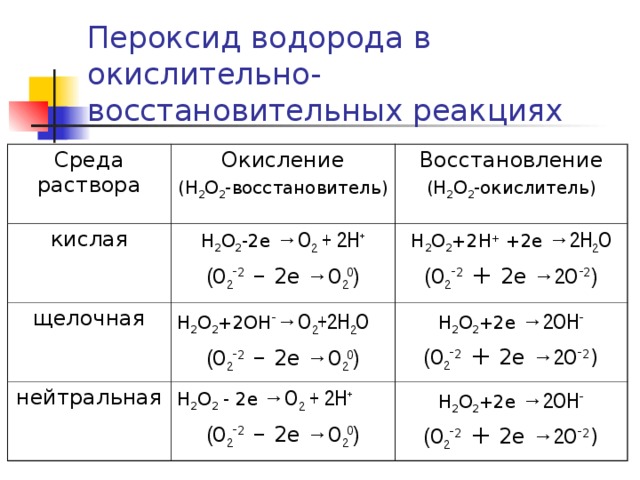
Пероксид водорода в окислительно-восстановительных реакциях
Среда раствора
Окисление
(Н 2 О 2 -восстановитель)
кислая
Восстановление
(Н 2 О 2 -окислитель)
Н 2 О 2 -2е → О 2 + 2Н +
(О 2 - 2 – 2е → О 2 0 )
щелочная
Н 2 О 2 +2ОН - → О 2 +2Н 2 О
(О 2 - 2 – 2е → О 2 0 )
Н 2 О 2 +2Н + +2е → 2Н 2 О
(О 2 - 2 + 2е → 2О - 2 )
нейтральная
Н 2 О 2 +2е → 2ОН -
(О 2 - 2 + 2е → 2О - 2 )
Н 2 О 2 - 2е → О 2 + 2Н +
(О 2 - 2 – 2е → О 2 0 )
Н 2 О 2 +2е → 2ОН -
(О 2 - 2 + 2е → 2О - 2 )

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация Окислительно-восстановительные реакции (237.5 KB)
Презентация Окислительно-восстановительные реакции (237.5 KB)
 0
0 481
481 58
58 Нравится
0
Нравится
0


