
Водород

Теория, мой друг, суха, но зеленеет жизни древо…
И.Гете

Отгадайте о чём идёт речь
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!

А сейчас - физминутка !

Тема: Водород План урока
- Строение атома и особенности положения в ПС.
- Физические свойства.
- Распространенность в природе.
- Получение водорода.
- Химические свойства водорода.

Водород – химический элемент.
Характеристика водорода по периодической системе.
- 1. Порядковый номер.
- 2. Номер периода.
- 3. Номер группы и ее тип.
- 4. Относительная атомная масса.
- 5. Заряд ядра атома
- 6. Число электронов, протонов и нейтронов

Водород – простое вещество
- 1. Металл – неметалл
- 2. Формула простого вещества
- 3. Агрегатное состояние при обычных условиях

Водород – простое вещество.
Н 2

Физические свойства водорода
- Лёгкий горючий газ без цвета, запаха и вкуса.
- Температура плавления -259,15
- Температура кипения -252,7
- Плохо растворим в воде.

Водород в природе.
Первый я на белом свете:
Во вселенной, на планете
Превращаюсь в лёгкий гелий,
Зажигаю Солнце в небе.
Гость из космоса пришёл
В воде приют себе нашёл!

Нахождение в природе
В земной коре
Во вселенной

Получение водорода из воды с помощью солнечной энергии

Получение водорода
В промышленности :
2СН 4 + О 2 = 2СО + 4Н 2 ↑
2H 2 O = 2H 2 ↑ + O 2 ↑
В лаборатории :
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑

Образование гремучей смеси
Обычно лёгок и летуч,
Он вдруг становится могуч:
Его нагрев неосторожно
Взорвать в округе всё возможно.

Химические свойства водорода
- Водород – окислитель:
2Li 0 + H 2 0 = 2Li +1 H -1 (с активными металлами при повышенных температуре и давлении);

- Водород – восстановитель:
- - с наиболее активными неметаллами:
- Н 2 + Сl 2 = 2HCl
- - с кислородом: 2H 2 + O 2 = 2H 2 O
- - с азотом: 3H 2 + N 2 = 2NH 3
- - с оксидами металлов: CuO + H 2 = Cu + H 2 O
- - галогенводороды при растворении в воде диссоциируют с образованием гидратированных ионов водорода, т.е. проявляют кислотный характер:
- HCl = H + + Cl -

Выберите утверждения, верные для водорода:
- Газ без цвета, вкуса, запаха, малорастворим в воде.
- В реакциях, как правило, окислитель.
- Используется как восстановитель в металлургии.
- Получают электролизом воды.
- Самый распространенный элемент космоса.
- Входит в состав воздуха.
- Реагирует с неметаллами.
- Входит в состав оксидов.
- Галогенводороды при растворении в воде диссоциируют с образованием гидратированных ионов водорода, т.е. проявляют кислотный характер
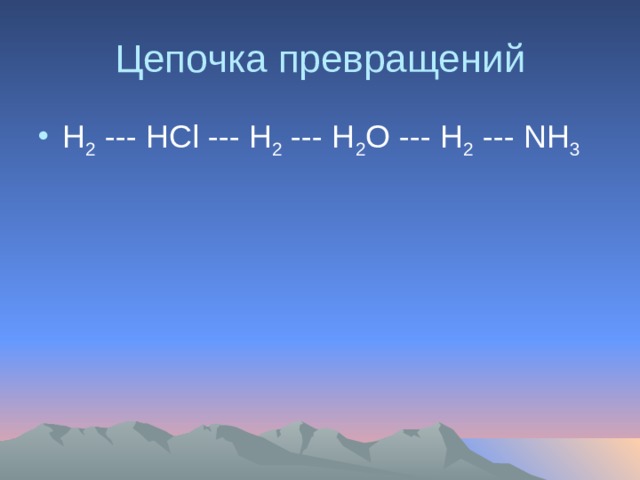
Цепочка превращений
- Н 2 --- НСl --- H 2 --- H 2 O --- H 2 --- NH 3

Задача
- Над нагретой серой пропустили водород, полученный газ пропустили через раствор сульфата меди (П), в результате чего выпал осадок массой 12 г. Рассчитайте объем (н.у.) водорода, вступившего в реакцию

Лабораторный опыт № 4
Испытание индикатором растворов водородных соединений неметаллов

- Внимательно слушайте и выполняйте указания учителя.
- Рабочее место надо содержать в чистоте, не загромождая его предметами, не относящимися к данной работе. Лишние книги и тетради не должны находиться на рабочем месте.
- По окончании работы необходимо привести в порядок рабочее место.
- Категорически запрещается проводить опыты, не относящиеся к данной работе, трогать вещества руками и пробовать их на вкус.

Спасибо за урок!
Запишите домашнее задание:
параграф 36, № 3,6
Подготовить сообщения по теме:
«Применение водорода»

Если вы согласны с утверждениями, поставьте плюс.
- 1. Я узнал много нового и интересного.
- 2. На все возникшие в ходе урока вопросы я получил ответы.
- 3. Мне это пригодится в будущей профессиональной деятельности и в повседневной жизни.
- 4. Считаю, что работал добросовестно и достиг цели урока.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация на тему "Водород" (660.03 KB)
Презентация на тему "Водород" (660.03 KB)
 0
0 1210
1210 124
124 Нравится
0
Нравится
0




