
Цель: сформировать представление об аллотропии серы, её физических и химических свойствах.

1.Истрия открытия и изучения серы.
2. Положение серы в ПСХЭ.
3. Распространение серы в природе.
4. Получение серы в лаборатории.
5. Аллотропия и физические свойства серы.
6.Химические свойства серы.
7.Применение серы человеком и её соединений.

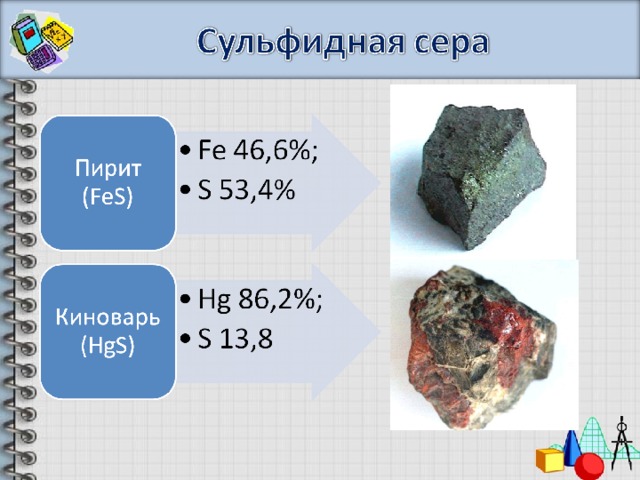
- Дата открытия – известна древним цивилизациям;
- Греческое название серы тейони (божественный, небесный) указывает на её легкую воспламеняемость, поскольку огонь считался принадлежностью богов.
С какой целью серу
применяли в древности?



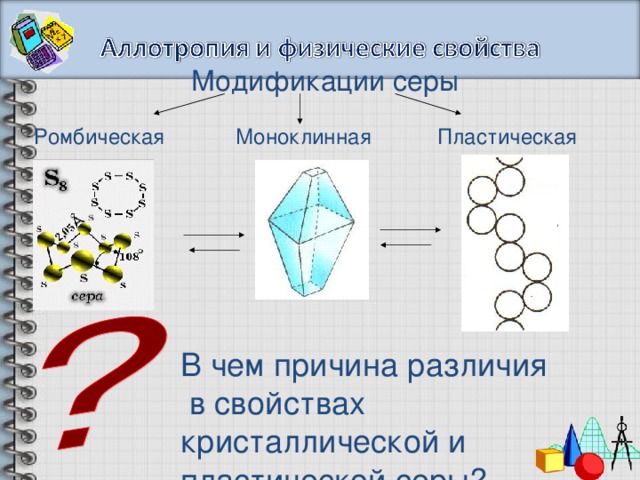
Модификации серы
Пластическая
Моноклинная
Ромбическая
В чем причина различия
в свойствах кристаллической и пластической серы?

- Промышленный метод - выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода).
2H 2 S + O 2 2S + 2H 2 O
3. Реакция Вакенродера
2H 2 S + SO 2 3S + 2H 2 O
 Hg +2 1 восстановитель окисления S 0 + 2e –– S –2 1 окислитель восстановления Взаимодействие с натрием 2Na 0 + S 0 = Na 2 +1 S –2 Na 0 – e –– Na + 2 восстановитель окисления S 0 + 2e –– S +2 1 окислитель Восстановления " width="640"
Hg +2 1 восстановитель окисления S 0 + 2e –– S –2 1 окислитель восстановления Взаимодействие с натрием 2Na 0 + S 0 = Na 2 +1 S –2 Na 0 – e –– Na + 2 восстановитель окисления S 0 + 2e –– S +2 1 окислитель Восстановления " width="640"
1) Взаимодействие с металлами:
Hg 0 + S 0 = Hg +2 S –2 Hg 0 – 2e –– Hg +2 1 восстановитель окисления S 0 + 2e –– S –2 1 окислитель восстановления
2Na 0 + S 0 = Na 2 +1 S –2 Na 0 – e –– Na + 2 восстановитель окисления S 0 + 2e –– S +2 1 окислитель Восстановления
 H + 2S –2 S 0 + 2e –– S –2 1 окислитель Восстановления H 0 2 – 2e –– 2H + 1 восстановитель Окисления " width="640"
H + 2S –2 S 0 + 2e –– S –2 1 окислитель Восстановления H 0 2 – 2e –– 2H + 1 восстановитель Окисления " width="640"
2) Взаимодействие с водородом.
S 0 + H 0 2 –– H + 2S –2 S 0 + 2e –– S –2 1 окислитель Восстановления H 0 2 – 2e –– 2H + 1 восстановитель Окисления
 S –2 2 окислитель Восстановления C 0 – 4е –– C +4 1 восстановитель Окисления " width="640"
S –2 2 окислитель Восстановления C 0 – 4е –– C +4 1 восстановитель Окисления " width="640"
3) Взаимодействие с углеродом.
S 0 + C 0 = C +4 S 2 –2 2 S 0 + 2e –– S –2 2 окислитель Восстановления C 0 – 4е –– C +4 1 восстановитель Окисления
 S +4 восстановитель Окисления О 0 2 + 4е –– 2O –2 окислитель Восстановления " width="640"
S +4 восстановитель Окисления О 0 2 + 4е –– 2O –2 окислитель Восстановления " width="640"
4) Взаимодействие с кислородом.
S 0 + О 0 2 = S +4 О –2 2 S 0 – 4e –– S +4 восстановитель Окисления О 0 2 + 4е –– 2O –2 окислитель Восстановления

1.Распределение электронов по энергетическим уровням в атоме серы:
А. 2, 6. В. 2, 8, 6.
Б. 2, 8. Г. 2, 8, 8.
2.Ряд формул веществ, в котором степень окисления серы уменьшается:
А . SO 3 -FeS-SO 2 . В . SO 2 -S-H 2 S.
Б . MgS-S-SO 2 . Г. S - H 2 S - Al 2 S 3 .

3.Свойство, характерное для серы:
А.Хорошо растворима в воде.
Б.Имеет металлический блеск.
В.Твердое вещество желтого цвета.
Г.Проводит электрический ток.
4. Уравнение реакции, в котором элемент сера является восстановителем:
А . Fe+H 2 SO 4 =FeSO 4 +H 2 .
Б . S+O 2 =SO 2 .
В. 2Li+S=Li 2 S.
Г. SO 3 +H 2 O=H 2 SO 4


Рефлексия.
Параграф 12.
Задание на опережение: прочитать про следующие соединения
1 ученик - сероводород
2 ученик – оксиды серы
3 ученик – сернистая кислота

 Получите свидетельство
Получите свидетельство Вход
Вход












 Hg +2 1 восстановитель окисления S 0 + 2e –– S –2 1 окислитель восстановления Взаимодействие с натрием 2Na 0 + S 0 = Na 2 +1 S –2 Na 0 – e –– Na + 2 восстановитель окисления S 0 + 2e –– S +2 1 окислитель Восстановления " width="640"
Hg +2 1 восстановитель окисления S 0 + 2e –– S –2 1 окислитель восстановления Взаимодействие с натрием 2Na 0 + S 0 = Na 2 +1 S –2 Na 0 – e –– Na + 2 восстановитель окисления S 0 + 2e –– S +2 1 окислитель Восстановления " width="640"
 H + 2S –2 S 0 + 2e –– S –2 1 окислитель Восстановления H 0 2 – 2e –– 2H + 1 восстановитель Окисления " width="640"
H + 2S –2 S 0 + 2e –– S –2 1 окислитель Восстановления H 0 2 – 2e –– 2H + 1 восстановитель Окисления " width="640"
 S –2 2 окислитель Восстановления C 0 – 4е –– C +4 1 восстановитель Окисления " width="640"
S –2 2 окислитель Восстановления C 0 – 4е –– C +4 1 восстановитель Окисления " width="640"
 S +4 восстановитель Окисления О 0 2 + 4е –– 2O –2 окислитель Восстановления " width="640"
S +4 восстановитель Окисления О 0 2 + 4е –– 2O –2 окислитель Восстановления " width="640"













 Презентация "Сера: положение в ПСХЭ, физические и химические свойства, получение и применение" (2.78 MB)
Презентация "Сера: положение в ПСХЭ, физические и химические свойства, получение и применение" (2.78 MB)
 0
0 749
749 69
69 Нравится
0
Нравится
0


