Цели урока:
Дидактические:
Опираясь на знания учащихся, повторить понятия “бинарные соединения”, «оксиды», «несолеобразующие оксиды», «солеобразующие оксиды», «кислотные оксиды».
Способствовать формированию у учащихся понимания связи между степенью окисления неметалла в оксиде с его химическими свойствами
Рассмотреть состав и строение оксидов неметаллических элементов, их номенклатуру и свойства
Развивающие:
Развивать умение устанавливать логические последовательности в генетической связи между классами неорганических соединений.
Развивать умение анализировать состав и свойства веществ.
Стимулировать исследовательскую и поисковую деятельность учащихся.
Развивать творческий потенциал учеников
Воспитательные:
Воспитывать чувство товарищества, умение работать коллективно.
Способствовать экологическому воспитанию учащихся, ориентировать учащихся на здоровый образ жизни.
Задачи урока:
Изучить строение, свойства и значение некоторых оксидов неметаллов. Обозначить проблему загрязнения окружающей среды.
Ход урока.
1. Организационный этап – размещение учащихся в кабинете для работы в группах, знакомство с рабочими листами, их заполнение.
Дидактические задачи этапа – организовать учащихся к продуктивной деятельности на уроке
2. Актуализация опорных знаний учащихся.
Дидактические задачи этапа – повторить основные понятия, необходимые для усвоения новой темы, закрепить изученный материал, стимулировать учащихся к активной деятельности на уроке.
Место урока в теме – заполнение изученных разделов урока на Smart-доске
Блиц – тест – групповая работа, с последующей проверкой у доски (перемещение объектов) и самооценкой выполненного теста
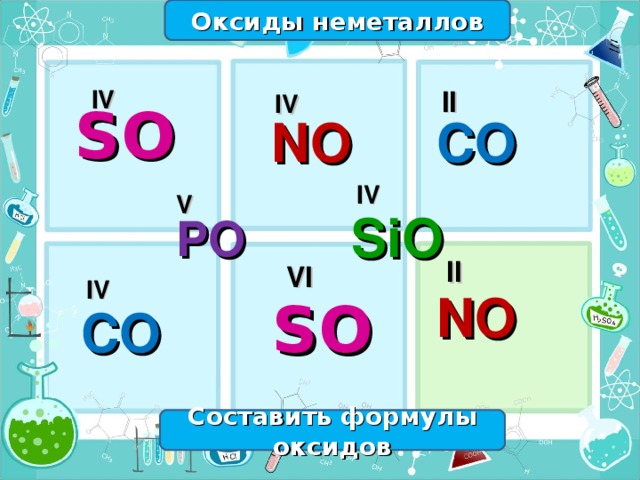
Мозговой штурм – групповая работа - Составить формулы оксидов по данной валентности. Какую информацию мы можем извлечь из предложенных формул? - с последующей проверкой у доски (запись ответа на доске)
Блиц – тест – групповая работа
Мозговой штурм – групповая работа - Составить формулы оксидов по данной валентности. Какую информацию мы можем извлечь из предложенных формул.
3. Изучение нового материала:
Дидактические задачи этапа – стимулировать учащихся к активной деятельности на уроке, продолжить формирование умений работать в группе, совершенствовать умения записывать уравнения химических реакций по предложенным схемам, давать названия полученным веществам, обозначить экологические проблемы современности, воспитывать экологическую культуру учащихся.
Объявление темы урока «Оксиды неметаллов или штрихи к семейному портрету»
Объявление целей урока «Рассмотреть состав и строение оксидов неметаллических элементов, их номенклатуру и свойства»
Изложение материала:
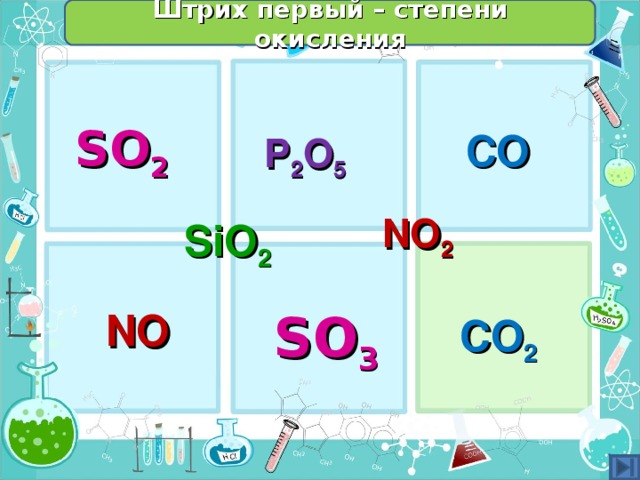
Определить степени окисления неметаллов в оксидах – групповая работа - с последующей проверкой у доски (запись ответа на доске)
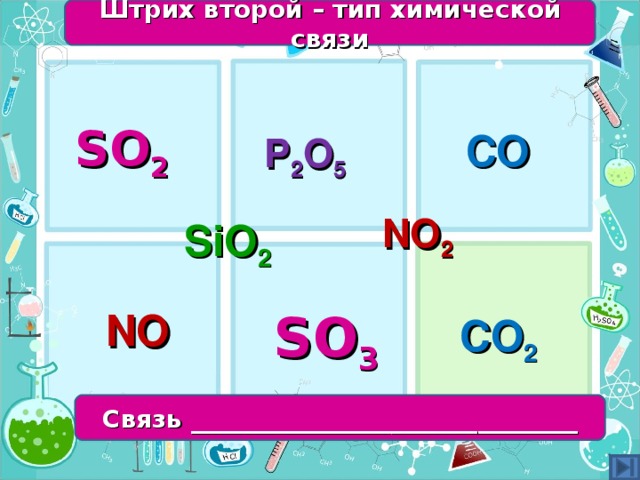
Определить тип химической связи – групповая работа - с последующей проверкой у доски (запись ответа на доске)
Дать название оксидам по современной номенклатуре – групповая работа - с последующей проверкой у доски (запись ответа на доске)
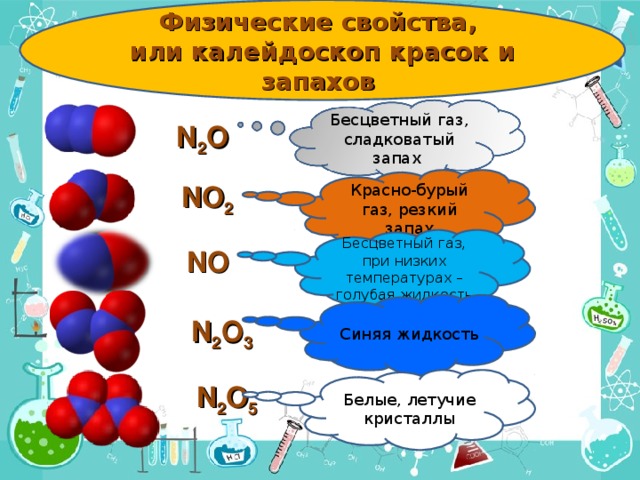
Физические свойства оксидов неметаллов или калейдоскоп красок и запахов – рассказ учителя. Работа учеников у доски – по предложенным моделям молекул составить формулы оксидов Нитрогена (перемещение объектов)
Химические свойства оксидов неметаллов:
Классификация оксидов неметаллов (несолеобразующие оксиды)
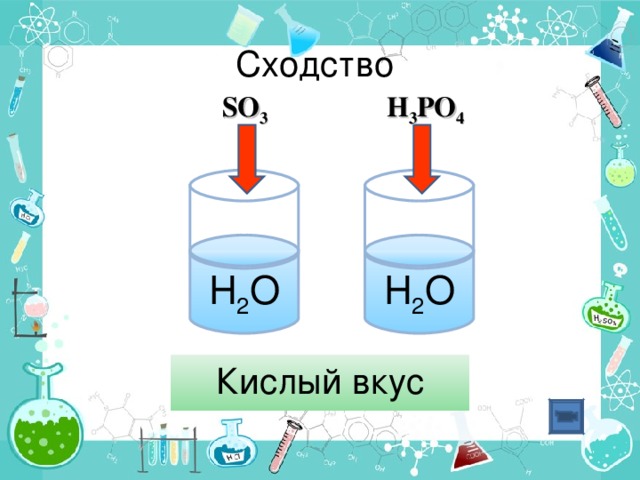
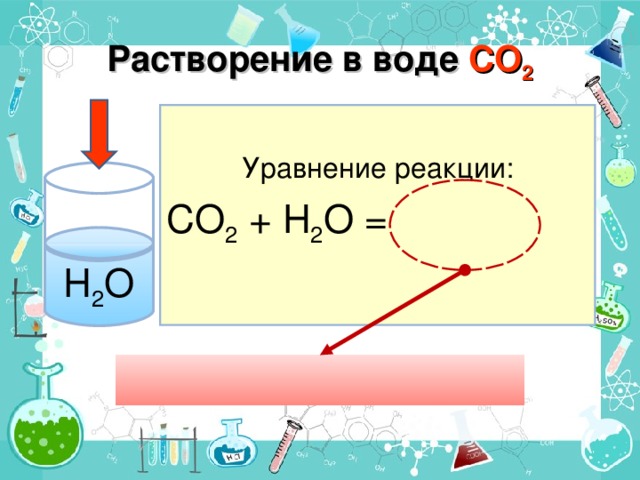
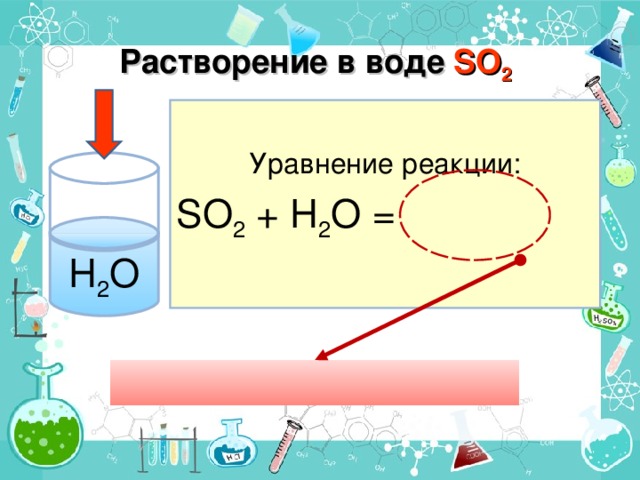
Взаимодействие кислотных оксидов с водой (дописать уравнения предложенных реакций, сделать вывод о природе полученных веществ; просмотр видео – «взаимодействие кислотных оксидов с водой»; запись уравнений реакций; соответствие кислотных оксидов кислотам (исходя из степени окисления неметалла в оксиде и кислоте)
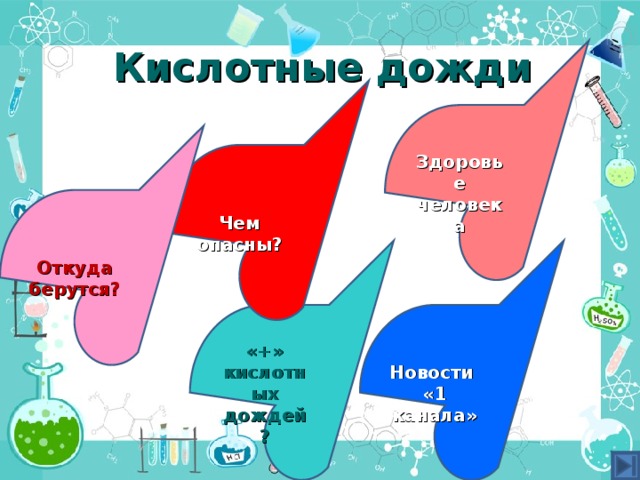
Кислотные дожди (откуда возникают, влияние кислотных дожей, кислотные дожди и здоровье, новости «1 канала», «+» кислотных дождей – видео
Взаимодействие с основными оксидами (дописать уравнения предложенных реакций, сделать вывод о природе полученных веществ)
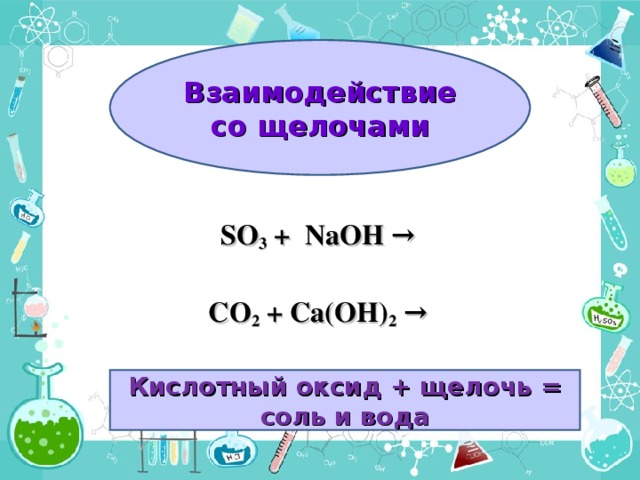
Взаимодействие с щелочами (дописать уравнения предложенных реакций, сделать вывод о природе полученных веществ)
Взаимодействие с кислородом
Взаимодействие с кислотными оксидами
4. Закрепление изученного материала.
Дидактические задачи этапа – совершенствовать умения записывать уравнения химических реакций по предложенным схемам, давать названия полученным веществам, закрепить полученные на уроке знания
1. Подчеркните и назовите оксиды неметаллов:
SO2, Na2SO4, CO2, KOH, P2O5, ZnO, NO, HNO3.
2. Сколько различных оксидов у Нитрогена? Приведите их химические формулы. Какие из них несолеобразующие?
3. Напишите по одной формуле оксидов неметаллов 3-го периода таблицы Д. И. Менделеева и назовите эти оксиды.
4. Как изменяются кислотные свойства высших оксидов неметаллов в 3-м периоде и в V группе периодической системы Д. И. Менделеева?
5. Составьте уравнения реакций по следующим схемам:
SO3 + H2O = ……………. ,
SO2 + NaOH = …………. ,
P2O5 + CaO = ……………
5. Домашнее задание:
Дидактические задачи этапа – предоставить учащимся возможность выбора заданий разного уровня сложности, способствовать развитию творческих способностей учащихся и расширению межпредметных связей (химия, биология, экология, компьютерные технологии)
До 6 баллов – пар. 8 – стр. 69 №1
До 9 баллов – пар. 8 – стр. 69 - №1, 5
До 12 баллов – пар. 8 – стр. 69 - №1, 5,
№6 - творческое задание «Парниковый эффект. Глобальное потепление: что за ним кроется»
5. Рефлексия учебной деятельности.
Дидактические задачи этапа – осуществить рефлексию учебной деятельности учащихся и наблюдение эмоционального состояния детей в начале, во время и в конце урока.

 Получите свидетельство
Получите свидетельство Вход
Вход

































 Презентация по химии "Неметаллы и их соединения" (2.96 MB)
Презентация по химии "Неметаллы и их соединения" (2.96 MB)
 1
1 3474
3474 516
516 Нравится
0
Нравится
0


