Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №4 г. Онеги»
Онежского района Архангельской области
Тематическое планирование по химии
в 8 классе
(1 четверть, профильный уровень)
подготовила
учитель химии и физики
Некрасова Светлана Марьяновна
Онега 2013
Тема 1. Предмет химии.
(8 часов при 3 часах в неделю)
Урок 1. Задачи и предмет химии. Лабораторная посуда. Правила техники безопасности.
(ПЗ№1, первая часть).
Цели: учащиеся должны понять значение науки, ее задачи, предмет; познакомиться с лабораторной посудой; правилами техники безопасности
Задачи для учащихся: учащиеся должны знать предмет химии; знать основную лабораторную посуду; правила техники безопасности.
Оборудование и реактивы: стаканы с раствором гидроксида натрия и соляной кислоты; палочка из дерева с прикрепленной в виде звезды фильтровальной бумагой, смоченной в растворе фенолфталеина и высушенной («волшебная» палочка); стаканы; мензурки; пипетки; стеклянная палочка; фарфоровые чашечки разных размеров; фарфоровая ступка; пестик; воронки; колбы плоскодонные, конические, круглодонные; воронка; лабораторный штатив; спиртовка; склянки с реактивами и т.д.
Ход урока.
Знакомство с классом. Знакомство со структурой учебника.
Вводная беседа о предмете химии.
Вопросы классу. Как вы думаете, ребята, зачем нужна человеку химия? (Возможные ответы учащихся: чтобы жить, для питания, для тканей, машин и т.д.) Может ли современный человек прожить без продуктов химического производства? ( Возможные ответы учащихся: нет).
Закройте глаза и представьте себе, что нас ожидает, если вдруг исчезнет химическое производство. Мы не сможем почистить утром зубы, поскольку не будет ни пасты, ни зубной щетки; не сможем вымыть руки; не будет у нас красивой одежды и т. д. Открывайте скорее глаза, ведь на самом деле химия помогает нам жить, ее производство никуда не исчезло. Кто из вас знает, откуда произошло слово «химия»? По одной из версий, оно схоже с названием древнего Египта («Хем»), где химия достигла высокого расцвета, где было сделано много интересных открытий. Существуют и другие версии происхождения слова «химия», их вы можете найти сами, а на следующем уроке рассказать нам об этом.
III. Предмет химии.
Опыт. Заранее приготовленной «волшебной» палочкой взмахиваем в воздухе, опускаем ее в стакан с раствором гидроксида натрия (окраска меняется на малиновую), затем снова взмахиваем палочкой в воздухе, опускаем ее в стакан с раствором соляной кислоты (окраска исчезает).
Ребята, а как вы думаете, почему менялась окраска нашей «волшебной» палочки?
( Возможные ответы учащихся: получались другие вещества). Верно. Мы с вами провели химические реакции, в которых участвовали вещества. Именно вещества нам и предстоит изучать на уроках химии. Итак, предметом химии являются вещества.
Химия – наука о веществах, их свойствах и превращениях.
На уроках физики (7 кл.) вы говорили о веществах и телах. Что же такое вещество?
( Возможные ответы учащихся: то, из чего сделано тело). Что такое тело? ( Возможные ответы учащихся: то, что вокруг нас).
IV. Лабораторная посуда.
Для проведения химического эксперимента нам будет необходима специальная посуда (химическая посуда). Познакомимся с ней подробнее. Работа по рисунку 14.1 (стр. 233). Учитель демонстрирует посуду, называет ее.
V. Закрепление понятий: «вещество» и «тело».
Из перечня: гвоздь, мел, стекло, журнальный столик, графит, тетрадь выберем вещества и тела.
VI. Правила техники безопасности.
Знакомство с правилами техники безопасности по таблице и тексту учебника.
Домашнее задание. Введение,? 5 – 7, упр. 5, 7(письменно), ПТБ (стр. 231), творческое задание (сочинение или рисунок на тему «Химия и я»).
Урок 2. Химическое оборудование. Правила техники безопасности. Знакомство с лабораторным штативом и спиртовкой (ПЗ№1, вторая часть).
Цели: учащиеся должны знать правила техники безопасности, названия и внешний вид лабораторного оборудования, уметь пользоваться лабораторным штативом, спиртовкой.
Задачи для учащихся: учащиеся должны знать устройство и принцип действия лабораторного штатива и спиртовки, знать химическую посуду.
Оборудование: пробирки, колбы, газоотводные трубки, пробиркодержатель, штатив для пробирок, спиртовка. Лабораторный штатив, ложечка для веществ, воронка, фарфоровые чашечки, колбы, стаканы и другая лабораторная посуда.
Ход урока.
Повторение (фронтальная работа).
Что изучает химия? Что такое вещество? Что такое тело?
Учитель показывает лабораторную посуду, учащиеся называют ее. Затем один учащийся у стола учителя (по просьбе учителя) находит называемую лабораторную посуду. Попробуем пройти небольшой тест на знание правил техники безопасности.
Увидев в химическом кабинете белый порошок, вы:
А) съедите его сами
Б) поделитесь с соседом
В) будете ждать учителя
2. Для нагревания воды в пробирке вы:
А) узнаете у учителя, как правильно это сделать
Б) сами проведете эксперимент
В) при нагревании будете глубоко заглядывать в пробирку
Конечно, прежде чем проводить эксперимент, вы должны узнать у учителя, как его правильно провести.
Лабораторный штатив и спиртовка. Нагревание над спиртовкой и в лапке штатива.
Учитель демонстрирует лабораторный штатив с насадками, показывает принцип действия штатива, закрепляет в лапке штатива пробирку с водой, показывает правила ее обогрева.
Учитель объясняет устройство спиртовки, демонстрирует нагревание пробирки с водой над спиртовкой, правила тушения спиртовки.
ПЗ№1.
Учащиеся знакомятся с текстом работы, внимательно читают ход работы.
После разрешения учителя учащиеся:
закрепляют в лапке штатива пробирку с водой
зажигают спиртовку
нагревают пробирку
тушат спиртовку
Затем:
1) закрепляют пробирку с водой в держателе
2) зажигают спиртовку
3) нагревают воду в пробирке
4) тушат спиртовку.
Оформление практической работы.
В тетрадях для практических работ ребята оформляют работу по плану (план на доске).
Название работы.
Цель работы.
Приборы и материалы.
Ход работы. 1. Устройство лабораторного штатива. (Рис. с пояснениями).
Устройство спиртовки. (Рис. с пояснениями).
Строение пламени. (Рис. с пояснениями).
Вывод.
Итог урока.
Повторение устройства спиртовки, штатива.
Домашнее задание. Закончить оформление ПЗ№1, ПТБ
Урок 3. Химическое вещество. Свойства веществ. Химический элемент.
Цели: учащиеся должны применять знания о физических свойствах вещества, знать положения атомно-молекулярного учения, использовать полученные на уроках физики знания для описания веществ.
Задачи для учащихся: знать определения «вещество» и «тело», перечислять физические свойства вещества, различать тела и вещества.
Оборудование и реактивы: стаканы с водой, стеклянная палочка, сахар, железо (гвоздь), мел (кусок), поваренная соль, спиртовка, пробирка, держатель, спички, штатив.
Ход урока.
Повторение.
На доске задание: выбрать вещества и тела из данного перечня.
Соль поваренная, сода, железо, гвоздь, проволока.
На кафедре приготовлено оборудование.
1 учащийся объясняет устройство лабораторного штатива, закрепляет пробирку в лапке штатива, обогревает пробирку. Поясняет свои действия ПТБ.
2 учащийся объясняет устройство спиртовки, закрепляет пробирку с водой в пробиркодержателе, демонстрирует нагревание. Поясняет свои действия ПТБ.
Свойства веществ.
В сказке «три поросенка» один поросенок построил себе дом из соломы, домик развалился. Второй братец построил себе домик из веток, домик опять развалился. Что же не знали два глупых поросенка? Конечно, свойств используемых материалов. Вспомним, какие свойства есть у вещества?
Свойства: физические и химические.
Теперь вспомним физические свойства веществ (знакомы с уроков физики).
Физические свойства:
агрегатное состояние.
запах.
цвет.
плотность.
теплопроводность, электропроводность.
температуры плавления, кипения, кристаллизации.
твердость.
ЛО№1 «Описание физических свойств веществ».
Класс получает набор (поваренная соль или сахар, стакан с водой, стеклянная палочка). Задание выполняется по следующему плану.
Цвет, запах, агрегатное состояние.
растворимость.
Плотность (вспомнить силу Архимеда).
Химический элемент.
Мы знаем, что такое «вещество». Из чего состоит вещество? (Возможные ответы учащихся: из молекул и атомов). Вещества состоят из атомов химических элементов.
Химический элемент – определенный вид атомов. Химические элементы находятся в периодической системе Д. И. Менделеева. Обратите внимание на то, что элементы изображены разными цветами. Поскольку проявляют разные химические свойства. Попробуем понять, чем отличаются железо и сера? (Возможные ответы учащихся: цветом). Железо относится к металлам, сера относится к неметаллам. Кроме того, есть элементы. Проявляющие свойства и металла и неметалла, их называют амфотерными. В зависимости от свойств элементы выделены в таблице разным цветом. Теперь начнем знакомство с химическим языком. В конце тетради делаем таблицу и пишем 10 первых металлов.
| Название элемента | Произношение. | Химический знак |
Знакомство с понятием «смесь», «материал», «горная порода», «минерал».
Выполнение ЛО№2 «Ознакомление с веществами».
Обсуждение результатов.
Домашнее задание. Записать отличия между веществом, минералом, материалом, смесью, горной породой. 1.2, упр. 1,3,4 стр. 12, 10 х. э.
Урок 4. Способы разделения смесей.
Цель: учащиеся должны знать способы разделения смесей, уметь различать однородные и неоднородные смеси.
Задачи для учащихся: учащиеся должны перечислять способы разделения смесей на компоненты, уметь использовать лабораторную посуду и ПТБ.
Оборудование и реактивы:
1) на учительском столе: смесь железа с серой, стакан с водой, магнит, стакан с водой и глиной, стакан с раствором поваренной соли, порошок железа, смесь опилок с раствором сахарного песка.
Ход урока.
I. Повторение.
Учитель заготовил карточки размером 10*15 со знаками 10 химических элементов (металлы изображены красным цветом). Учитель показывает карточку с элементом, учащиеся называют или произносят элемент (по заданию учителя).
На доске сделана заготовка.
. Li . Na . Mg
. K . Ca . Ti
Учитель называет элементы, учащиеся соединяют их линиями. При правильном соединении получается знак «v» (или любой другой на усмотрение учителя). В конце тетради записываем в таблицу еще 10 химических элементов (металлов).
Чистые вещества и смеси. Способы разделения смесей.
Мы уже знаем, что есть чистые вещества и смеси. Составим таблицу, в которой укажем их признаки.
| Чистые вещества | Смеси |
| Постоянный состав и свойства. Зная свойства вещества, можно определить о каком веществе идет речь. | Переменный состав. Каждый компонент смеси сохраняет свои свойства в смеси. |
Учитель демонстрирует порошок железа.
Задание: определите вещество это или смесь, объясните ход ваших мыслей.
(Ответы учащихся: вещество, потому что у него определенные физические свойства). Вещество темно – серого цвета, имеет металлический блеск, притягивается магнитом, не растворяется в воде.
Учитель демонстрирует смесь железа и серы. Задание: определите вещество это или смесь, объясните ход ваших мыслей.
(Ответы учащихся: смесь, потому что вещества разного цвета).
Учитель демонстрирует раствор поваренной соли в воде.
Задание: определите вещество это или смесь, объясните ход ваших мыслей.
(Ответы учащихся: вода). На самом деле это смесь поваренной соли и воды, однако соли вы не видите. Итак, смеси можно разделить на две группы: однородные и неоднородные.
Однородные смеси – смеси, в которых частицы вещества видны только под микроскопом.
Неоднородные смеси – смеси, в которых частицы вещества видны только под микроскопом.
У меня на столе есть еще одна смесь (глина + вода). Какая она? Почему? Верно, однородная, так как хорошо видна глина в воде. Попробуем определить. Как можно разделить неоднородные смеси? Ваши предложения. (Возможные ответы учащихся: отлить воду, выпаривать).
Для разделения неоднородных смесей на компоненты можно использовать следующие методы:
отстаивание.
выпаривание.
действие магнитом (если в смеси есть железо).
Учитель подробно объясняет правила приготовления фильтра, демонстрирует фильтрование смеси древесных опилок и воды.
Основные способы разделения однородных смесей:
выпаривание.
хроматография.
Учитель демонстрирует выпаривание смеси сахарного песка и воды. Какими способами разделения смесей вы пользуетесь дома? Приведите примеры. (Возможные ответы учащихся: фильтрование, когда варим морс; отстаивание при приготовлении творога). А как найти стальную иголку в стоге сена? (Возможные ответы учащихся: магнитом).
Закрепление.
Предложите ход разделения смеси растительного масла и воды. Назовите используемые способы.
(Возможные ответы учащихся: снять масло ложкой, способ – отстаивание).
Разбор ПЗ№2
Выводы по уроку.
Смеси состоят из компонентов. Для разделения смесей физическими методами используют:
отстаивание.
выпаривание.
хроматографию.
действие магнитом.
фильтрование.
Домашнее задание. 1.3, упр. 10, стр.21, ПЗ№2, 20 х. э.
Урок 5. ПЗ№2 Очистка загрязненной поваренной соли.
Цель: учащиеся должны применять приобретенные знания о веществах и смесях, методах разделения смесей на практике.
Задачи для учащихся: знать ПТБ, уметь определить последовательность выполнения работы.
Оборудование и реактивы: смесь поваренной соли и древесных опилок, стаканы, фильтр, фильтровальная воронка, спички, фарфоровая чашечка, ложечка для веществ, спиртовка, штатив с кольцом, колба.
Ход урока.
Повторение.
Вспомним способы разделения смесей, правила приготовления фильтра. Сегодня нам предстоит самим очистить загрязненную поваренную соль. Повторим последовательность выполнения работы, ПТБ.
Выполнение ПЗ№2.
Оформление проделанной работы в тетрадях для практических работ по плану (план на доске).
Название работы.
Цель работы.
Приборы и материалы.
Реактивы.
Ход работы. 1. Растворение загрязненной поваренной соли в воде. (Рис. с пояснениями).
Фильтрование. (Рис. с пояснениями).
Выпаривание. (Рис. с пояснениями).
Вывод.
Дополнительное задание. Предложите способ разделения смеси железо + древесные опилки.
Итог урока.
Мы провели достаточно серьезную работу – очистили загрязненную поваренную соль. Помните сказку о Золушке? Как бы вы стали разделять зерна пшена и риса? По зернышку? (Возможные ответы учащихся: залили бы водой, пшено осталось бы сверху). Наша задача: уметь применять полученные на уроках химии знания в повседневной жизни.
Домашнее задание. Оформить до конца ПЗ№2, 20 химических элементов, кроссворд по ПТБ и способам разделения смесей.
Урок 6. КВН по теме «ПТБ. Смеси. Способы разделения смесей».
Цель: учащиеся должны применять знания о смесях и способах их разделения.
Задачи для учащихся: учащиеся должны усвоить понятия «вещество», «смесь», уметь применять способы разделения смесей, различать смеси.
Оборудование и реактивы: магнит, железные опилки, древесные опилки, растительное масло, делительная воронка, стеклянная палочка, спички, штатив с кольцом, фарфоровая чашечка, фильтр, поваренная соль, мел.
Ход урока. Класс делится на 3 части. Одна часть – эксперты, которые будут оценивать выступление команд вместе с учителем и две команды. Команда выбирает капитана, придумывает название, девиз (связан с темой урока, например «Однородники»).
Итак, сегодня мы с вами повторим тему в игровой форме.
1 задание. (1балл за 1 правильный ответ, 1 балл за быстроту выполнения задания). Каждая команда получает текст с 3 вопросами.
1 вопрос. Из приведенного перечня выберите: а) вещества; б) тела; в) смеси.
Мрамор, железо, чугун, простокваша, суп, кастрюля, стакан, мел, цемент, хлор.
2 вопрос. Определите по физическим свойствам, о каком веществе идет речь.
Температура кипения 100°C, без цвета, без вкуса. Без запаха, замерзает при 0°C
3 вопрос. Что тяжелее: 1 кг воды или 1 кг льда? Почему?
2 задание. Кроссворд по ТПБ и лабораторной посуде.
К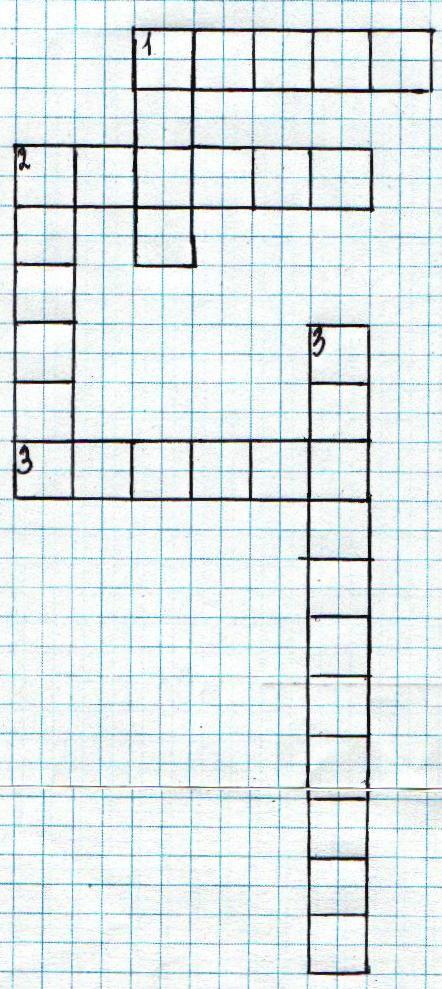 аждая команда получает по кроссворду, составленному ребятами из других классов.
аждая команда получает по кроссворду, составленному ребятами из других классов.
(1 балл за правильный ответ).
Кроссворд.
По вертикали:
1. На что нельзя пробовать вещества (вкус)
2.В нем можно хранить воду (стакан).
3. Правила техники безопасности надо …. знать и применять (обязательно).
По горизонтали:
Необходима для фильтрования (воронка).
2. Оборудование для измельчения веществ (ступка)
3. Брать вещества руками … (нельзя)
3 задание. Найти ошибку.
Смесь железа и серы является однородной. Ее можно разделить на компоненты путем выпаривания. (2 балла).
4 задание. Конкурс капитанов.
Задание для капитана 1 команды. Разделите смесь древесных опилок, железа и мела (5 баллов).
Задание для капитана 2 команды. Разделите смесь растительного масла и раствора поваренной соли.
Подведение итогов игры, награждение.
Домашнее задание. 20 химических элементов.
Урок 7. Физические и химические явления.
Цели: учащиеся должны различать физические и химические явления.
Задачи для учащихся: учащиеся должны определять физические и химические явления по признакам.
Ход урока.
На первом нашем уроке мы воспользовались «волшебной» палочкой. Химию считают волшебной наукой. Попробуем это доказать экспериментально.
Опыт 1. В пробирке смешиваем растворы HCI и AgNO3 . Наблюдаем появление осадка и изменение окраски раствора.
Опыт 2. В пробирке смешиваем растворы HCI и Na2CO3 . Наблюдаем выделение газа.
Опыт 3. В колбу с заготовленным кислородом опускаем тлеющую лучинку. Лучинка разгорается.
Опыт 4. Сгибаем (изменяем форму) медной проволоки. Ничего кроме формы не изменяется.
Опыт 5. Прогреваем над спиртовкой стеклянную палочку, изменяем ее форму. Кроме формы ничего не изменяется.
Вывод. Провели физические и химические явления, попробуем определить отличия между ними.
При физических явлениях (опыты 4, 5) мы наблюдали (Ответы учащихся: изменение формы).
При химических явлениях мы наблюдали (Ответы учащихся: изменение окраски, осадок, газ, свечение).
Физические явления – явления, в результате которых изменяется форма или агрегатное состояние вещества.
Химические явления – явления, в результате которых образуются новые вещества.
Существует 5 признаков химических явлений (реакций) словно 5 пальцев на одной руке.
Признаки химических явлений (реакций).
1.Выпадение осадка.
2. Выделение газа.
3. Изменение окраски.
4. выделение тепла.
5. Выделение света.
Закрепление материала.
Задание. В своей жизни мы используем и физические и химические явления. Определим, о каком явлении идет речь, поясним свой выбор.
- почернение серебряных изделий
- скисание молока
- кипение воды
- таяние льда
Работа с учебником. (1.4)
Заполните таблицу, приведя 2 – 3 примера.
| Физические явления | Химические явления |
Домашнее задание.1.4, упр.6, стр.25, 30 химических элементов, карточки с элементами (10*15)
Тема 2. Химический элемент.
Урок 8. Атомы и молекулы.
Цели: учащиеся должны знать понятия «молекула», «атом», «химический элемент», вспомнить положения атомно – молекулярной теории, структуру периодической системы химических элементов Д. И. Менделеева.
Задачи для учащихся: учащиеся должны формулировать определение химического элемента, находить элементы в периодической системе химических элементов Д. И. Менделеева.
Ход урока.
Повторение.
Проверка домашнего задания.
История создания атомно – молекулярного учения.
Вспомним историю создания учения о молекулах и атомах, используя страницы книги П. Эткинса «Молекулы» «Когда вы держите в руках книгу – вы держите в руках молекулы. Когда вы пьете кофе – вы глотаете молекулы… Вы едите молекулы, вы одеты в молекулы. В конце концов, вы сами построены из молекул… Мы окружены частицами. И, тем не менее, многие люди не подозревают о существовании частиц…так как до последнего времени никому не удавалось увидеть молекулу. На рубеже XIX и XX вв. в результате чрезвычайно плодотворного сотрудничества физиков, химиков и биологов было доказано, что молекулы действительно существуют. С помощью спектроскопии, то есть изучения света, поглощаемого и излучаемого молекулами, удалось выяснить расположение атомов в молекулах. Методом дифракции рентгеновских лучей (изучение картины распределения интенсивности рентгеновских лучей после прохождения через монокристалл вещества) было рассчитано распределение электронов в атоме. В конце концов, значительные успехи микроскопии, особенно электронной, привели к долгожданной цели – изображениям индивидуальных молекул и атомов». 1 Основателем идеи атома считают Демокрита. (Материал о его жизни и деятельности можно подготовить в виде доклада к следующему уроку). В 1827 году шотландский ботаник Роберт Броун подтвердил идеи Демокрита. Броун заметил, что пыльца растений движется под действием какой – то силы, причем хаотично. Большую роль в теорию внес англичанин Джон Дальтон, сформулировавший определение «химического элемента», используя атомы. Наш земляк, М. В. Ломоносов также занимался изучением строения вещества, говорил о существовании «корпускул» (молекул) и «элементов» (атомов). В 1860 году в г. Карлсруэ состоялся международный конгресс химиков, на котором были приняты определения атома и молекулы, а также положения атомно – молекулярного учения. Они вам знакомы с уроков физики.
Вещества состоят из молекул и атомов.
Атом – мельчайшая химические неделимая частица вещества.
Молекула – мельчайшая частица вещества, имеющая состав и свойства молекулы.
Химический элемент – определенный вид атомов.
Между частицами есть промежутки.
Частицы вещества непрерывно движутся.
Знаки химических элементов.
Вы уже знаете 30 химических элементов, вспомним их.
Работа с карточками.
Задание. Учитель просить показать химические элементы:
- элемент, необходимый для дыхания
- элемент, образующийся в виде простого вещества в ушной раковине
- элемент, не поддерживающий горения
- элемент, без которого не будет чугуна и стали
.H .C . Li Учащиеся соединяют точки между элементами, по заданиям учителя.
. Na .S .K При правильном выполнении задания у учащихся получается «+»
. N .O .F
Каждый химический элемент имеет свой порядковый номер.
.1 .6 . 8 Учащиеся соединяют точки между элементами, по заданиям учителя.
. 11 .20 .7 При правильном выполнении задания у учащихся получается «+»
.19 .14 .16
Домашнее задание. 2.1, 2.2, упр. 1,3,5, стр. 35, 30 химических элементов.
Урок 9. Относительная атомная масса.
Цели: учащиеся должны знать определение относительной атомной массы, уметь определять ее по таблице химических элементов, округлять ее до целых чисел.
Задачи для учащихся: уметь дать характеристику положения химического элемента в периодической системе, определять относительную атомную массу элемента, округлять ее значение.
Оборудование: карточки со знаками химических элементов.
Ход урока.
Работа с карточками.
Знакомство с относительной атомной массой.
(Из статьи: Пономарева Л. И) «Д. Дальтон не только поверил в атомную гипотезу, но и стал искать из нее следствия: если все вещества действительно состоят из атомов, то каждому атому можно приписать характеристику, например, атомный вес. Результаты своих размышлений Дальтон изложил в знаменитой книге «Новая система химической философии» (1808). Оставалось сделать последнее: научиться определять атомные веса элементов. Однако между химиками той поры долго не было согласия: почти каждый известный химик признавал только свою собственную таблицу весов, органики не доверяли неорганикам и т. д. Впервые абсолютное значение атомных масс и размеров удалось оценить в 1865 году Йозефу Лошмидту, который в это время преподавал физику в Венском университете. Оказалось, что размеры всех атомов примерно одинаковы и равны 10 -8 см, а вес атома водорода составляет всего 10 -24см. Впервые мы встречаемся с такими малыми величинами, и у нас просто нет необходимых понятий, чтобы их осмыслить. Самое большое, на что мы способны, это сказать: тонкий как волос, или – легкий, как пух. Но толщина волоса (10 -2 см) в миллион раз больше самого большого атома. Чтобы хоть как – то соразмерить малость этих чисел, обычно все же прибегают к сравнению. Если взять «атом» арбуза и вишню диаметром 1 см и одновременно их увеличивать, то в то момент, когда вишня станет величиной с земной шар, «атом» - и весом, и величиной – начнет походить на хороший арбуз.»1
Работа с текстом учебника (2.3)Учащиеся дополняют записи.
Относительная атомная масса (Ar) показывает …
Относительная атомная масса (Ar) измеряется …
Изотопы -…
Ar = m ат. эл / m ат. C * 1/12
Проводить расчеты значений относительных атомных масс элементов по формуле не удобно, мы будем искать их в периодической системе.
Закрепление материала.
Найдем относительные атомные массы элементов по периодической системе химических элементов Д. И. Менделеева.
Ar (O) = Ar (H) = Ar (Li) =
Задание. Попробуем определить, какие элементы спрятались в наших записях
11 ? 16 8 ? 2 1 ? 3 1 ?
Итак, изотопы (в данном случае водорода) отличаются лишь числом нейтронов.
Характеристика элемента по периодической системе.
План.
1). Порядковый номер
2) Относительная атомная масса.
Домашнее задание. 2.3, упр. 1,2,4, стр. 37, 35 химических элементов, карточки.
Урок 10. Химическая формула.
Цель: учащиеся должны знать химический язык, уметь различать простые и сложные вещества.
Задачи для учащихся: давать характеристику элемента по периодической системе; рассчитывать относительную атомную массу, характеризовать качественный и количественный состав вещества; классифицировать вещества на простые и сложные; читать химическую формулу.
Ход урока.
Повторение.
На доске задание. Пользуясь периодической системой химических элементов, запишите относительные атомные массы элементов
Ar (H) = Ar (Cl) = Ar (O) =
Ar (S) = Ar (Fe) = Ar (B) =
Структура периодической системы химических элементов Д. И. Менделеева.
Для того, чтобы дать более полную информацию о положении элемента в периодической системе, познакомимся со строением таблицы подробнее. Периодическая система состоит из 8 групп, расположенных вертикально. Каждая группа делится на две подгруппы: главную (А) и побочную (В). В периодической системе есть 7 периодов, расположенных горизонтально. Попробуем теперь охарактеризовать более подробно положение кислорода в периодической системе.
№8
Ar (O)=16
6 группа, главная подгруппа
2 период
Вспомним знаки химических элементов.
По заданию учителя ребята соединяют цифры, соответствующие округленному значению Ar. При правильном выполнении задания получают соответствующий символ.
.1 .4 .12
.16 .40 .23
Простые и сложные вещества.
H2SO4 HCl O2 Fe H2 SiO2
1 задание. Попробуйте выбрать сложные вещества, обоснуйте свой выбор.
Все сложные вещества состоят из атомов разных химических элементов (H2SO4 HCl SiO2)
2 задание. Попробуйте выбрать простые вещества, обоснуйте свой выбор.
Все простые вещества состоят из атомов одного химического элемента. (O2 Fe H2 )
Вещества: простые и сложные.
Простые вещества – состоят из атомов одного химического элемента.
Сложные вещества – состоят из атомов разных химических элементов.
Состав вещества выражается химической формулой.
Химическая формула – условная запись качественного и количественного состава вещества посредством химических знаков и индексов.
ЗНАКИ ЭЛЕМЕНТОВ



 КОЭФФИЦИЕНТ H3PO4
КОЭФФИЦИЕНТ H3PO4



ИНДЕКСЫ
Задание. Прочитайте химические формулы, определите качественный и количественный состав; назовите вещества; разделите на простые и сложные вещества.
5H2O, 3HNO3, 2 H2SO4, O2, Fe, CaCO3, K
Работа с учебником.
2.4, упр. 1 – 5, 8 -9, стр. 39 - 40
Домашнее задание. 2.4, 35 химических элементов, карточки.
Урок 11. относительная молекулярная масса.
Цели: учащиеся должны знать определение относительной молекулярной массы, уметь определять ее.
Задачи для учащихся: уметь дать характеристику положения химического элемента в периодической системе, определять относительную молекулярную массу элемента.
Оборудование: карточки со знаками химических элементов.
Ход урока.
Повторение.
Класс делим на две части. Одна часть – эксперты, вторая часть – ученики. Ученики по очереди читают химические формулы веществ, объясняют качественный и количественный состав молекулы, называют вещества.
Эксперты (в случае необходимости) помогают ученикам.
4H2O, 2HNO3, H2SO4, NaCl, 3Fe, CaCO3, Cu
Задание. Определим, где простые, а где сложные вещества в этом перечне. Если показываемое вещество простое, 1 хлопок в ладоши, если сложное – 2 хлопка (работает весь класс).
Относительная молекулярная масса.
Мы знаем, что атом имеет относительную атомную массу, относительная атомная масса (Ar) измеряется в а. е.м. Что же имеет молекула? (Ответ учащихся: относительную молекулярную массу). Что показывает Ar? (Ответ учащихся: отношение массы атома к 1/12 массы атома углерода). Что же, на ваш взгляд, показывает относительная молекулярная масса? (Ответ учащихся: отношение массы молекулы к 1/12 массы атома углерода). Относительная атомная масса обозначается Ar. А как, на ваш взгляд, обозначается относительная молекулярная масса? (Ответ учащихся: Mr).
Попробуем рассчитать относительную молекулярную массу для молекулы воды. Из каких атомов состоит молекула воды? (Ответ учащихся: из 2 атомов водорода и 1 атома кислорода).
Как же определить массу молекулы, если в ней несколько атомов? (Ответ учащихся: сложить значения Ar). Но ведь атомов водорода два, как учесть это? (Ответ учащихся: умножить Ar водорода на 2).
Итак, чтобы определить относительную молекулярную массу, нужно следовать плану.
Найти значения относительных атомных масс элементов в периодической системе.
Умножить число атомов на значение относительной атомной массы для каждого элемента.
Сложить полученные значения.
Пример 1. Mr (H2O) = 2Ar (H) +Ar (O) =2 +16 = 18
Пример 2. Mr (H2 S) = 2Ar (H) +Ar (S) =2+32=34
Рассчитайте относительные молекулярные массы веществ.
Mr (CaO) =
Mr (CuSO4) =
Mr (Al (OH) 3) =
Mr (NaCl) =
Mr (FeCL3) =
Mr (MgO) =
Mr (Al2O3) =
Mr (K2O) =
Mr (Na2O) =
Проверка выполнения задания у доски.
Задание. Выберите вещества, которые схожи между собой. Определите, чем они схожи.
Ребята выбирают MgO, Al2O3, Na2O, CaO, K2O Сходство в том, что вещества состоят из 2 элементов, в каждом веществе есть кислород.
Оксиды – сложные вещества, состоящие из 2 элементов, последним всегда стоит кислород.
Домашнее задание. 2.5, упр.1,стр.43.
Урок 12. Массовая доля элемента в веществе.
Цели: учащиеся должны уметь рассчитывать массовую долю элемента в веществе, понимать значение массовой доли.
Задачи для учащихся: рассчитывать массовую долю элемента в веществе любым удобным способом (пропорция или по формуле), считать относительную молекулярную массу вещества.
Ход урока.
Повторение.
Один из методов изучения химии – наблюдение. Человек наблюдательный сначала внимательно изучает что – то, затем анализирует, лишь потом делает выводы.
Химия – наука о…
Вещества можно разделить на …
Задание. Из данного перечня выберите простые и сложные вещества.
H2O, AgNO3, HCl, Cu, C, Mg, O2, Al, CO
Почему простые вещества записаны разными цветами? (Ответ учащихся: металлы, неметаллы, амфотерные элементы). А сталкиваемся ли мы с предложенными веществами в повседневной жизни? (Ответ учащихся: да).
Учитель рассказывает о применении предложенных веществ (учащиеся помогают учителю).
H2O - необходима человеку для нормальной жизни и деятельности
AgNO3 (ляпис) - можно использовать для сведения бородавок, а также в фотоделе
HCl - есть в нашем организме, а также хорошо прочищает водопроводные трубы
Cu - изготовление проводов в электротехнике
C - уголь, например для приготовления шашлыков
O2 – для дыхания
Mg - в пиротехнике
Al - изготовление проводов в электротехнике
CO – угарный газ (ЯД!). ТБ: влажная повязка, свежий воздух.
Задание. Определим относительные молекулярные массы сложных веществ из нашего перечня.
Mr (H2O) =
Mr (AgNO3) =
Mr (HCl) =
Mr (CO) =
Проверим правильность выполнения задания.
.19 .18 .20
.36,5 .36 .28
.171 .170 .28
Соединим цифры следующим образом: Mr (HCl) c Mr (CO). Mr (H2O) с Mr (AgNO3). При правильном выполнении задания, получим знак «+».
Можем смело двигаться дальше.
Массовая доля элемента в веществе.
Ситуация 1. Вы находитесь в магазине у прилавка с зубными пастами. Перед вами зубная паста «Crest» производства США (содержит SnF2) и зубная паста «Extra Dent» производства Болгарии (содержит NaF∙NaPO3) Что же выбрать, чтобы защитить зубную эмаль от кариеса? Чтобы ответить на этот вопрос, нам нужно определить, в какой из зубных пасть содержится больше фтора.
F - химический элемент. Мы можем по периодической системе найти значение его Ar. SnF2
и NaF∙NaPO3 - вещества, мы можем определить для них значения Mr. Чтобы узнать % содержания фтора в веществах, разделим значение Ar на Mr. Итак, получаем формулу для расчета массовой доли элемента в веществе.
W(омега) – массовая доля элемента.
Ar (элемента) ∙ X
W=------------------------------------ ∙ 100%
Mr (вещества)
X – число атомов элемента
Решим поставленную перед нами задачу.
Дано. Найти. Формулы.
SnF2 W(F) W(F)=(Ar (F) ∙X/Mr (вещества)) ∙100
NaF∙NaPO3
Решение. 1. Вычислим Mr веществ.
Mr (SnF2) = Ar (Sn) + 2Ar (F) = 117+19*2 = 156
Mr (NaF∙NaPO3=Na2 PO3F) =2Ar (Na) +Ar (P) +3Ar (O) +Ar (F) =2∙23+31+3∙16+19=144
2. Определим W (F)
W (F) в SnF2= (2∙19/156) ∙100%=24%
W (F) NaF∙NaPO3= (19/144) ∙100%=13, 2%
Ответ: богаче фтором зубная паста «Crest»
Конечно, мы упростили себе задачу, ведь зубных паст намного больше. Но для нас главной задачей было понять, как вычислить массовую долю элемента в веществе, а значит, как правильно сделать выбор.
Ситуация 2. Зима пробежала незаметно, выглянуло солнышко, родители потянулись на …огороды. Но прежде они заглянули в магазин «Сад и огород» за азотными удобрениями. Родители в недоумении, что выбрать: 1кг аммиачной селитры (NH4NO3);1 кг натриевой селитры (Na NO3); 1 кг калийной селитры (KNO3). Какой совет дадим родителям?
1 колонка. W (N) в NH4NO3
2 колонка. W (N) в NаNO3
3 колонка. W (N) в КNO3
Обсуждение результатов.
Проверочная работа.
Вычислить Mr:
1 вариант. FeO, NaOH, Al (OH) 3
2 вариант. Fe2O3, KOH, Fe (OH) 3
Домашнее задание. 2.5, упр. 2,3, стр. 43, 35 химических элементов.
Урок 13. Массовая доля элемента. Составление химических формул по массовой доле элементов.
Цели: учащиеся должны рассчитывать массовые доли элементов в веществе; составлять химические формулы по значениям массовых долей элементов; считать относительную молекулярную массу веществ.
Задачи для учащихся: рассчитывать массовую долю элемента в веществе, по известной массовой доле составлять формулы химических веществ.
Ход урока.
Повторение.
Класс делится на три колонки.
Задание. Даны вещества H2O, НNO3, CuO, MgSO4, Na2O, CaO, FeCl2, CuF2, Na
1 колонка. Выбрать формулы оксидов, определить их Mr, назвать вещества.
2 колонка. Выбрать формулы оставшихся сложных веществ, определить их Mr.
3 колонка. Определить массовую долю кислорода в воде (%).
Проверка выполнения задания возможна следующим образом. По очереди представители 1 и 2 колонок на доске делают соответствующие записи с пояснением. Представитель 3 колонки оформляет задачу на доске, комментирует сделанные записи.
Составление химических формул по известным массовым долям элементов в веществе.
Зная скидку, действующую в магазине, мы легко определим сэкономленные деньги. Зная массовые доли элементов в веществе, можно составить химическую формулу данного вещества.
Задача. Составьте химическую формулу вещества, в котором 89% кислорода, 11 % водорода.
Дано. Найти. Формулы.
W (О) =89% формула
W (Н) =11% НxOy W (эл.)= Ar (эл.) ∙X/Mr (вещества) ∙100
Решение. 1. x: y= W(Н)/Ar(H): W (O)/Ar (O)
X: y = 11/1:89/16 = 11:5, 5 = 2:1
2. Формула вещества H2O
Ответ. H2O
Проверочная работа «Mr. Массовая доля элемента».
1 вариант.
1. Вычислите относительные молекулярные массы веществ, назовите вещества.
А) MgO Б) H2O В)HNO3 Г)CaO
2. Определите массовую долю углерода в углекислом газе (CO2)
3. Выведите формулу вещества, зная, что массовые доли серы и кислорода в нем 50 %.
2 вариант.
1. Вычислите относительные молекулярные массы веществ, назовите вещества.
А) Na2O Б) H2SO4 В)Al2O3 Г)HCl
2. Определите массовую долю кальция в оксиде кальция (CаO)
3. Выведите формулу вещества, зная, что массовые доли кальция 40 %, углерода 12%, кислорода 48 %.
Дополнительно. Вычислите массовую долю углерода в глюкозе (C6 H12O6)
Домашнее задание. 2.5, 35 химических элементов, формулы.
Тема 3. Количественные отношения в химии.
(8 ч.)
Урок 14. Валентность. Определение валентности по ПС.
Цели: учащиеся должны знать правила определения валентности элементов по периодической системе, составлять химические формулы по валентности.
Задачи для учащихся: уметь определять валентности химических элементов по периодической системе, составлять химические формулы по валентности.
Ход урока.
Анализ проверочной работы.
У доски рассматриваются вопросы, в которых учащиеся допустили наибольшее количество ошибок.
Валентность.
Мы владеем химическим языком. Умеем читать химические формулы, знаем качественный и количественный состав молекул.
Вспомним на примере молекулы аммиака NH3
Задание. Атомы каких элементов входят в состав молекулы аммиака? Сколько их?
Состав молекул строго определенный.
Валентность – способность атомов химических элементов присоединять определенное число атомов других элементов.
Обозначается валентность римскими цифрами. Где нам встречались римские цифры? (Ответ учащихся: номер групп).
Действительно, валентность тесно связана с периодической системой.
Правила определения валентности по периодической системе.
Группы делятся на подгруппы: главные и побочные. Вам это уже известно. Существуют определенные правила, по которым можно определить валентность элемента по периодической системе.
Правила (запись).
Валентность металлов главных подгрупп (А) постоянна и равна номеру группы.
Валентность металлов побочных подгрупп (В) переменна, всегда указывается в скобках после названия вещества.
Если неметалл стоит в формуле первым, чаще его валентность равна номеру группы (высшая валентность).
Если неметалл стоит в формуле вторым, его валентность вычисляется по формуле
8 - № группы (низшая валентность)
Попробуем определить возможные валентности химических элементов
Na, Al, Mg, Be, K, Si
Высшая валентность, например азота V, низшая III (8 -5)
Составление химических формул по валентности.
Формулы бинарных соединений составляются по определенному алгоритму.
Алгоритм составления формул по валентности.
Пишем рядом знаки химических элементов, начиная с последнего в названии.
Над элементами ставим римскими цифрами их валентность.
Находим наименьшее общее кратное между значениями валентностей, пишем его арабской цифрой сверху.
Делим наименьшее общее кратное на валентности, ставим индексы.
Читаем химическую формулу.
Задание. По данному алгоритму составим формулу оксида кальция.
СаО
II II
СаО
II 2 II
СаО
СаО
Составим формулу оксида алюминия.
AlO
III II
AlO
III 6 II
AlO
Al2O3
Составим формулу оксида железа (III).
FeO
III II
FeO
III 6 II
FeO
Fe2O3
Самостоятельная работа.
Составьте формулы веществ по валентности.
Оксид натрия.
Оксид железа (II).
Оксид меди (II).
Оксид серы (IV).
Оксид серы (VI).
Оксид серебра (I).
Оксид марганца (IV).
Оксид титана (II).
Проверка (по цепочке) учащиеся выполняют задание. Комментируют сделанные записи по алгоритму.
Домашнее задание. Записи в тетрадях (алгоритм, правила), упр. 5, стр. 48
Урок 15. Составление химических формул по валентности. Определение валентности элементов в формуле.
Цели: учащиеся должны знать определение валентности, правила определения валентности элементов по периодической системе, знать высшую и низшую валентности, составлять формулы бинарных соединений по валентности.
Задачи для учащихся: владеть понятием «валентность», знать правила ее определения по периодической системе, знать алгоритм составления формул по валентности, уметь его применять на практике.
Ход урока.
Повторение.
Вспоминаем правила определения валентности элементов по периодической системе, алгоритм составления формул веществ по валентности.
Задание. Составим, согласно алгоритму, формулы веществ.
Хлорид натрия.
Хлорид калия.
Хлорид железа (II).
Хлорид серебра (I).
Хлорид меди (II).
Бромид магния.
Бромид калия.
Бромид кальция.
Иодид калия.
Фторид натрия.
Определение валентности элементов по химической формуле.
Алгоритм (запись).
Определяем валентность у одного из элементов по периодической системе (берем тот элемент, валентность которого постоянна).
Умножаем валентность на индекс, получаем наименьшее общее кратное.
Дели наименьшее общее кратное на индекс второго элемента, получаем его валентность.
Называем вещество.
Пример. Fe2O3
По алгоритму.
II
1. Fe2O3
6 II
2. Fe2O3
Ш 6 II
3. Fe2O3
4. Оксид железа (III)
III. Самостоятельная работа.
Задание. Определите валентности элементов. Назовите вещества.
FeO, FeCl3, CuO, CuCl2, MnO2, ZnO, ZnCl2, TiO2
Проверка задания у доски (по цепочке) учащиеся выполняют задание, комментируют свои действия.
Задача на массовые доли элементов в веществе.
Определим, что богаче железом: оксид железа (II) или оксид железа (III).
Один учащийся выполняет на доске первую часть задачи, второй учащийся – вторую часть задачи. Вывод делает класс.
Домашнее задание. 3/1, повторить формулу.
Урок 16. Закон постоянства состава веществ.
Цели: учащиеся должны знать формулировку закона постоянства состава веществ, использовать его при расчетах.
Задачи для учащихся: знать формулировку закона постоянства состава веществ, уметь применять его при решении задач.
Ход урока.
Повторение.
Вспомним понятие «валентность», правила составления химических формул по валентности, правила определения валентности элементов в формуле.
Задание 1. Составьте формулы веществ. ( У доски 3 учащихся.)
Оксид натрия. Хлорид калия. Бромид меди (II).
Задание 2. Определите валентности элементов, назовите вещества. ( У доски 3 учащихся.)
Fe2O3 CuO Ag2O
Закон постоянства состава веществ.
Составляя химические формулы, мы видим, что атомы в молекулах находятся в определенных массовых отношениях.
Fe2O3 2:3 CuO 1:1 Ag2O 2:1
Как же определить массовые отношения? Экспериментальным путем установлено, что при разложении воды получается смесь газов. Содержащих 89% кислорода и 11 % водорода. Такое соотношение не зависит ни от места нахождения, ни от способа получения.
Закон постоянства состава : вещество имеет один и тот же качественный и количественный состав, физические и химические свойства, независимо от того, где и как оно получено.
Именно благодаря закону постоянства состава можно записывать химические формулу веществ по валентности, и по известным массовым долям элементов, решать задачи на определение массовой доли элемента в веществе. Вспомним, как проводятся такие расчеты.
Задача 1. Составьте формулу вещества, в котором 71 % кальция и 29 % кислорода. Назовите вещество.
Задача 2. Определите массовую долю железа в оксиде железа (III).
Домашнее задание. 3.2, стр.42,43, упр.4.5
Урок 17. Систематизация и коррекция ЗУН по теме «Химическая формула. Валентность».
Цели: учащиеся должны знать определение «валентность», формулу для расчета массовой доли элемента в веществе, уметь определять валентность по периодической системе, в формулах веществ, составлять формулы по валентности, знать формулировку закона постоянства состава.
Задачи для учащихся: определять валентность элементов, решать задачи на массовую долю элемента в веществе, составлять формулы веществ по валентности.
Ход урока.
Проверка домашнего задания.
Решение расчетных задач на выводы формул веществ по известным массовым долям элементов.
Задача 1. Определите химическую формулу вещества, содержащего 2 % водорода, 32,6% серы и 65 % кислорода.
Задача 2. Определите химическую формулу соединения, широко используемого в производстве стекла, если в нем содержится 46.7 % кремния и 53, 3 % кислорода.
Решение задач на определение массовой доли элемента в веществе.
Задача. Определите, какое из соединений богаче железом: хлорид железа (II) или хлорид железа (III).
Домашнее задание. Подготовиться к контрольной работе.
Урок 18. Контрольная работа по теме «Валентность. Химическая формула».
Цели: проверить знания, полученные учащимися по данному материалу.
Задачи для учащихся: показать владение материалом данной темы.
Ход урока.
Выполнение контрольной работы по вариантам.
I вариант.
Определите валентности элементов в веществах, назовите вещества.
CuF2, CaI2, MgO, CO2, FeCL3
Составьте формулы соединений:
а) алюминия с хлором;
б) натрия с кислородом;
в) кальция с серой.
Назовите вещества.
Определите массовую долю кислорода в серной кислоте (H2SO4).
Определите химическую формулу соединения, содержащего 27 % натрия, 16 % азота, 56 % кислорода.
(дополнительно). Массовая доля кислорода в оксиде двухвалентного металла 28, 57 %. Определите элемент и составьте формулу вещества.
II вариант.
Определите валентности элементов в веществах, назовите вещества.
CuCL2, NaI, CaO, CO, FeCL2
Составьте формулы соединений:
а) калия с хлором;
б) кальция с кислородом;
в) магния с серой.
Назовите вещества.
Определите массовую долю кислорода в азотной кислоте (HNO3).
Определите химическую формулу соединения, содержащего 56,6 % калия, 8,7 % углерода, 34,8 % кислорода.
(дополнительно). Массовая доля кислорода в оксиде трехвалентного металла 47 %. Определите элемент и составьте формулу вещества.
Домашнее задание. Подобрать материал о М. В. Ломоносове.
Урок 18, 19(спаренный урок). Закон сохранения массы веществ. М. В. Ломоносов – человек и ученый.
Цели: учащиеся должны знать формулировку закона сохранения массы веществ, его значение, жизнь и деятельность М. В. Ломоносова.
Задачи для учащихся: учащиеся должны формулировать закон сохранения массы веществ, владеть материалом о жизни и деятельности М. В. Ломоносова.
Оборудование и реактивы: BaCl2, H2SO4, весы, стаканы.
Ход урока.
Обсуждение результатов контрольной работы.
Закон сохранения массы веществ.
Опыт. На весах уравновешиваем 2 стакана. В одном стакане находится раствор хлорида бария, в другом – раствор серной кислоты. Сливаем содержимое стаканов. Наблюдаем, изменение окраски, появление осадка, а весы остаются в равновесии.
Закон сохранения массы веществ – масса веществ, вступивших в химическую реакцию равна массе образовавшихся веществ.
Благодаря данному закону стало возможным записывать химические уравнения. О химических уравнениях мы поговорим во второй четверти. А сейчас поговорим о нашем великом земляке, имеющем непосредственное отношение к данному закону, М. В. Ломоносове. Вы подготовили сообщения о жизни и деятельности великого ученого, сейчас мы проведем малые Ломоносовские Чтения.
Малые Ломоносовские чтения.
Данное мероприятие представляет собой конференцию учащихся 8 класса, целями которой являются:
знакомство с автобиографией М. В. Ломоносова
рассмотрение деятельности М. В. Ломоносова в разных областях науки
привлечение учащихся к исследовательской деятельности
популяризация достижений отечественной и мировой науки
формирование гармонически развитой личности ребенка
Подготовка к Ломоносовским чтениям началась заранее. Учащимся было предложено найти материал о М. В. Ломоносове, показать его учителю. После знакомства с черновиками ребят оказалось, что большая часть материала, найденного учащимися, относится к детству земляка и его трудам по химии и физике. Для того, чтобы на Ломоносовских чтениях деятельность М. В. Ломоносова была рассмотрена всесторонне, учитель ищет материал о значении деятельности М. В. Ломоносова для истории.
Открытие конференции.
Отрывок из Оды на день восшествия на всероссийский престол Ее Величества Государыни Императрицы Елисаветы Петровны 1747 года
… О вы, которых ожидает
Отечество от недр своих
И видеть таковых желает,
Каких зовет от стран чужих,
О, ваши дни благословенны!
Дерзайте ныне ободренны
Раченьем вашим показать,
Что может собственных Платонов
И быстрых разумом Невтонов
Российская земля рождать.
Науки юношей питают,
Отраду старым подают,
В счастливой жизни украшают,
В несчастной случай берегут;
В домашних трудностях утеха
И в дальних странствах не помеха.
Науки пользуют везде,
Среди народов и в пустыне,
В градском шуму и наедине,
В покое сладки и в труде…
Затем идет вступительное слово (учитель).
М. В. Ломоносов. Великий ученый, патриот Отечества призывал к большим благородным делам, связывал воедино научную деятельность и выполнение общественного долга, и научные поиски. Мы, его потомки, будем стараться быть достойными великого земляка. Итак, в ходе нашей конференции мы проанализируем все сферы деятельности М. В. Ломоносова, докажем его всесторонность. Регламент выступления 5 минут.
1. Слово предоставляется учителю.
Тема выступления: М. В. Ломоносов – основоположник русской исторической науки.
М. В. Ломоносов был ученым и неутомимым организатором исследовательской и просветительной работы. Человек могучей научной страсти, он посвятил свою жизнь развитию науки, борьбе с невежеством, непониманием, никогда не ждал наград, привык преодолевать сопротивление невежд. Восхищенный широтой диапазона и талантом архангельского помора, Пушкин писал: «… Ломоносов обнял все отрасли просвещения. Жажда науки была сильнейшею страстию сей души. Историк, ритор, механик, химик, художник и стихотворец. Он все испытал и все проник»
Ломоносов был основоположником и зачинателем исторической науки в России. Его работы по этногенезу, то есть по происхождению народов, в том числе и русского, составили целую эпоху в истории. История была для Ломоносова такой же «божественной наукой», какими были для него химия, физика, литература. Ломоносов в 1746 году составил «Родословие великих князей, царей и императоров всероссийских». За что был назначен в 1748 году профессором в Историческое собрание. Ломоносов разоблачил приемы норманистов, которые переделывали имена русских князей на скандинавские: из Владимира выходил у них Валдамар, из Ольги – Аллогия, из Всеволода – Визавалдур и прочее. Ломоносов правильно определяет территорию, которую заселяли славяне. Ломоносов создал «Российскую историю». Параллельно с работой над книгой, Ломоносов читал лекции, ставил опыты, произносил публичные речи, занимался устройством фейерверков и сочинял надписи к транспарантам во время иллюминаций. Ломоносов был вооружен знанием всех доступных тогдашнему историку источников, правильно понимал долг историка перед народом. Первый том был напечатан уже после смерти автора, в 1766 году, под названием «Древняя Российская история от начала российского народа до кончины великого князя Ярослава Первого, или до 1054 года, сочиненная Михайлом Ломоносовым, статским советником, профессором химии и членом Санкт – Петербургской императорской и королевской шведской Академий наук».
Труды Ломоносова по отечественной истории должны быть поставлены в один ряд с открытиями ученого в экспериментальных науках. Гений Ломоносова проявился в полной мере в его занятиях историей.
Трагична история памяти и научного наследия Ломоносова. Было сделано все, чтобы в России забыли фамилию великого ученого, однако это было напрасно. Кучка невежд не смогла погасить народную славу.
Далее предоставляется слово учащимся согласно программе конференции.
Возможные темы для выступлений:
« Великий ученый».
«Детство, юность М. В. Ломоносова».
«Жизнь великого русского ученого М. В. Ломоносова».
«Студенческие годы М. В. Ломоносова».
«Обучение в Германии».
«Деятельность М. В. Ломоносова после жизни в Германии».
«Научная деятельность М. В. Ломоносова»
«Ломоносов и физика».
«Ломоносов и его труды по химии».
«Ломоносов и мозаика».
«М. В. Ломоносов и физическая химия».
«Научная деятельность великого помора».
«Ломоносов и неорганическая химия».
«Ломоносов и наука».
Закрытие конференции.
Для закрытия конференции слово предоставляется учителю.
М. В. Ломоносов предстал перед нами как многогранная личность. Он был естествоиспытателем, философом, поэтом, основоположником русского литературного языка, историком, географом, политическим деятелем. Личность М. В. Ломоносова, его патриотический подвиг, бескорыстное служение народу – все это делает его родным и близким для нас. М. В. Ломоносов жил убеждением, что «Крепит Отечества любовь Сынов российских дух и руку». Именно вам предстоит продолжить великие дела великого помора.
Награждение участников конференции.
Участники конференции награждаются дипломами участника Малых Ломоносовских чтений и ценными призами (книгами).
Домашнее задание. Оформить материал выступлений.
Урок 20. Заключительный урок в 1 четверти. Игра «Кто хочет стать миллионером?»
Цели: повторить изученный материал в форме игры.
Задачи для учащихся: использовать полученные знания в нестандартной ситуации.
Ход урока.
Учитель объясняет правила игры, подсказки (по принципу телеигры «Кто хочет стать миллионером?»)
Подсказки:
-помощь друга (в классе).
-помощь компьютера (учителя)
- помощь аудитории (класса)
Три несгораемых цифры:
-1000 рублей («3»)
-10000 рублей («4»)
- 100000 рублей («5»)
За урок можно провести несколько игр. Приведу пример одной игры.
Вопросы отборочного тура.
Расположите формулы веществ согласно их названиям.
H2O, NaCl, CaO, H2SO4
А. хлорид натрия
Б. вода
В. серная кислота.
Г. оксид кальция.
Победитель отборочного тура продолжает игру (рядом с учителем).
Вопросы игры.
1 вопрос (100 рублей)
Что изучает химия?
А. вещества.
Б. уголовное право.
В. буквы.
Г. тела вокруг нас.
2 вопрос (200 рублей).
Из чего состоят вещества?
А. из шурупов.
Б. из проводов.
В. из атомов.
Г. из кнопок.
3 вопрос (300 рублей).
Что такое молекулы?
А. мельчайшие частицы вещества.
Б. часть атома.
В. крупнейшие частицы тела.
Г. бесформенные крупинки.
4 вопрос (500 рублей).
Как называется вещество NaCl?
А. оксид натрия.
Б. хлорид натрия.
В. Бромид натрия.
Г. Сульфид натрия.
5 вопрос (1000 рублей). Первая «несгораемая» цифра («3»).
Как разделить смесь железа и серы.
А. выпарить
Б. профильтровать
В. отстоять
Г. использовать магнит
6 вопрос (5000 рублей)
Какую химическую формулу имеет ляпис?
А. H2O
Б. KNO3
В. AgNO3
Г. Cu(NO3) 2
7 вопрос. (10000 рублей). Вторая «несгораемая» цифра («4»)
Раствор какого вещества используют в медицине для дезинфекции.
А. H2O
Б. CaCl2
В. KMnO4
Г. CuSO4
8 вопрос. (50000 рублей).
Какой газ называют «бурым»?
А. SO3
Б. SO2
В. NO2
Г. NO
9 вопрос. (100000 рублей). Последняя «несгораемая» цифра («5»).
Кто впервые сумел оценить размеры атомов?
А. Д. Дальтон.
Б. М. Ломоносов.
В. Й. Лошмидт.
Г. Р. Бойль
Учащиеся вправе в любой момент забрать «деньги», то есть заработанную оценку.
II. Подведение итогов 1 четверти.
Домашнее задание (на каникулы). Сочинение на тему «Химия в моей жизни».
Список использованной литературы
1. Габриелян О. С., Воскобойникова Н. П., Яшукова А. В. Настольная книга учителя. Химия . 8 к л.: Методическое пособие. — М.: Дрофа, 2006.
2. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия . 9 к л.: Методическое пособие. — М.: Дрофа, 2003.
3 . Химия . 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна « Химия . 8 »/ О. С. Габриелян , П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2005.
4. Габриелян О. С., Смирнова Т. В. Изучаем химию в 8 кл.: Дидактические материалы. — М.: Блик плюс, 2004.
5. Габриелян О. С., Яшунова А. В. Рабочая тетрадь. 8 кл. К учебнику О. С. Габриеляна « Химия . 8». — М.: Дрофа, 2007.
6. Габриелян О. С., Рунов Н. Н., Толкунов В. И. Химический эксперимент в основной школе. 8 кл. — М.: Дрофа (выйдет в 2005 г.).
7. Габриелян О. С., Воскобойникова Н. П. изучаем химию . Химия в тестах, задачах, упражнениях. 8 — 9 кл. — М.: Дрофа, 2005.
Литература для учителя:
1. Программа О.С. Габриеляна «Программа курса химии для 8 -11 классов общеобразовательных школ», М.: «Дрофа», 2010г
С. Габриелян «Примерное тематическое планирование уроков химии », 2006г
О.С. Габриелян «Настольная книга учителя химии », М., «Блик и К», 2007г
Литература для учащихся:
О.С. Габриелян « Химия , 8 класс », М., 2009 г
О.С. Габриелян «Мы изучаем химию , 8 класс », М., 2009г
Использованные материалы и Интернет-ресурсы
1. Единые образовательные ресурсы с сайта www. school-coolection.edu.ru
(единой коллекции образовательных ресурсов)
2. CD «Неорганическая химия», издательство «Учитель»
3. CD «Органическая химия», издательство «Учитель»
4. CD «Общая химия», издательство «Учитель»
5. CD «Школа Кирилла и Мефодия», издательство «Учитель»
6. Химия. Просвещение «Неорганическая химия»,. 8 класс. (на 2-х дисках)
7. Химия (8-11 класс). Виртуальная лаборатория (учебное электронное издание)
8. СD «Химия 8-11 класс», Библиотека электронных наглядных пособий.
9. CD Самоучитель «Химия для всех» (8-11 класс)
10. Интерактивное оборудование, интернет ресурсы и CD диски.

 Получите свидетельство
Получите свидетельство Вход
Вход


 аждая команда получает по кроссворду, составленному ребятами из других классов.
аждая команда получает по кроссворду, составленному ребятами из других классов.

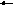 КОЭФФИЦИЕНТ H3PO4
КОЭФФИЦИЕНТ H3PO4











 Поурочное планирование по химии (8 класс) (0.5 MB)
Поурочное планирование по химии (8 класс) (0.5 MB)
 5
5 3981
3981 865
865 Нравится
0
Нравится
0


