| Объяснение материала учителем. Распределение электронов по энергетическим уровням. Характеристика состояния электронов в атомах. Электроны в атомах обладают различным запасом энергии, которую они поглощают или излучают определенными порциями, или так называемыми квантами.
Электрон в атоме находится лишь в определенных квантовых состояниях, соответствующих определенным значениям энергии его связи с ядром.
Значение энергии электрона задается главным квантовым числом n, которое может принимать только целочисленные значения: n=1, 2,3… . Электроны, обладающие наименьшим запасом энергии (n=1 ), находятся на первом энергетическом уровне.
Переход электрона из одного квантового состояния в другое связан со скачкообразным изменением энергии, при этом электроны могут переходить на второй и более удаленные энергетические уровни.
Число электронов N на данном энергетическом уровне определяется формулой N=2n2 , где n – главное квантовое число.
Согласно этой формуле :
на первом энергетическом уровне (n=1 ) могут находиться два электрона (N=2 ∙ 12 = 2),
на втором (n=2) – восемь электронов (N=2 ∙ 22 = 8),
на третьем (n=3) – восемнадцать электронов (N=2 ∙ 32 = 18 ) и т.д.
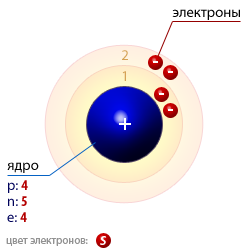
Предложить учащимся рассмотреть графическое изображение состояние электронов в атомах на примере атома водорода. 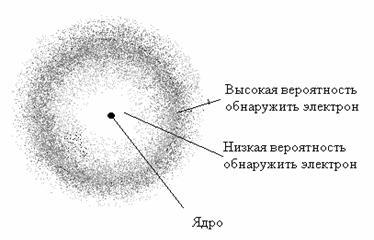 Далее показать вторую картинку Электронное облако водорода с неравномерной плотностью  Попросить учащихся ответить на вопросы по данным картинкам. Например, Понятно ли им, что показывают данные картинки? Есть ли траектория движения у электрона? Экспериментально доказано, что вероятность пребывания электрона в области заряженного ядра не одинакова.
Вероятность нахождения электрона около самого ядра атома водорода близка нулю.
При удалении от ядра вероятность пребывания электрона в данной области пространства быстро возрастает и достигает максимального значения на расстоянии 53 пм от ядра, а потом постепенно убывает.
Частоту пребывания электрона на определенном расстоянии от ядра принято графически изображать точками.
Там, где электрон пребывает чаще, плотность точек больше, где реже – меньше.
В результате возникает картина, напоминающая область эколоядерного пространства, в котором вероятность нахождения электрона составляет – 90%, называют электронным облаком или электронной орбиталью. (учащиеся пишут под запись)
Она имеет определенную форму и пространственную ориентировку. 
Просмотр видео: Что такое атомная орбиталь? Задать вопросы по данному видео после просмотра учащимися. Что такое орбита? Что такое атомная орбиталь. Как можно определить атомные орбитали? Какова природа электрона.
Объяснение учителем: Понятие о s-, p-электронах и их распределении по энергетическим уровням и подуровням. Электроны, состояние которых описывается облаком (орбиталью) сферической формы, принято называть s-электронами. 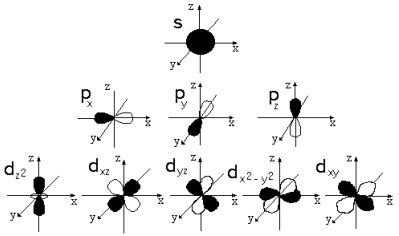 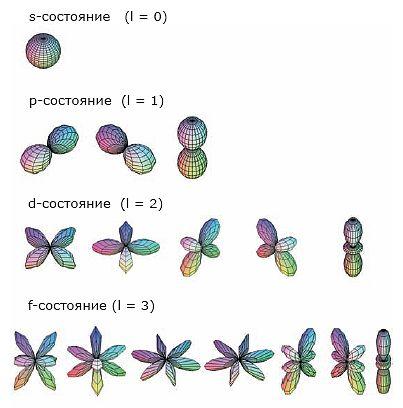 Задать вопрос учащимся: Сколько электронов в атоме гелия ?
(Предполагаемый ответ: в атоме гелия два s-электрона).
Как могут сосуществовать на одном энергетическом уровне два электронных облака сферической формы ?
Объяснение учителем: Электроны, кроме движения вокруг ядра, обладают ещё и внутренним движением, которое упрощенно можно представить как вращение вокруг собственной оси.
Это явление получило название «спин» (от англ.spin – крутиться, вертеться). Электронные облака одинаковой формы могут перекрываться, если электроны обладают противоположными (антипараллельными) спинами, т.е. один как бы вращается вокруг оси по часовой, а другой – против часовой стрелки.
Графически это изображается так:
1s1 1s2
Н ↑ Не ↑↓
Клетка обозначает орбиталь, стрелка – электрон, разнонаправленные стрелки – противоположные (антипараллельные) спины.
Расположение электронов в атомах принято также изображать в виде электронных формул, например:
H - 1s1
He - 1s2
Цифра перед буквой показывает номер энергетического уровня; Буква – энергетический подуровень и форму электронного облака; Цифра справа над буквой – число электронов на указанном подуровне с данной формой облака.
Число электронов на энергетическом уровне соответствует известной формуле N=2n2 Учащимся предлагается выполнить задание уровня А: Сколько и какие химические элементы первого периода содержат от одного до двух электронов ? (Ответ: в 1-м периоде периодической таблицы химических элементов не может быть больше двух химических элементов. Это водород и гелий).
У атома Li третий, а у атома бериллия Ве третий и четвертый электроны располагаются на втором энергетическом уровне. Эти электроны в своём движении тоже образуют сферические облака, но большего размера.
У атома бора В появляется пятый электрон. 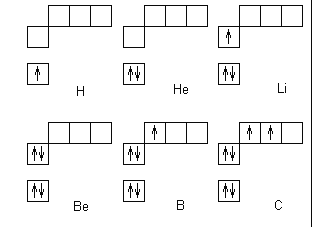 Этот электрон при движении образует облако, напоминающее форму гантели  Показать учащимся возможную ориентацию р- электронных облаков в пространстве  Гантелеобразные электронные облака располагаются взаимно перпендикулярно по осям x, y, z.
Объяснить учащимся, что для построения электронных конфигураций атомов необходимо учитывать: Принцип Паули. В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствам  Вольфганг Паули Вольфганг Паули
Правило Хунда. При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке. 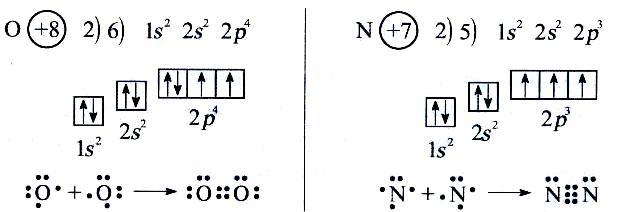  Фридрих Хунд Фридрих Хунд
Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l. 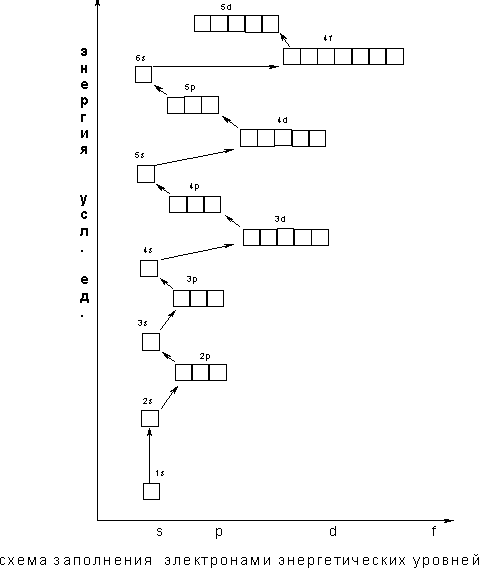
Работа в группах Задание: составьте схемы распределения электронов
1 группа: С, Са, О, Cl
2 группа: N, Ne, K, Ar
3 группа: Na, F, S, P
Взаимопроверка работ группами по ключам ответов.
Дополнительный вопрос классу:
Могут ли на одном и том же энергетическом уровне находиться электроны с различной формой облаков?
(Ответ: Да, но эти электроны отличаются друг от друга энергией связи с ядром).
Объяснить, что отображает данный слайд. 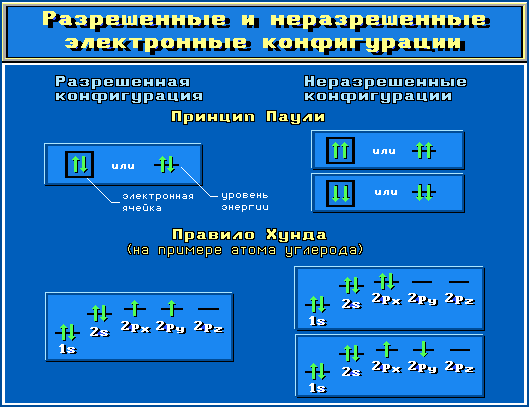 Показать учащимся возможные схемы изображения электронно-графических конфигураций атомов.
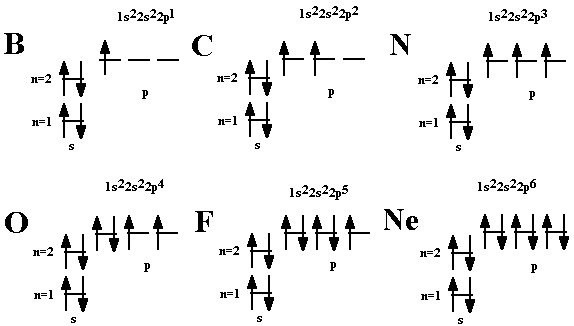
Индивидуальная работа учащихся Задание: Объяснить значения электронных конфигураций на примере атома водорода. 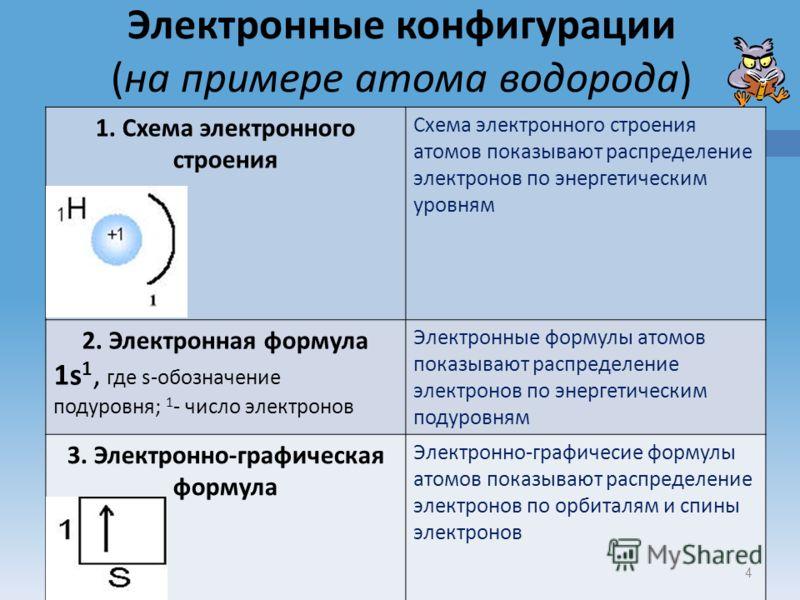 Взаимопроверка работ учащихся 
Далее следует провести групповую работу по изготовлении моделей атомов первых 20-ти элементов (навыки 2 гр: применение знаний) Задание: из имеющегося материала изготовить любые модели атомов для первых 20-ти ХЭ. Если в классе имеются учащиеся, занимающиеся олимпиадами по химии, задание можно усложнить. Изготовить модели атомов для элементов побочных подгрупп. КРИТЕРИИ К ЗАДАНИЮ: Правильно определяет количество электронных оболочек. Правильно распределяет электроны по уровням. Правильно строит электронно-графическую формулы выбранного атома элемента. Правильно указал число протонов и нейтронов. Изготавливает аккуратно и ровно вырезанные круги (орбитали). Аккуратно соединяет друг с другом готовые круги ниткой (они должны вращаться). Красиво рисует электроны на орбиталях (можно использовать цветные фломастеры). Относится творчески к изготовлению модели.   
И другие. ОЦЕНИВАНИЕ РАБОТ УЧАЩИХСЯ ЧЕРЕЗ ВЗАИМООЦЕНИВАНИЕ . УЧАЩИЕСЯ ОБМЕНИВАЮТСЯ МОДЕЛЯМИ АТОМОВ И ПРОВЕРЯЮТ СОГЛАСНО ВЫДАННЫМ КРИТЕРИЯМ, ПРАВИЛЬНОСТЬ МОДЕЛЕЙ АТОМОВ. | 

 Получите свидетельство
Получите свидетельство Вход
Вход











 Вольфганг Паули
Вольфганг Паули 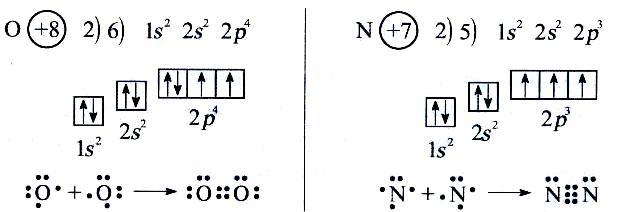
 Фридрих Хунд
Фридрих Хунд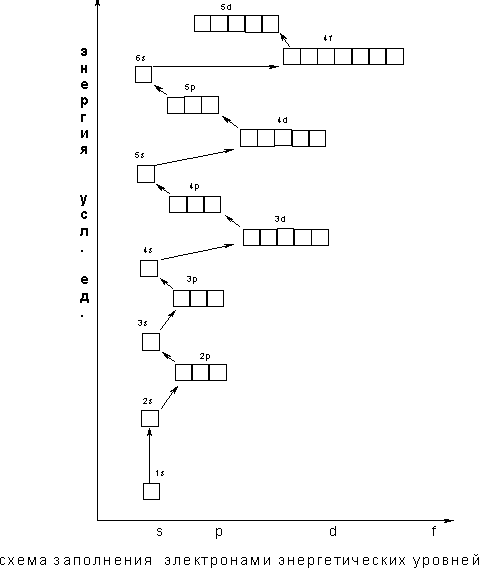

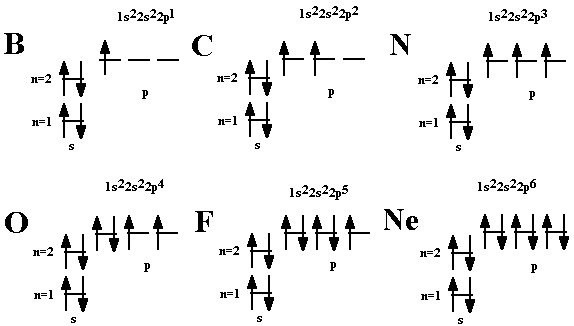













 План урока по химии на тему "Распределение электронов в атоме. Изготовление моделей атомов" (0.43 MB)
План урока по химии на тему "Распределение электронов в атоме. Изготовление моделей атомов" (0.43 MB)
 0
0 5730
5730 818
818 Нравится
0
Нравится
0





