Тема: Основные положения Молекулярно-кинетической теории. Размеры молекул.
Цели урока:
образовательная: сформулировать основные положения МКТ; дать понятие о размерах молекул систематизировать знания учащихся по МКТ на основе структуры физической теории; на примере становления идеи атомизма проследить общий путь научного познания: опыт – модель – следствия - эксперимент.
развивающая: формировать умение применять теорию на практике; развиватьнаблюдательность, самостоятельность.
воспитательная: продолжить формирование представлений о единстве и взаимосвязи явлений природы;
продолжить работу по воспитанию положительной мотивации к изучению физики, формированию инициативности, уверенности в своих силах.
Тип урока: изучение нового материала.
Форма урока: Вводная лекция с элементами беседы.
Ход урока
-
Изучение нового материала
Историческая справка
В 5 веке до новой эры древнегреческий ученый Демокрит утверждал: «Ничто не существует, кроме атомов и пустого пространства. Всё прочее есть мнение… Атомы бесконечны в числе и бесконечно различны по форме».
В 4 веке появилось учение Аристотеля, которое позднее будет поддержано христианской церковью: «Любое тело может делиться до бесконечности».
В 1646 году француз Пьер Гассенди высказал предположение, что атомы объединяются в небольшие группы «молекулы» (от лат. «moles» – масса)
В 18 веке М.В. Ломоносов предположил, что молекула может быть однородной и разнородной и находиться в в хаотичном состоянии. В этом же веке Бернулли применил понятие о молекуле для объяснения давления газов.
В 1827 году английский ботаник Броун обнаружил движение спор плауна ( болотного растения), взвешенных в воде.
Вклад М. В. Ломоносова в развитие МКТ (XVIII в.): считает, что теплота – движение корпускул, создает зачатки модели идеального газа, объясняет явления теплопроводности, выдвигает идею о недостижимости самой низкой температуры. Работы Ломоносова остались незамеченными (на них обратили внимание лишь через 100 лет).
Формирование основных понятий статистической физики.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – это явления , связанные с нагреванием или охлаждением тел.
Тепловое движение молекул – это беспорядочное и хаотическое движение молекул.
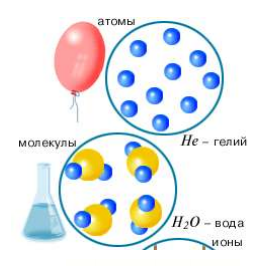
В основе молекулярно-кинетической теории строения вещества лежат три утверждения:
1. Все вещества состоят из частиц. (Возможность механического дробления веществ, растворение вещества в воде, диффузия, сжатие и расширение газов).
2. Частицы хаотично движутся. (Диффузия – явление проникновения молекул одного вещества между молекулами другого вещества. Броуновское движение мелких, взвешенных в жидкости частиц под действием ударов молекул).
3. Частицы взаимодействуют друг с другом: одновременно проявляя силы взаимного притяжения и отталкивания. (Для разрыва твердого тела необходимо некоторое усилие, в то же время твердые и жидкие тела трудно сжимаемы. Капли жидкости, помещенные в непосредственной близости друг от друга, сливаются).
Каждое утверждение строго доказано с помощью опытов.
Оценка размеров молекул.
Разливаем капельку оливкового масла на поверхность воды. Масло никогда не займет всю поверхность, если сосуд велик.
Вопрос. Почему?
Нельзя заставить капельку объёмом 1 мм3 расплыться так, чтобы она занимала площадь поверхности более 0,6 м2.
Объём слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е.
V=S*d
d=0,001 см3/6000 см2 = 1,7*10 см -7.
Размеры молекул больше размеров атомов. Диаметр любого атома примерно равен 10 -8см.
Число молекул.
Подсчитаем число молекул в капле воды массой 1 г объёмом 1 см3
Диаметр молекулы воды равен 3*10 -8 см.
N=1 см 3/(3*10-8)3 см3 =3*1022
-
Закрепление материала
Решение задачи.
Кусочек парафина массой 9 · 10-7 кг, брошенный в горячую воду, расплавился и образовал пленку, площадь поверхности которой 1 м2 . Определить диаметр молекулы парафина, полагая, что толщина пленки равна диаметру молекулы. Плотность парафина 900 кг/м3 . Дано:
m = 9 · 10-7 кг
S = 1 м2
ρ = 900 кг/м3
Решение:
1) d = V/S
2) V = m/ ρ
3) d=m/ ρS=9*10-7/900*1=10-9 м

терминологию: атомы, химические формулы, количество вещества, молярная масса.
Относительная молекулярная масса вещества: Мr= (табличн. значение)
Количество вещества (стр. 101)- определение прочитать, обозначение ν, единица измерения (моль), прочитать, что такое 1 моль.
Число Авогадро (стр. 101) прочитать, записать значение в тетради: NA=6,02∙1023 моль-1,
Молярная масса – масса одного моля вещества, M= Мr∙10-3 кг/моль, М=m0∙NA, где m0 –масса одной молекулы.
Количество вещества (стр. 101) ![]() , где N- о число молекул в данной массе вещества, m – масса вещества.
, где N- о число молекул в данной массе вещества, m – масса вещества.
Число молекул в данной массе вещества ![]()
Масса вещества ![]() =
=![]()
Экспериментально установлено, что атомная единица массы равна 1,6610-27кг. Поскольку в таблице Менделеева указаны относительные атомные массы, то легко вычислить массу любого атома или молекулы. (К доске вызывается один ученик) Например, рассчитать массу молекулы углекислого газа.
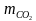 = 1,6610-27кг44 = 73,0410-27кг.
= 1,6610-27кг44 = 73,0410-27кг.
Подведение итогов урока:
Американский физик Рейман считал, что если человечество и плоды его трудов исчезнут и для будущих поколений разрешено будет оставить одну фразу, то это будет следующее:
1. Вещество состоит из частиц;
2. Частицы движутся;
3. Частицы взаимодействуют между собой.
-
Домашнее задание: §55, 56
Повторить терминологию: атомы, химические формулы, количество вещества, молярная масса.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Основные положения Молекулярно-кинетической теории. Размеры молекул. (143.03 KB)
Основные положения Молекулярно-кинетической теории. Размеры молекул. (143.03 KB)
 0
0 277
277 4
4 Нравится
0
Нравится
0




