Скорость химической реакции v.
v гомогенной реакции определяется изменением количества вещества в единицу времени в единице объема (V):
![]()
где ∆ v / V = ∆С (изменение концентрации),
![]()
v гетерогенной реакции определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ (S):
![]()
где ∆v — изменение количества вещества (реагента или продукта), моль, ∆ t — интервал времени, с, мин.
Факторы, влияющие на v (количество соударений частиц и их эффективность).
1) Природа реагентов: состав, строение = энергия активации Еа.
Еа — избыток энергии (по сравнению со средней), необходимый для эффективного соударения реагирующих частиц.
• Чем меньше Еа, тем больше v.
• vр ионного обмена большая, так как Eа мала.
• v(N2 + H2) при о. у. мала, так как Еа велика.
2) Температура: при ↑ t на каждый 10 °С, v ↑ в 2 — 4 раза (правило Вант-Гоффа). При ↑ t, ↑ количество активных частиц (с Eа) и их эффективных соударений.
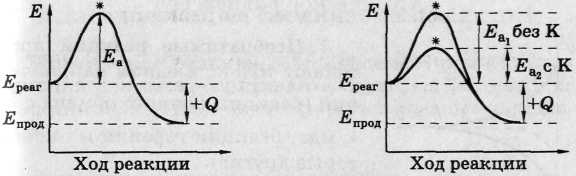
3) Концентрация: чем больше, тем чаще происходят соударения и v ↑. При постоянной t для реакции
тА + пВ = D, происходящей в одну стадию, ![]() (закон действующих масс), k — константа скорости, k = v при
(закон действующих масс), k — константа скорости, k = v при ![]() (C-const твердое вещество и входит в k ).
(C-const твердое вещество и входит в k ).
4) Катализаторы — вещества, которые изменяют
механизм реакции, уменьшают Еа = v ↑.
• Катализаторы остаются неизменными по окончанию реакции.
• Катализ — влияние катализатора на v.
• Реакции в присутствии катализатора каталитические.
Механизм действия катализатора.
• Без К:
![]()
• С участием К:
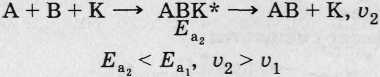
• Ферменты — биологические К, по природе белки.
• Ингибиторы — вещества, которые ↓ v.
5) Для гетерогенных реакций v зависит также:
• от состояния поверхности,
• от характера образующихся продуктов,
• от подвода исходных веществ и отвода продуктов и др.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Опорный конспект "Скорость химической реакции. Факторы, влияющие на скорость химической реакции" (50.43 KB)
Опорный конспект "Скорость химической реакции. Факторы, влияющие на скорость химической реакции" (50.43 KB)
 0
0 141
141 3
3 Нравится
0
Нравится
0


