
Химические свойства
Способы получения
900igr.net
Классификация оксидов по химическим свойствам
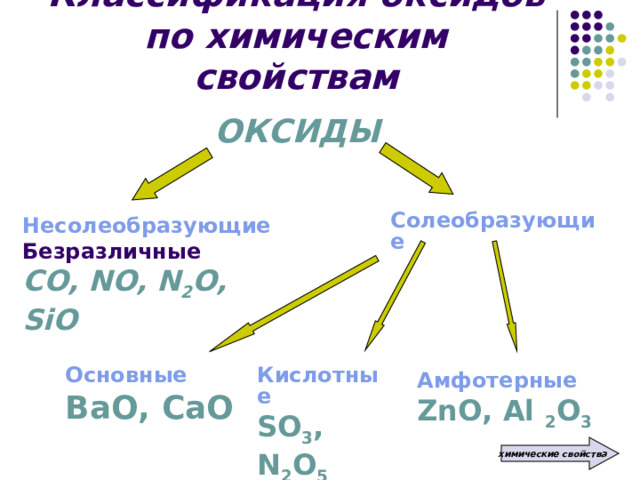
ОКСИДЫ
Солеобразующие
Несолеобразующие
Безразличные
СО, NO, N 2 O, SiO
Основные
Кислотные
ВаО, СаО
SO 3 , N 2 O 5
Амфотерные
ZnO, Al 2 O 3
химические свойства

Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей
СО, NO, N 2 O, SiO

Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды

Основные оксиды – это оксиды, которым в качестве гидроксидов соответствуют основания
- Образованы металлами в степени окисления +1, +2
К 2 О → КОН
MgO → Mg(OH) 2

Кислотные оксиды – это оксиды, которым в качестве гидроксидов соответствуют кислоты
- Образованы неметаллами и металлами в степени окисления +5 и выше
S О 3 → Н 2 S О 4

Амфотерные оксиды – это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот
- Образованы металлами в степени окисления +3, +4, а также оксиды ВеО, ZnO, SnO, PbO
ZnO → Zn(OH) 2 или Н 2 Zn О 2

Химические свойства основных оксидов
- основной оксид + вода = основание
Са O + H 2 O = Са( O Н) 2
- основный оксид + кислота = соль + вода
CuO + 2 HCL = CuCL 2 + H 2 O
- основный оксид + кислотный оксид = соль
MgO + SO 3 = MgSO 4

Химические свойства кислотных оксидов
- кислотный оксид + вода = кислота
Р 2 O 5 + 3 H 2 O = 2 H 3 Р O 4
- кислотный оксид + основание = соль + вода
CO 2 + Mg ( O Н) 2 = MgCO 3 + H 2 O
- кислотный оксид + основный оксид = соль
SO 3 + MgO = MgSO 4

Химические свойства амфотерных оксидов
Основные
- С кислотами: ZnO + 2НС l → Zn С l 2 + Н 2 О
- С кислотными оксидами: ZnO + SiO 2 = ZnSiO 3
Кислотные
- С основаниями: ZnO + 2 Na ОН = Na 2 ZnO 2 +Н 2 О
- С основными оксидами: ZnO + Mg О = MgZnO 2
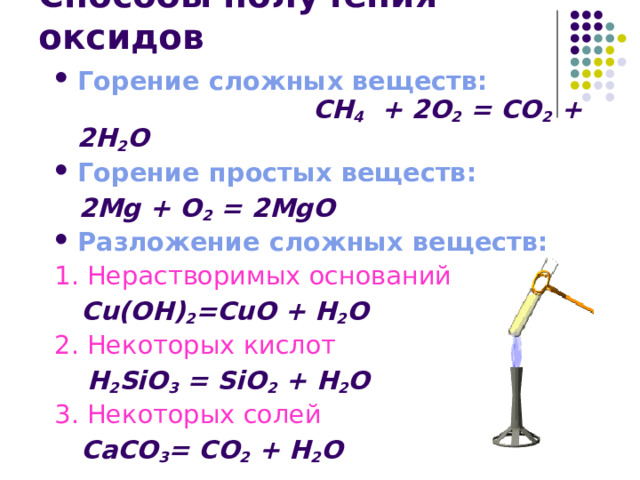
Способы получения оксидов
- Горение сложных веществ: СН 4 + 2О 2 = СО 2 + 2Н 2 О
- Горение простых веществ:
2 Mg + О 2 = 2 Mg О
- Разложение сложных веществ:
1. Нерастворимых оснований
Cu ( O Н) 2 = Cu О + H 2 O
2. Некоторых кислот
H 2 SiO 3 = SiO 2 + H 2 O
3. Некоторых солей
СаСО 3 = СО 2 + Н 2 О

 Получите свидетельство
Получите свидетельство Вход
Вход











 Оксиды, их химические свойства (437 KB)
Оксиды, их химические свойства (437 KB)
 0
0 709
709 22
22 Нравится
0
Нравится
0



