Занятие №23
ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ЗНАНИЙ ПО РАЗДЕЛУ «МОЛЕКУЛЯРНАЯ ФИЗИКА»
Цели:
Образовательные: обобщить и систематизировать знания по разделу «Молекулярная физика»; выявить уровень овладения системой знаний и умений, опытом творческой деятельности;
Развивающие: выработка умения самостоятельно анализировать учебный материал и выделять нужную информацию; развитие мышления и монологической речи (в ходе отбора материала и представления его классу);
Воспитательные: воспитание культуры учебного труда; формирование культуры общения (умения слушать и слышать, аргументированно возражать, тактично делать замечания).
Тип занятия: обобщение и систематизация знаний.
Форма организации познавательной деятельности учащихся: парная, индивидуально – обособленная, фронтальная.
Основной методологический подход к организации учебного процесса на занятии: системно – структурны й.
ПЛАН ЗАНЯТИЯ
1. Организационный момент
2. Актуализация опорных знаний
3. Целеполагание
4. Решение задач
5. Домашнее задание
6. Рефлексия
1. Организационный момент. Выявление готовности группы к занятию.
2. Актуализация опорных знаний.
– Назовите основные положения МКТ. (В основе МКТ лежат три положения: 1. Вещество имеет дискретное строение, т. е. состоит из микроскопических частиц; 2. Частицы вещества хаотически движутся; 3. Частицы вещества взаимодействуют между собой.
– Что такое концентрация? (Концентрация – величина, равная отношению числа частиц N к занимаемому ими объему V: n = 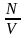 ).
).
– Как определяется количество вещества? (Количества вещества  определяют отношением числа частиц этого вещества N к постоянной Авогадро
определяют отношением числа частиц этого вещества N к постоянной Авогадро  :
:  =
=  ).
).
– Что такое молярная масса и как ее найти? (Молярная масса – масса вещества, взятого в количестве  = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству
= 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству 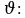 M =
M =  ).
).
– Каким соотношением молярная масса вещества связана с относительной молекулярной массой? (Молярная масса вещества связана с его относительной молекулярной массой следующим соотношением: 


 ).
).
– По какой формуле можно найти число молекул в веществе? (Число N молекул в данном веществе можно найти по формуле: N =  =
= 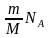 =
=  ).
).
– Какой газ называется идеальным? (Идеальный газ – модель газа, удовлетворяющая следующим условиям: 1) молекулы газа можно считать материальными точками, которые хаотически движутся; 2) силы взаимодействия между молекулами идеального газа практически отсутствуют; они не действуют только при столкновениях молекул, причем эти силы отталкиваются).
– Какое уравнение называют основным уравнением МКТ идеального газа? (Уравнение, связывающее микропараметры состояния идеального газа с его макропараметрами, непосредственно измеряемым на опыте, называют основным уравнением МКТ идеального газа: p =  n
n ).
).
– От чего зависит давление идеального газа? (Давление идеального газа зависит от средней кинетической энергии поступательного движения его молекул и их концентрации: p =  n
n ).
).
– Что называют тепловым равновесием? (Тепловым равновесием называют такое состояние изолированной физической системы, при котором все ее макроскопические параметры остаются неизменными с течением времени).
– Чему равна средняя кинетическая энергия поступательного движения? (Средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре:  =
= 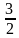 kT).
kT).
– Чему равна средняя квадратичная скорость молекул газа? (Средняя квадратичная скорость молекул газа равна  =
=  ).
).
– Чему равно давление идеального газа? (Давление идеального газа прямо пропорционально концентрации его молекул и абсолютной температуре газа: p = nkT).
– Каким соотношением связана температура по шкале Кельвина с температурой по шкале Цельсия? (Температура по шкале Кельвина (Т) приближенно связана с температурой по шкале Цельсия (t) соотношением:
T = t + 273).
– Сформулируйте закон Дальтона. (Давление смеси химически не реагирующих между собой разреженных газов равно сумме парциальных давлений каждого из газов: p =  +
+  + . . . +
+ . . . + ).
– Как выглядит уравнение состояния идеального газа? (При постоянных массе и молярной массе идеального газа отношение произведения давления газа и его объема к абсолютной температуре является величиной постоянной: = const, pV =
RT).
– Как связаны давление и объем идеального газа при изотермическом процессе? (Давление данной массы идеального газа при постоянных молярной массе и температуре обратно пропорционально объему газа:
p = ).
– Как связаны объем и температура идеального газа при изобарном процессе? (Объем данной массы идеального газа при постоянных молярной массе и давлении прямо пропорционален абсолютной температуре:
V = const T).
– Как связаны давление и температура идеального газа при изохорном процессе? (Давление данной массы идеального газа при постоянных молярной массе и объеме прямо пропорционально абсолютной температуре: p = const T).
– Что называют коэффициентом поверхностного натяжения? (Работу внешних сил по увеличению площади поверхности жидкости на единицу площади при сохранении объема и температуры жидкости неизменными называют коэффициентом поверхностного натяжения: =
).
– Чему равно поверхностное натяжение? (Поверхностное натяжение численно равно отношению модуля силы поверхностного натяжения, действующей на прямолинейный участок границы поверхностного слоя жидкости, к длине этого участка: =
).
– От чего зависит высота подъема жидкости в капилляре? (Высота подъема жидкости в капилляре зависит от поверхностного натяжения жидкости, плотности жидкости и внутреннего радиуса капилляра: h = ).
– Какую величину называют абсолютной влажностью воздуха? (Абсолютной влажностью воздуха называют физическую величину, равную плотности водяного пара, находящегося в воздухе при данных условиях).
– Какую величину называют относительной влажностью воздуха? (Относительной влажностью воздуха называют физическую величину, равную отношению абсолютной влажности к плотности насыщенного водяного пара при данной температуре: =
 100
100 ).
3. Целеполагание. Цель данного занятия: обобщить и систематизировать знания по разделу «Молекулярная физика»; выявить уровень овладения системой знаний и умений, опытом творческой деятельности.
4. Решение задач.
Задача 1. Каково количество вещества (в молях), содержащегося в 1 г воды?
Дано: Решение:
М( = 1 г =
 кг/моль
кг/моль  =
=
М(Н) = 1 г/моль = Химическая формула воды , поэтому
=  кг/моль
кг/моль = 2
+
.
М(О) = 16г/моль =  =
= ,
= 1,6

кг/моль
 =
= = 0,056 (моль).
 – ?
– ?
Ответ:  = 0,056 (моль).
= 0,056 (моль).
Задача 2. Молярная масса азота равна 0,028 кг/моль. Чему равна масса молекулы азота?
Дано: Решение:
= 0, 028 кг/моль
=
, где
– масса одной молекулы,
 = 6,022
= 6,022 
m – масса всего вещества,
– ? N – число молекул вещества.
N =
=
=
= = = 0,465

.
Задача 3. В колбе объемом 1,2 л содержится 3 
атомов гелия. Какова средняя кинетическая энергия каждого атома? Давление газа в колбе
Па?
Дано: Решение:
V = 1,2 л = 1,2 
p =
 n
n , где n =
, где n = 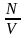 – концентрация газа.
– концентрация газа.
N = 3

атомов Поэтому
 =
=
p = Па
 =
=
 – ?
– ?  = = 6
= = 6 
(Дж).
Ответ:  = 6
= 6 
(Дж).
Задача 4. Какова средняя кинетическая энергия атома аргона, если температура газа 17 ?
Дано: Решение:
t = 17 Средняя кинетическая энергия
k = 1,38

вычисляется по формуле:
 =
= 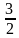 kT
kT
 – ? T = 273 + t
– ? T = 273 + t
T = 273 + 17 = 290 К
 = = 6
= = 6 
(Дж).
Ответ:  = 6
= 6 
(Дж).
Задача 5. Современные вакуумные насосы позволяют понижать давление до 1,3 
Па (
мм. рт. ст.). Сколько молекул газа содержится в 1 см3 при указанном давлении и температуре 27
?
Ответ: N = 3,14  104 молекул.
104 молекул.
Задача 6. Газ сжат изотермически от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на p = 4 кПа. Каким было начальное давление p1?
Ответ: p1 = 12 кПа.
Задача 7. Плотность некоторого газообразного вещества равна 2,5 кг/м3 при температуре 10 и нормальном атмосферном давлении. Найдите молярную массу этого вещества.
Ответ: М = 0,058 кг/моль.
Задача 8. В комнате объемом V = 120 м3 при температуре t = 15 относительная влажность воздуха
= 60
. Определите массу водяных паров в воздухе комнаты. Давление насыщенных паров
при t = 15
равно 12,8 мм. рт. ст.
Ответ: mn = 0,92 кг.
5. Домашнее задание. Подготовиться к контрольной работе.
6. Рефлексия.
2

 Получите свидетельство
Получите свидетельство Вход
Вход












 Обобщение и систематизация знаний по разделу «молекулярная физика» (188.61 KB)
Обобщение и систематизация знаний по разделу «молекулярная физика» (188.61 KB)
 0
0 160
160 3
3 Нравится
0
Нравится
0


