Методические указания
к выполнению внеаудиторной самостоятельной работы
по дисциплине «Химия»
|
|
|
| Составитель: О.А.Норикова | преподаватель дисциплины «Химия» |
|
|
|
Содержание
| 1. Пояснительная записка | 6 |
| 2. Раздел 1. Общая и неорганическая химия |
|
| Тема 1.1. Основные понятия и законы химии |
|
| Самостоятельная работа № 1. Решение задач с применением закона Авогадро | 10 |
| Самостоятельная работа № 2. Вычисление формулы вещества и массовой доли элемента в сложном веществе | 11 |
| Самостоятельная работа № 3. Вычисление массы и количества вещества | 12 |
| Самостоятельная работа № 4. Вычисление массовой доли элемента в сложном веществе | 13 |
| Тема 1.2. Периодический закон и Периодическая система химических элементов Д.И.Менделеева и строение атома |
|
| Самостоятельная работа № 5. Составление электронных формул атомов химических элементов | 13 |
| Самостоятельная работа № 6. Характеристика простого вещества и образуемых им соединений на основании положения в Периодической системе химических элементов | 16 |
| Самостоятельная работа № 7. Подготовка отчета по лабораторной работе: Моделирование построения Периодической таблицы химических элементов | 17 |
| Тема 1.3. Строение вещества |
|
| Самостоятельная работа № 8. Составление схем образования ионной связи | 18 |
| Самостоятельная работа № 9. Составление схем образования ковалентной связи | 19 |
| Самостоятельная работа № 10. Составление творческого отчета по теме: Свойства веществ (металлы, газы, жидкости) в зависимости от их строения | 20 |
| Самостоятельная работа № 11. Определение чистых веществ и смесей | 21 |
| Самостоятельная работа № 12. Определение массовой доли вещества в растворе | 22 |
| Самостоятельная работа № 13. Подготовка отчета по лабораторной работе: Приготовление дисперсных систем | 23 |
| Тема 1.4. Вода. Растворы. Электролитическая диссоциация |
|
| Самостоятельная работа № 14. Решение задач на вычисление массы растворенного вещества | 24 |
| Самостоятельная работа № 15. Подготовка отчета по практической работе: Приготовление растворов заданной концентрации | 25 |
| Самостоятельная работа № 16. Составление уравнений электролитической диссоциации | 26 |
| Тема 1.5. Классификация неорганических соединений и их свойства |
|
| Самостоятельная работа № 17. Составление уравнений химических реакций, характеризующих свойства кислот | 27 |
| Самостоятельная работа № 18. Составление уравнений химических реакций, характеризующих свойства оснований | 28 |
| Самостоятельная работа № 19. Составление уравнений химических реакций, характеризующих свойства солей и оксидов | 29 |
| Самостоятельная работа № 20. Подготовка отчета по лабораторной работе: Изучение свойств неорганических кислот и оснований | 29 |
| Самостоятельная работа № 21. Подготовка отчета по лабораторной работе: Изучение свойств солей | 30 |
| Тема 1.6. Химические реакции |
|
| Самостоятельная работа № 22. Составление ионных уравнений химических реакций | 31 |
| Самостоятельная работа № 23. Определение окислителя и восстановителя в окислительно-восстановительных реакциях | 32 |
| Самостоятельная работа № 24. Определение скорости химических реакций | 33 |
| Самостоятельная работа № 25. Составление творческого отчета по теме: Рекомендации по изменению условий проведения химических реакций, лежащих в основе конкретного производства, с целью увеличения выхода продукта реакции | 34 |
| Тема 1.7. Металлы и неметаллы |
|
| Самостоятельная работа № 26. Составление творческого отчета по теме: Виды коррозии и способы защиты металлов от коррозии | 35 |
| Самостоятельная работа № 27. Составление творческого отчета по теме: Металлургическое производство Челябинской области | 35 |
| Самостоятельная работа № 28. Подготовка отчета по практической работе: Решение задач на определение сплава черного металла | 36 |
| Самостоятельная работа № 29. Выполнение реферата на тему: Цветная металлургия Челябинской области | 37 |
| Самостоятельная работа № 30. Определение коэффициентов в реакциях методом электронного баланса | 39 |
| 3. Раздел 2. Органическая химия |
|
| Тема 2.1. Основные понятия органической химии и теория строения органических веществ |
|
| Самостоятельная работа № 1. Определение изомеров углеводородов | 41 |
| Самостоятельная работа № 2. Подготовка отчета по практической работе: Составление изомеров и формул органических веществ | 41 |
| Самостоятельная работа № 3. Определение названий алканов по рациональной и международной номенклатуре | 42 |
| Самостоятельная работа № 4. Составление уравнений реакций и их классификация в органической химии | 43 |
| Тема 2.2. Углеводороды и их природные источники |
|
| Самостоятельная работа № 5. Составление уравнений химических реакций, характеризующих свойства алканов | 44 |
| Самостоятельная работа № 6. Определение названий алкенов по международной номенклатуре | 44 |
| Самостоятельная работа № 7. Определение названий алкадиенов по международной номенклатуре | 45 |
| Самостоятельная работа № 8. Подготовка отчета по практической работе: Составление формул и названий алканов, алкенов, алкадиенов | 46 |
| Самостоятельная работа № 9. Составление формул и названий алкинов по международной номенклатуре | 47 |
| Самостоятельная работа № 10. Составление формул и названий ароматических углеводородов по международной номенклатуре | 47 |
| Самостоятельная работа № 11. Составление творческого отчета по теме: Использование нефтепродуктов и альтернативных видов топлива и энергии | 49 |
| Самостоятельная работа № 12. Подготовка отчета по лабораторной работе: Ознакомление с коллекцией образцов нефти и продуктов ее переработки | 50 |
| Тема 2.3. Кислородсодержащие органические соединения |
|
| Самостоятельная работа № 13. Решение задач на определение выхода продукта реакции в процентах от теоретического | 50 |
| Самостоятельная работа № 14. Подготовка отчета по практической работе: Составление формул и названий спиртов | 51 |
| Самостоятельная работа № 15. Составление уравнений реакций получения альдегидов, составление структурных формул карбоновых кислот | 52 |
| Самостоятельная работа № 16. Подготовка отчета по лабораторной работе: Свойства глицерина. Свойства уксусной кислоты | 53 |
| Самостоятельная работа № 17. Подготовка отчета по практической работе: Составление формул и названий альдегидов, карбоновых кислот | 53 |
| Самостоятельная работа № 18. Составление творческого отчета по теме: Сравнительная характеристика мыла и синтетических моющих средств | 54 |
| Самостоятельная работа № 19. Выполнение реферата на тему: Биологическое значение кислородсодержащих органических соединений | 55 |
| Тема 2.4. Азотсодержащие органические соединения. Полимеры |
|
| Самостоятельная работа № 20. Составление схем генетических связей органических и неорганических веществ | 57 |
| Самостоятельная работа № 21. Выполнение реферата на тему: Строение и функции белков | 58 |
| Самостоятельная работа № 22. Подготовка отчета по лабораторной работе: Свойства белков | 60 |
| Самостоятельная работа № 23. Подготовка отчета по практической работе: Распознавание пластмасс и волокон | 61 |
| Учебно-методическое и информационное обеспечение | 63 |
1. Пояснительная записка
Методические указания к выполнению внеаудиторной самостоятельной работы студентов по дисциплине «Химия» предназначены для студентов по профессиям: 08.01.06 «Мастер сухого строительства», 08.01.18 «Электромонтажник электрических сетей и электрооборудования», 15.01.05 «Сварщик», 22.01.03 «Машинист крана металлургического производства», 23.01.03 «Автомеханик», 23.01.07 «Машинист крана», 23.01.09 «Машинист локомотива»; по специальностям 21.02.05 «Земельно-имущественные отношения», 22.02.06 «Сварочное производство», 23.02.03 «Техническое обслуживание и ремонт автомобильного транспорта».
Цель методических указаний: оказание помощи студентам в выполнении самостоятельной работы по дисциплине «Химия».
Настоящие методические указания содержат работы, которые позволят студентам самостоятельно овладеть фундаментальными знаниями, профессиональными умениями и навыками деятельности по специальности, опытом творческой и исследовательской деятельности и направлены на формирование следующих компетенций:
1. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
2. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
3. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
4. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
5. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
6. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
7. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
8. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
В результате выполнения самостоятельной работы по дисциплине «Химия» студенты должны уметь:
должны знать:
значение химии в профессиональной деятельности и при освоении профессиональной образовательной программы;
основные решения прикладных задач в области профессиональной деятельности;
основные понятия химии и способы проведения химического эксперимента.
Перечень видов самостоятельной работы представлен в таблице 1.
Таблица 1. Виды самостоятельной работы
| № темы | Кол-во часов | Вид самостоятельной работы | Форма контроля |
| 1.1 | 1 | Решение задач с применением закона Авогадро | объяснение алгоритма решения |
|
| 1 | Вычисление формулы вещества и массовой доли элемента в сложном веществе | объяснение алгоритма решения |
|
| 1 | Вычисление массы и количества вещества | объяснение алгоритма решения |
| № темы | Кол-во часов | Вид самостоятельной работы | Форма контроля |
|
| 1 | Вычисление массовой доли элемента в сложном веществе | объяснение алгоритма решения |
| 1.2 | 1 | Составление электронных формул атомов химических элементов | объяснение алгоритма решения |
|
| 1 | Характеристика простого вещества и образуемых им соединений на основании положения в Периодической системе химических элементов | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по лабораторной работе: Моделирование построения Периодической таблицы химических элементов | зашита отчета по лабораторной работе |
| 1.3 | 1 | Составление схем образования ионной связи | объяснение алгоритма решения |
|
| 1 | Составление схем образования ковалентной связи | объяснение алгоритма решения |
|
| 1 | Составление творческого отчета по теме: Свойства веществ (металлы, газы, жидкости) в зависимости от их строения | защита творческой работы |
|
| 1 | Определение чистых веществ и смесей | объяснение алгоритма решения |
|
| 1 | Определение массовой доли вещества в растворе | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по лабораторной работе: Приготовление дисперсных систем | зашита отчета по лабораторной работе |
| 1.4 | 1 | Решение задач на вычисление массы растворенного вещества | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по практической работе: Приготовление растворов заданной концентрации | зашита отчета по практической работе |
|
| 1 | Составление уравнений электролитической диссоциации | объяснение алгоритма решения |
| 1.5 | 1 | Составление уравнений химических реакций, характеризующих свойства кислот | объяснение алгоритма решения |
|
| 1 | Составление уравнений химических реакций, характеризующих свойства оснований | объяснение алгоритма решения |
|
| 1 | Составление уравнений химических реакций, характеризующих свойства солей и оксидов | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по лабораторной работе: Изучение свойств неорганических кислот и оснований | зашита отчета по лабораторной работе |
|
| 0,5 | Подготовка отчета по лабораторной работе: Изучение свойств солей | зашита отчета по лабораторной работе |
| 1.6 | 1 | Составление ионных уравнений химических реакций | объяснение алгоритма решения |
|
| 2 | Определение окислителя и восстановителя в окислительно-восстановительных реакциях | объяснение алгоритма решения |
|
| 1 | Определение скорости химических реакций | объяснение алгоритма решения |
| № темы | Кол-во часов | Вид самостоятельной работы | Форма контроля |
|
| 1 | Составление творческого отчета по теме: Рекомендации по изменению условий проведения химических реакций, лежащих в основе конкретного производства, с целью увеличения выхода продукта реакции | защита творческого отчета |
| 1.7 | 1 | Составление творческого отчета по теме: Виды коррозии и способы защиты металлов от коррозии | защита творческого отчета |
|
| 1 | Составление творческого отчета по теме: Металлургическое производство Челябинской области | защита творческого отчета |
|
| 0,5 | Подготовка отчета по практической работе: Решение задач на определение сплава черного металла | зашита отчета по практической работе |
|
| 2 | Выполнение реферата на тему: Цветная металлургия Челябинской области | защита реферата |
|
| 2 | Определение коэффициентов в реакциях методом электронного баланса | объяснение алгоритма решения |
| 2.1 | 1 | Определение изомеров углеводородов | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по практической работе: Составление изомеров и формул органических веществ | зашита отчета по практической работе |
|
| 1 | Определение названий алканов по рациональной и международной номенклатуре | объяснение алгоритма решения |
|
| 1 | Составление уравнений реакций и их классификация в органической химии | объяснение алгоритма решения |
| 2.2 | 1 | Составление уравнений химических реакций, характеризующих свойства алканов | объяснение алгоритма решения |
|
| 1 | Определение названий алкенов по международной номенклатуре | объяснение алгоритма решения |
|
| 1 | Определение названий алкадиенов по международной номенклатуре | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по практической работе: Составление формул и названий алканов, алкенов, алкадиенов | зашита отчета по практической работе |
|
| 1 | Составление формул и названий алкинов по международной номенклатуре | объяснение алгоритма решения |
|
| 1 | Составление формул и названий ароматических углеводородов по международной номенклатуре | объяснение алгоритма решения |
|
| 1 | Составление творческого отчета по теме: Использование нефтепродуктов и альтернативных видов топлива и энергии | защита творческого отчета |
|
| 0,5 | Подготовка отчета по лабораторной работе: Ознакомление с коллекцией образцов нефти и продуктов ее переработки | зашита отчета по лабораторной работе |
| 2.3 | 1 | Решение задач на определение выхода продукта реакции в процентах от теоретического | объяснение алгоритма решения |
| № темы | Кол-во часов | Вид самостоятельной работы | Форма контроля |
|
| 0,5 | Подготовка отчета по практической работе: Составление формул и названий спиртов | зашита отчета по практической работе |
|
| 1 | Составление уравнений реакций получения альдегидов, составление структурных формул карбоновых кислот | объяснение алгоритма решения |
|
| 0,5 | Подготовка отчета по лабораторной работе: Свойства глицерина. Свойства уксусной кислоты | зашита отчета по лабораторной работе |
|
| 0,5 | Подготовка отчета по практической работе: Составление формул и названий альдегидов, карбоновых кислот | зашита отчета по практической работе |
|
| 1 | Составление творческого отчета по теме: Сравнительная характеристика мыла и синтетических моющих средств | защита творческого отчета |
|
| 2 | Выполнение реферата на тему: Биологическое значение кислородсодержащих органических соединений | защита реферата |
| 2.4 | 1 | Составление схем генетических связей органических и неорганических веществ | объяснение алгоритма решения |
|
| 2 | Выполнение реферата на тему: Строение и функции белков | защита реферата |
|
| 0,5 | Подготовка отчета по лабораторной работе: Свойства белков | зашита отчета по лабораторной работе |
|
| 0,5 | Подготовка отчета по практической работе: Распознавание пластмасс и волокон | зашита отчета по практической работе |
2. Раздел 1. Общая и неорганическая химия
Тема 1.1. Основные понятия и законы химии
Самостоятельная работа № 1
Тема: «Решение задач с применением закона Авогадро»
Цель работы: развитие умений и навыков по вычислению числа атомов и молекул вещества.
Основной теоретический материал
Относительная атомная масса элемента – это величина, показывающая, во сколько раз масса его атома больше 1/12 массы атома углерода.
Например, относительная масса железа равна 56. Это означает, что атом железа 56Fе в 56 раз тяжелее 1/12 массы атома углерода.
Относительную атомную массу обозначают Аr. Например, Аr(О) = 16, Аr(С) = 12, Аr(Н) = 1. Каждый элемент имеет свое значение относительной атомной массы.
Аналогично относительную молекулярную массу вещества обозначают Мr, например Мr(Н2О) = 18.
Аr и Мr – величины, которые не имеют единиц измерения.
Чтобы узнать относительную молекулярную массу вещества нужно просто сложить относительные атомные массы элементов, образующих вещество, с учетом числа атомов, например:
Мr(Н2О) = 2Аr(Н) + Аr(О) = 2.1 + 16 = 18. (1)
Молярная масса М вещества представляет собой отношение его массы к количеству вещества:
М =m/n. (2)
где m — масса в граммах, n — количество вещества в молях, М — молярная масса в г/моль — постоянная величина для каждого данного вещества.
Моль - это количеству вещества, содержащего столько же структурных частиц данного вещества, сколько атомов содержится в изотопе углерода массой 12 г.
Определение, данное молю, опирается на число структурных частиц, содержащихся в 12 г углерода. Было установлено, что указанная масса углерода содержит 6,02·1023 атомов этого элемента. Следовательно, любой химический индивид количеством 1 моль содержит 6,02·1023 структурных частиц (атомов или молекул).
Число NA=6,02·1023 носит название постоянной Авогадро и выведено с использованием закона Авогадро. Постоянная Авогадро имеет размерность - моль-1.
Закон Авогадро: одинаковые объемы различных газов при одинаковых условиях (давлении и температуре) содержат одинаковое число молекул.
Большое практическое значение имеет следствие из закона Авогадро: при нормальных условиях (н.у.) один моль любого газа занимает объем, равный 22,4 л.
Объем 22,4 л называют молярным (мольным) объемом газа и обозначают соответственно VM = 22,4 л/моль.
Так, 6,02∙1023 молекул (1 моль) любого газа и любой смеси газов (при н.у.) занимает объём равный 22,4 л.
Задание:
Задания представлены на стр.9 № 21, 22 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 2
Тема: «Вычисление формулы вещества и массовой доли элемента в сложном веществе»
Цель работы: развитие умений и навыков по вычислению формулы вещества массовой доли элемента в сложном веществе.
Основной теоретический материал
Массовая доля элемента в веществе находится по формуле:
w(Э) = (n. Ar(Э)/ Mr(в-ва), (3)
где w(Э) – массовая доля элемента Э в веществе;
n – число атомов элемента Э в веществе;
Ar(Э) – относительная атомная масса элемента Э;
Mr(в-ва) – относительная молекулярная масса вещества.
Решение типовых заданий
1. Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
| Дано: Фосфорная кислота H3PO4 | Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты Ar(H)=1
Ar(P)=31
Ar(O)=16 2. Вычисляем относительную атомную массу соединения Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100% Подставляем значения, 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
2. Найти эмпирическую формулу вещества, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
| Дано:
w(Na) = 43,4%
w(C)=11,3%
w(O)=45,3% | Решение:
Пусть числа атомов натрия, углерода и кислорода в эмпирической формуле равны соответственно х, у и z — NaxCyOz Атомные массы Na, С и О равны 23, 12 и 16
23x:12y:16z=43,4:11,3:45,3
x:y:z=43,4/23:11,3/12:45,3/16=1.88:0,94:2,82
x:y:z=1,88/0,94:0,94/0,94:2,82/0,94=2:1:3 Ответ:Эмпирическая формула вещества Na2CO3. |
| Найти: NaxCyOz -? |
Задание:
Задания представлены на стр.16-18 № 11, 50 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 3
Тема: «Вычисление массы и количества вещества»
Цель работы: развитие умений и навыков по вычислению массы и количества вещества.
Основной теоретический материал
Материал представлен в самостоятельной работе № 1.
Решение типовых заданий
Вычислите массу железа, взятого количеством вещества 0,5 моль.
| Дано: n(Fe)=0,5 моль | Решение: m = M · n M(Fe) = Ar(Fe) = 56 г/моль (Из периодической системы) m (Fe) = 56 г/моль · 0,5 моль = 28 г Ответ: m (Fe) =28 г |
| Найти: m(Fe) - ?
|
Задание:
Задания представлены на стр.16 № 4, 5, 6 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 4
Тема: «Вычисление массовой доли элемента в сложном веществе»
Цель работы: развитие умений и навыков по вычислению массовой доли элемента в сложном веществе.
Основной теоретический материал
Материал представлен в самостоятельной работе № 2.
Задание:
Задания представлены на стр.16 № 1, 2, 3 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Тема 1.2. Периодический закон и Периодическая система химических элементов Д.И.Менделеева и строение атома
Самостоятельная работа № 5
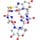
Тема: «Составление электронных формул атомов химических элементов»
Цель работы: развитие умений и навыков по составлению графических электронных формул атомов химических элементов.
Основной теоретический материал
Под электронной оболочкой понимают совокупность всех электронов в атоме. Число электронов в атоме, как электронейтральной частице, равно числу протонов, т. е. порядковому номеру элемента.
Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень.
Число энергетических уровней в атоме равно номеру периода в таблице Д. И. Менделеева, в котором располагается химический элемент: у атомов элементов 1-го периода — один уровень, 2-го периода — два, 7-го периода — семь.
Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве. Он может находиться в любой части этого пространства, окружающего ядро. Совокупность различных положений электрона рассматривают как электронное облако с определенной плотностью отрицательного заряда.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называют орбиталью или электронным облаком.
Из существующих четырех типов орбиталей (s, р, d и f) познакомимся с первыми тремя типами, s-орбитали имеют сферическую форму, р-орбитали — форму гантели или объемной восьмерки, а d-орбитали — форму листа клевера.

Рисунок 1. Типы орбиталей
В атомах химических элементов первый уровень составляет одна s-орбиталь, на которой находятся два s-электрона. Второй энергетический уровень также содержит s-орбиталь, но большего размера, так как запас энергии электронов на ней выше, чем у электронов первого уровня. Кроме того, на втором уровне содержатся также и три р-орбитали. Третий энергетический уровень, помимо одной s- и трех р-орбиталей, содержит пять d-орбиталей.
Каждую орбиталь могут занимать два электрона. Следовательно, максимальное число электронов, которые могут поместиться на первом уровне, равно 2, на втором — 8 (2 на одной s-орбитали и 6 на трех р-орбиталях), на третьем — 18 (2 на s-орбитали, 6 на р-орбитали и 10 на d-орбитали).
В зависимости от того, на какой орбитали находится последний электрон, химические элементы можно разделить на семейства: s, p. d и f.
К s-элементам относят элементы главных подгрупп 1 и II групп Периодической системы Д. И. Менделеева, а также гелий.
К р-элементам относят элементы главных подгрупп Ш—VШ групп Периодической системы Д. И. Менделеева.
К d-элементам относят элементы побочных подгрупп I—VIII групп Периодической системы Д. И. Менделеева.
Принадлежность химического элемента к тому или иному электронному семейству можно определить по электронной конфигурации, (электронной формуле), которая показывает расположение электронов на энергетических уровнях и орбиталях атомов.



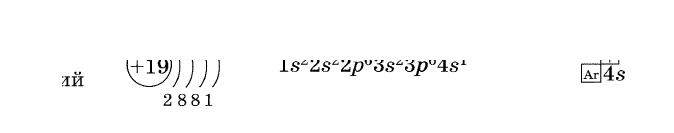
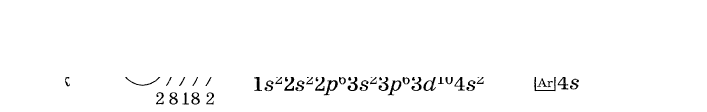
Рисунок 2. Графические электронные формулы атомов
водорода, гелия, лития, калия, цинка
Задание:
Задания представлены на стр.28-29 № 24, 43 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 6
Тема: «Характеристика простого вещества и образуемых им соединений на основании положения в Периодической системе химических элементов»
Цель работы: развитие умений и навыков работы с Периодической системой химических элементов.
Основной теоретический материал
Периодическая система богата периодическими закономерностями: кроме горизонтальной периодичности (по периодам), есть вертикальная (по группам) и диагональная.
Менделеев Д.И. выделил периоды, в которых свойства химических элементов и образованных ими веществ закономерно изменяются. Рассмотрим эти изменения.
1. Металлические свойства простых веществ ослабевают и сменяются неметаллическими, которые наиболее ярко выражены у галогенов.
2. Значение степени окисления атомов элементов в высших оксидах возрастает от +1 до +7.
3. Значения степени окисления атомов элементов в гидридах и в летучих водородных соединениях возрастает сначала от +1 до +3 и затем от _-4 до -1:
 . (4)
. (4)
4. Основные оксиды, образованные химическими элементами начала периода, сменяет амфотерный оксид и далее – кислотные оксиды, свойства которых усиливаются:
 . (5)
. (5)
5. Гидроксиды-основания через амфотерный гидроксид сменяются все более сильными гидроксидами-кислотами:
 . (6)
. (6)
Вертикальная периодичность:
1. В группах с ростом порядковых номеров элементов усиливаются металлические свойства образуемых ими простых веществ и ослабевают неметаллические свойства.
2. Усиливается основный характер оксидов и гидроксидов.
3. Уменьшается прочность летучих водородных соединений и усиливаются их кислотные свойства.
Под диагональной периодичностью понимают повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга в Периодической системе.
Задание:
Задания представлены на стр.33-34 № 1, 7, 14 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 7
Тема: «Подготовка отчета по лабораторной работе: Моделирование построения Периодической таблицы химических элементов»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Тема 1.3. Строение вещества
Самостоятельная работа № 8
Тема: «Составление схем образования ионной связи»
Цель работы: развитие умений и навыков по составлению схем образования ионной связи.
Основной теоретический материал
Ионная химическая связь — это связь, образующаяся между катионами и анионами за счет их электростатического притяжения.
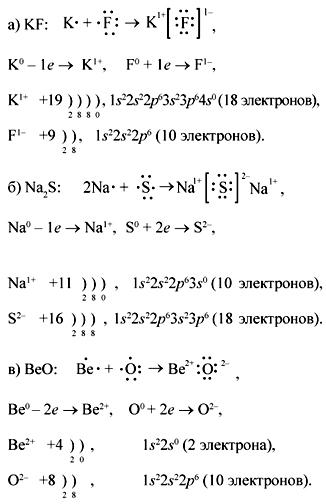
Рисунок 3. Схемы образования ионной связи
Этот тип связи характерен для соединений, образованных типичными металлами (щелочными и щелочноземельными) и типичными неметаллами (галогенами, кислородом).
Схемы образования ионной связи представлены на рисунке 3.
Задание:
Задания представлены на стр.45 № 5, 14 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 9
Тема: «Составление схем образования ковалентной связи»
Цель работы: развитие умений и навыков по составлению схем образования ковалентной связи.
Основной теоретический материал
Ковалентная связь - это связь, возникающая между атомами за счет образования общих электронных пар (например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентная неполярная связь - образуют атомы одного и того же химического элемента - неметалла (например, H2, O2, О3).
Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
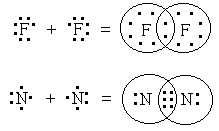
Рисунок 4. Схемы образования ковалентной неполярной связи
Ковалентная полярная связь - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (например, HCl, H2O).
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F:
 . (7)
. (7)
Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Схемы образования ковалентной полярной связи:
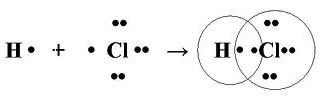 . (8)
. (8)
Задание:
Задания представлены на стр.45 № 8, 12 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 10
Тема: «Составление творческого отчета по теме: Свойства веществ (металлы, газы, жидкости) в зависимости от их строения»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 11
Тема: «Определение чистых веществ и смесей»
Цель работы: научиться выполнять поиск информации, определять чистые вещества и смеси.
Основной теоретический материал
Чистые вещества представлены одним веществом, имеющим одну химическую формулу.
Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу. Если свойства компонентов смеси разные, то их можно разделить на основании этих свойств.
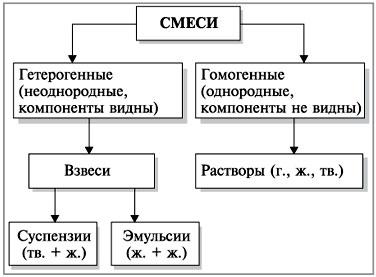
Рисунок 5. Классификация смесей
Задание:
1. Распределите на чистые вещества и смеси следующие вещества:
дистиллированная вода, бронза, алюминий, воздух, гранит, кефир, сера.
2. Напишите, какие минералы входят в состав горной породы – гранита.
3. Приведите состав двух используемых на кухне смесей, изучив сведения на их упаковках.
4. Дополните таблицу 2, записав в неё по два примера смесей.
Таблица 2. Агрегатное состояние веществ в смесях
| Агрегатное состояние веществ в смесях | Примеры смесей |
| Твердое-твердое |
|
| Жидкое-жидкое |
|
| Твердое-газообразное |
|
| Газ-газ |
|
| Твердое-жидкое |
|
5. Дополните таблицу 3 «Смеси и их применение». Для выполнения задания используйте возможности интернета.
Таблицу 3. Смеси и их применение
| Смесь | Область использования | Чистые вещества, из которых можно приготовить данную смесь |
| Физиологический раствор |
|
|
| Пропан-бутановая смесь |
|
|
| Дюралюминий |
|
|
| Нашатырный спирт |
|
|
| Пергидроль |
|
|
| Чугун |
|
|
| Бронза |
|
|
Требования к оформлению самостоятельной работы
Задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 12
Тема: «Определение массовой доли вещества в растворе»
Цель работы: развитие умений и навыков по вычислению массовой доли растворенного вещества в растворе.
Основной теоретический материал
Массовая доля растворённого вещества w(раствор.в.) - это безразмерная величина, равная отношению массы растворённого вещества m(раствор.в.) к общей массе раствора m(раствора):
m(раствора) = m(раствор.в.) + m(растворителя). (9)
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах.
Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Решение типовых заданий
Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
| Дано: m(раствора) = 300 г w(раствор.в.) = 5% | Решение: 1. Запишем формулу для расчёта массовой доли: w(раствор.в.) = (m(раствор.в.) / m(раствора)) . 100% 2. Преобразуем формулу и вычислим массу растворённого вещества в растворе m(раствор.в.) = (w(раствор.в.) · m(раствора) / 100% m(раствор.в.) = (5% · 300 г) / 100% = 15 г 3. Вычислим массу растворителя – воды: m(раствора) = m(раствор.в.) + m(H2O) m(H2O) = m(раствора) - m(раствор.в.) = 300 г - 15 г = 285 г Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды. |
| Найти: m(H2O) = ? m(раствор.в.) = ? |
Задание:
Задания представлены на стр.63 № 1, 3 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 13
Тема: «Подготовка отчета по лабораторной работе: Приготовление дисперсных систем»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Тема 1.4. Вода. Растворы. Электролитическая диссоциация
Самостоятельная работа № 14
Тема: «Решение задач на вычисление массы растворенного вещества»
Цель работы: развитие умений и навыков по вычислению массы растворенного вещества.
Основной теоретический материал
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) . V), (10)
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л или обозначается "M".
Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Решение типовых заданий
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
| Дано: V(раствора) = 1,2 л С(раствора) = 0,1 моль/л | Решение: m(K2CrO4) = C(K2CrO4) . V . M(K2CrO4) = 0,1 моль/л . 1,2 л . 194 г/моль = 23,3 г. Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра. Ответ: 23,3 г. |
| Найти: m(K2CrO4) - ? |
Задание:
Задания представлены на стр.64 № 12, 18 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 15
Тема: «Подготовка отчета по практической работе: Приготовление растворов заданной концентрации»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 16
Тема: «Составление уравнений электролитической диссоциации»
Цель работы: развитие умений и навыков по составлению уравнений диссоциации для электролитов сильной, средней и слабой силы.
Основной теоретический материал
Процесс разрушения или распада электролита на ионы называется электролитической диссоциацией. Составные части распавшихся молекул или кристаллов представляют собой частицы, имеющие заряд. Их называют ионы.
Ионы бывают отрицательные и положительные. Положительные ионы называются катионами, отрицательные — анионами.
Растворы веществ, молекулы или кристаллы которых способны распадаться на ионы, могут проводить электрический ток. Именно поэтому их называют электролитами.
Существуют вещества, молекулы или кристаллы которых хорошо распадаются на ионы. Их называют сильными электролитами.
Таблица 4. Сильные электролиты
| Кислоты | Основания | Соли |
| НCl, H2SO4, HNO3 | Растворимые в воде (по таблице растворимости) | Растворимые в воде(по таблице растворимости) |
Диссоциация сильных электролитов происходит необратимо.
Существуют вещества, молекулы или кристаллы которых плохо распадаются на ионы. Их называют слабыми электролитами.
Таблица 5. Слабые электролиты
| Кислоты | Основания | Соли |
| Н2S, H2SO3, H2CO3, H3PO4, H2SiO3 | Нерастворимые в воде (по таблице растворимости), NH3.H2O | Нерастворимые в воде(по таблице растворимости) |
Диссоциация слабых электролитов происходит обратимо, т. е. ионы, образовавшиеся при распаде молекулы, соединяясь снова, образуют исходную молекулу.
1. Диссоциация сильных электролитов
При диссоциации кислот их молекулы распадаются всегда на положительно заряженные ноны водорода (Н) и отрицательно заряженные ионы кислотных остатков:
H2SO4 = 2H+ + SO4. (11)
При диссоциации оснований их молекулы распадаются всегда на положительно заряженные ноны металла и отрицательно заряженные гидроксид-ионы (ОН-):
КОН = К+ + ОН-. (12)
При диссоциации солей их молекулы распадаются всегда на положительно заряженные ионы металла и отрицательно заряженные ноны кислотных остатков:
KBr = K+ + Br-. (13)
2. Диссоциация слабых электролитов
Диссоциация многоосновных кислот слабых электролитов на ионы происходит постепенно (ступенчато). При этом на каждой стадии диссоциации образуется один ион водорода Н и отрицательно заряженные ионы кислотных остатков:
1. H3PO4 ↔ H+ + H2PO4-, (14)
2. H2PO4- ↔ H+ + HPO42-, (15)
3. HPO42- ↔ H+ + PO43-. (16)
Диссоциация слабых электролитов многокислотных оснований на ионы происходит постепенно (ступенчато). При этом на каждой стадии диссоциации образуется один гидроксид-ион (ОН-):
1. Cu(OH)2 ↔ [CuOH]+ + OH- , (17)
2. [CuOH]+ ↔ Cu2+ + OH- . (18)
Задание:
Задания представлены на стр.55 № 1, 2 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Тема 1.5. Классификация неорганических соединений и их свойства
Самостоятельная работа № 17
Тема: «Составление уравнений химических реакций, характеризующих свойства кислот»
Цель работы: развитие умений и навыков по составлению уравнений химических реакций.
Основной теоретический материал
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
Химические свойства кислот
1. Реагируют с металлами в ряду активности до водорода (искл. HNO3 –азотная кислота):
Zn + 2HCl = ZnCl2 + H2. (19)
2. Реагируют с основными (амфотерными) оксидами металлов:
CuO + H2SO4 = Cu SO4 + H2O. (20)
3. Реагируют с основаниями:
H3PO4 + 3NaOH = Na3PO4 + 3H2O. (21)
4. Реагируют с солями слабых, летучих кислот - если образуется кислота, выпадающая в осадок или выделяется газ:
2NaCl(тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑. (22)
5. Разложение кислородсодержащих кислот при нагревании (искл. H2SO4; H3PO4):
Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑, (23)
H2SO3 ↔ H2O + SO2↑. (24)
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H2S↑ + CaCl2. (25)
Задание:
Задания представлены на стр.79 № 7 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 18
Тема: «Составление уравнений химических реакций, характеризующих свойства оснований»
Цель работы: развитие умений и навыков по составлению уравнений химических реакций.
Основной теоретический материал
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами - ОН.
Химические свойства оснований
1. Разложение с образованием оксида и воды. Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются.
Zn(OH)2 = ZnO + H2O. (26)
2. Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
в растворе: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2; (27)
при сплавлении: 2Al + 2NaOH + 2H2O = 2NaAlО2 + 3H2. (28)
3. Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H2O. (29)
4. Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2 = Na2CO3 + H2O, (30)
2NaOH + ZnO + H2O = Na2[Zn(OH)4]. (31)
5. Взаимодействие оснований с кислотами:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O. (32)
6. Взаимодействие щелочей с амфотерными гидроксидами:
в растворе: 2NaOH + Zn(OH)2 = Na2[Zn(OH)4], (33)
при сплавлении: 2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O. (34)
7. Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH = Na2SO4 + Cu(OH)2. (35)
Задание:
Задания представлены на стр.79 № 4,6 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 19
Тема: «Составление уравнений химических реакций, характеризующих свойства солей и оксидов»
Цель работы: развитие умений и навыков по составлению уравнений химических реакций.
Задание:
Задания представлены на стр.56 № 4,5, стр.79 № 1, 2 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 20
Тема: «Подготовка отчета по лабораторной работе: Изучение свойств неорганических кислот и оснований»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 21
Тема: «Подготовка отчета по лабораторной работе: Изучение свойств солей»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Тема 1.6. Химические реакции
Самостоятельная работа № 22
Тема: «Составление ионных уравнений химических реакций»
Цель работы: развитие умений и навыков по составлению ионных уравнений химических реакций.
Основной теоретический материал
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ, обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
Решение типовых заданий
Молекулярное уравнение реакции щелочи с кислотой:
К+ОН- + H+Cl- = K+Cl- + Н2+О2-. (36)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O. (37)
Сокращенное ионное уравнение реакции:
H+ + OH– = H2O. (38)
Задание:
Задания представлены на стр.58-59 № 1, 2, 9 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 23
Тема: «Определение окислителя и восстановителя в окислительно-восстановительных реакциях»
Цель работы: развитие умений и навыков по определению степени окисления элементов в веществе, определение окислителя и восстановителя в реакциях.
Основной теоретический материал
Расчет степени окисления 1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2.
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается:
H20 - 2ē = 2H+, (39)
S-2 - 2ē = S0, (40)
Al0 - 3ē = Al+3, (41)
Fe+2 - ē = Fe+3, (42)
2Br - - 2ē = Br20. (43)
Процесс присоединения электронов – восстановление. При восстановлении степень окисления понижается:
Mn+4 + 2ē = Mn+2, (44)
S0 + 2ē = S-2, (45)
Cr+6 +3ē = Cr+3, (46)
Cl20 +2ē = 2Cl-, (47)
O20 + 4ē = 2O-2, (48)
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а которые отдают электроны - восстановителями.
Задание:
Задания представлены на стр.46-47 № 30,36 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 24
Тема: «Определение скорости химических реакций»
Цель работы: развитие умений и навыков по решению задач на скорость химических реакций.
Основной теоретический материал
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. Формула для нахождения средней скорости:
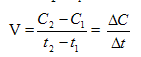 , (49)
, (49)
С2, С1 – молярные концентрации веществ (количество вещества в единице объема) в момент времени t1 и t2. Ее измеряют в моль/л.
Правило Вант - Гоффа: при повышении температуры на каждые 10°С скорость реакции увеличивается в 2-4 раза:
V=V0 . γ∆t/10, (50)
где V – скорость реакции при t2, V0 – начальная скорость реакции при t1, γ – коэффициент скорости реакции, ∆t = t2 - t1.
Решение типовых заданий
Пример 1. Реакция протекает по уравнению 2Мg+O2 = 2MgO. Начальная концентрация вещества Мg равна 0,35 моль/л, а через 40 с — 0,478 моль/л. Вычислите среднюю скорость реакции.
| Дано: с1 = 0,35 моль/л с2 = 0,478 моль/л t1 = 0 c t2 = 40 c | Решение: Используем формулу № 49 для расчёта. υ = ± Δс/Δt = ± (0,478-0,35)/(40-0) = 0,0032 моль/л ∙ с Ответ: 0,0032 моль/л ∙ с
|
| Найти: v-? |
Пример 2. Во сколько раз возрастет скорость реакции при повышении температуры с 50 до 90oС (γ=4)?
| Дано: γ = 4 t1 = 50oC t2 = 90oC | Решение: Используем формулу № 50 для расчёта. При увеличении температуры с 50 до 90oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает: Получаем v2/v1 = 4(90–50)/10 = 44 = 256 т.е. скорость реакции увеличится в 256 раз. Ответ: 256. |
| Найти: v2/v1 - ? |
Задание:
1. Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,56 моль/л, а через 30 с — 0,113 моль/л. Вычислите среднюю скорость реакции.
2. Как изменится скорость реакции при повышении температуры от 550С до 1000С, если температурный коэффициент скорости этой реакции равен 2,5?
3. При повышении температуры на 300С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 25
Тема: «Составление творческого отчета по теме: Рекомендации по изменению условий проведения химических реакций, лежащих в основе конкретного производства, с целью увеличения выхода продукта реакции»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Тема 1.7. Металлы и неметаллы
Самостоятельная работа № 26
Тема: «Составление творческого отчета по теме: Виды коррозии и способы защиты металлов от коррозии»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 27
Тема: «Составление творческого отчета по теме: Металлургическое производство Челябинской области»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 28
Тема: «Подготовка отчета по практической работе: Решение задач на определение сплава черного металла»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 29
Тема: «Выполнение реферата на тему: Цветная металлургия Челябинской области»
Цель работы: привить студентам навыки самостоятельного исследования.
Структура реферата
По структуре реферат подразделяется на:
Титульный лист;
Оглавление с указанием соответствующих страниц;
Введение;
Разделы и подразделы;
Заключение;
Библиография;
Приложения.
Во введении автор должен показать актуальность проблемы, степень ее разработанности и сформулировать те задачи, которые будут решаться в работе. Введение должно быть кратким (1-2 страницы).
В основной части излагается содержание темы. Эту часть рекомендуется разделить на 2 - 4 вопроса, раскрывающих сущность проблемы. Увеличивать число вопросов не следует, так как это приведет к их поверхностной разработке или значительному превышению объема реферата. Изложение каждого вопроса надо четко ограничивать с тем, чтобы можно было ясно видеть, где начинается и где кончается их освещение. Основная часть работы может быть изложена на 18-20 страницах.
Третья часть работы – заключение, содержит краткие выводы, которые излагаются на 1-2 страницах. В заключении студент также может изложить собственные впечатления и мнения, указать те проблемные вопросы, которые остались невыясненными и заслуживают дополнительного исследования.
Любые цитаты, статистика и другие данные должны быть снабжены сноской с указанием номера и страницы источника, название которого находится в библиографии.
Этапы работы над рефератом
Выполнение реферата целесообразно разделить на 6 следующих этапов:
выбор темы;
подбор и изучение литературы;
составление плана работы;
собрание и обработка фактического и статистического материала;
написание реферата;
защита реферата.
Необходимо составить список литературы, подобрать ее и изучить. Начинать эту работу следует с исследования перечня рекомендованной литературы, При составлении библиографического указателя рекомендуется пользоваться источниками библиотеки учебного заведения: библиографическими каталогами, тематическими библиографиями, перечнями статей за год, опубликованных в последнем номере того или иного журнала. При этом главная задача студента - из огромной массы российской и зарубежной литературы отобрать только те книги, журналы и статьи, в которых освещаются вопросы, относящиеся к выбранной теме реферата.
Изучение периодической литературы следует начинать с работ, опубликованных в последние годы и наиболее полно раскрывающих вопросы реферата, а затем уже переходить и к более ранним изданиям. Такая последовательность изучения литературы обусловлена не только глубоким реформированием всех сторон нашей жизни в последнее десятилетие, но и тем, что химия - наука творческая, она, как и любая другая наука не может стоять на месте, постоянно развивается.
При изучении литературы можно рекомендовать делать выписки из книг и статей основных положений, теоретических выводов, определений, доказательств, статистических данных и т. п.
После подбора и изучения литературы студент должен составить тщательно продуманный план реферата, который призван способствовать более полному раскрытию основных ее вопросов. План работы тесно связан с её структурой. Но раз дана структура работы, состоящая из введения, основного раздела и заключения, то задача студента состоит в том, чтобы определить 3-4 вопроса основной ее части, соблюдая их взаимосвязь и последовательность изложения.
Для написания реферата нужны не только литературные источники, но и статистические, нормативные материалы, на основе которых можно сделать обоснованные выводы о происходящих процессах и явлениях.
Требования к оформлению реферата
Объем реферата не ограничивается, однако в среднем должен составлять 20-25 страниц машинописного текста через 1,5 интервала.
Порядок подготовки и защиты реферата
Подготовка реферата должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
До выхода на защиту на титульном листе реферата должно стоять резюме преподавателя “К защите допущен”, его подпись и дата.
Защита реферата заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты реферата выставляется оценка за выполненный реферат, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы, дается аргументированная критика и самостоятельный анализ фактического материала на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы темы, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания рецензента, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие рефераты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 30
Тема: «Определение коэффициентов в реакциях методом электронного баланса»
Цель работы: развитие навыков по определению коэффициентов в реакциях методом электронного баланса.
Основной теоретический материал
Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса:
1. Определите степени окисления элементов.
2. Подчеркните символы элементов, степени окисления которых изменяются.
3. Выпишите элементы, изменяющие степени окисления.
4. Составьте электронные уравнения, определяя число отданных и принятых электронов.
5. Уравняйте число отданных и принятых электронов, подобрав наименьшее общее кратное и дополнительные множители.
6. Допишите уравнение реакции, расставив коэффициенты.
Решение типовых заданий
Пример. Расставьте коэффициенты в данной схеме реакции методом электронного баланса:
Fe2O3 + CO  Fe + CO2. (51)
Fe + CO2. (51)
Решение:
Воспользуемся алгоритмом расстановки коэффициентов методом электронного баланса.
1. Определим степени окисления элементов:
Fe2+3O3-2 + C+2O-2  Fe0 + C+4O2-2. (52)
Fe0 + C+4O2-2. (52)
2. Подчеркнем символы элементов, степени окисления которых изменяются:
Fe2+3O3-2 + C+2O-2  Fe0 + C+4O2-2. (53)
Fe0 + C+4O2-2. (53)
3. Выпишем элементы, изменяющие степени окисления:
Fe+3 → Fe0, (54)
C+2 → C+4. (55)
4. Составим электронные уравнения, определяя число отданных и принятых электронов:
Fe+3 + 3е → Fe0, (56)
C+2 – 2е → C+4. (57)
5. Число отданных и принятых электронов должно быть одинаково, т.к. не заряжены ни исходные вещества, ни продукты реакции. Уравниваем число отданных и принятых электронов, подобрав наименьшее общее кратное (НОК) и дополнительные множители:
| Fe+3 + 3е → Fe0 | НОК 6 | 2 |
|
|
|
| (58) |
| C+2 – 2е → C+4 | 3 |
|
6. Полученные множители являются коэффициентами. Перенесем коэффициенты в схему реакции:
Fе2О3 + 3СО = 2Fе + 3СО2. (59)
Задание:
Задания представлены на стр.87-88 № 5, 21 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Раздел 2. Органическая химия
Тема 2.1. Основные понятия органической химии
и теория строения органических веществ
Самостоятельная работа № 1
Тема: «Определение изомеров углеводородов»
Цель работы: развитие навыков по определению изомеров углеводородов и их названий по рациональной и международной номенклатуре.
Основной теоретический материал
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Явление существования изомеров называется изомерией.
Например, вещество состава С4Н10 имеет два изомерных соединения:
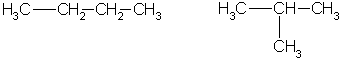
Рисунок 6. Изомеры вещества состава С4Н10
Физические свойства бутана и изобутана отличаются: изобутан имеет более низкие температуры плавления и кипения, чем бутан.
Химические свойства данных изомеров различаются незначительно, т.к. они имеют одинаковые качественный состав и характер связи между атомами в молекуле.
Задание:
Задания представлены на стр.194 № 8 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 2
Тема: «Подготовка отчета по практической работе: Составление изомеров и формул органических веществ»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 3
Тема: «Определение названий алканов по рациональной и международной номенклатуре»
Цель работы: развитие навыков по определению названий алканов по рациональной и международной номенклатуре.
Основной теоретический материал
Международная номенклатура IUPAC
1. Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой длинной. Во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная.
2. Пронумеровать атомы углерода в главной цепи так, чтобы атомы С, связанные с заместителями, получили возможно меньшие номера. Поэтому нумерацию начинают с ближайшего к ответвлению конца цепи. Например:
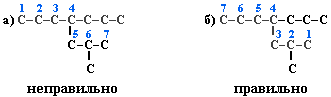 . (60)
. (60)
3. Назвать все радикалы (заместители), указав впереди цифры, обозначающие их местоположение в главной цепи. Если есть несколько одинаковых заместителей, то для каждого из них через запятую записывается цифра (местоположение), а их количество указывается приставками ди-, три-, тетра-, пента- (например, 2,2-диметил или 2,3,3,5-тетраметил).
4. Названия всех заместителей расположить в алфавитном порядке (так установлено последними правилами ИЮПАК).
5. Назвать главную цепь углеродных атомов, т.е. соответствующий нормальный алкан.
Например:
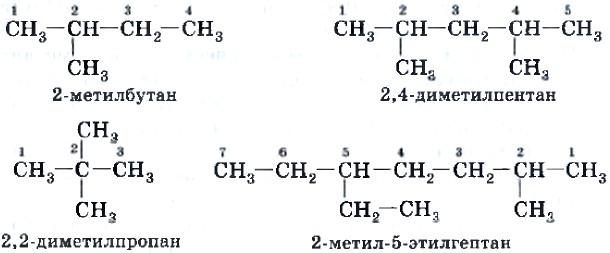
Рисунок 7. Примеры алканов
Рациональная номенклатура
Алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово «метан»:
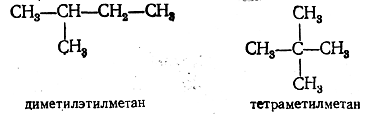
Рисунок 8. Примеры алканов
Задание:
Задания представлены на стр.193 № 6,7 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 4
Тема: «Составление уравнений реакций и их классификация в органической химии»
Цель работы: развитие навыков по составлению реакций в органической химии.
Задание:
1. К какому типу реакций относятся:
а) получение хлорметана из метана;
б) получение бромбензола из бензола;
в) получение хлорэтана из этилена;
г) получение этилена из этанола;
д) превращение бутана в изобутан;
е) дегидрирование этана;
ж) превращение бромэтана в этанол?
Составьте химические уравнения для данных реакций.
2. Какие реакции характерны:
а) для алканов;
б) для алкенов?
Приведите примеры реакций.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Тема 2.2. Углеводороды и их природные источники
Самостоятельная работа № 5
Тема: «Составление уравнений химических реакций, характеризующих свойства алканов»
Цель работы: развитие навыков по составлению реакций для алканов.
Задание:
Задания представлены на стр.194 № 10, 14 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 6
Тема: «Определение названий алкенов по международной номенклатуре»
Цель работы: развитие навыков по определению названий алкенов.
Основной теоретический материал
Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса -ан на –ен.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
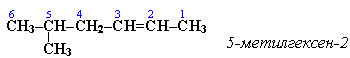 (61)
(61)
Задание:
Задания представлены на стр.203-204 № 5, 15 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 7
Тема: «Определение названий алкадиенов по международной номенклатуре»
Цель работы: развитие навыков по определению названий алкадиенов.
Основной теоретический материал
Номенклатура алкадиенов
По правилам главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием –диен.
Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия.
Например:
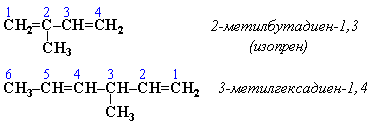 (62,63)
(62,63)
Задание:
Задания представлены на стр.204 № 7 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 8
Тема: «Подготовка отчета по практической работе: Составление формул и названий алканов, алкенов, алкадиенов»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 9
Тема: «Составление формул и названий алкинов по международной номенклатуре»
Цель работы: развитие навыков по составлению формул и определению названий алкинов.
Основной теоретический материал
Номенклатура алкадиенов
Согласно номенклатуре ИЮПАК при построении названий алкинов в названиях соответствующих полностью насыщенных углеводородов суффикс -ан заменяется суффиксом –ин.
Для указания положения тройной связи и замещающих групп цепь нумеруют также, как в соответствующих алкенах:
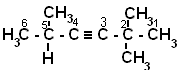 . (64)
. (64)
2, 2, 5- триметилгексин-3
Задание:
Задания представлены на стр.205 № 20, 21 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 10
Тема: «Составление формул и названий ароматических углеводородов по международной номенклатуре»
Цель работы: развитие навыков по составлению формул и определению названий ароматических углеводородов.
Основной теоретический материал
Номенклатура
Используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень):
Рисунок. 9. Примеры производных бензола
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например:
Рисунок. 10. Примеры производных бензола
Для дизамещенных бензолов R-C6H4-R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-;
мета- (м-) заместители через один атом углерода (1,3-);
пара- (п-) заместители на противоположных сторонах кольца (1,4-).
Рисунок. 10. Примеры производных бензола
Ароматические одновалентные радикалы имеют общее название «арил». Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
Задание:
Задания представлены на стр.211 № 3, 4 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 11
Тема: «Составление творческого отчета по теме: Использование нефтепродуктов и альтернативных видов топлива и энергии»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 12
Тема: «Подготовка отчета по лабораторной работе: Ознакомление с коллекцией образцов нефти и продуктов ее переработки»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Тема 2.3. Кислородсодержащие органические соединения
Самостоятельная работа № 13
Тема: «Решение задач на определение выхода продукта реакции в процентах от теоретического»
Цель работы: развитие навыков по решению задач на определение выхода продукта реакции.
Основной теоретический материал
Доля выхода продукта обозначается буквой η, измеряется в процентах или долях.
Массовая доля выхода продукта:
η = (m(практический продукт) / m(теоретический продукт)) . 100%. (65)
Также для расчётов может использоваться количественный выход:
η = (n(практический продукт) / n(теоретический продукт)) . 100%. (66)
Решение типовых заданий
При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| Дано: m(Mg) = 1,2 г mпрактическая(MgSO4) = 5,5 г | Решение: Мg + H2SO4 = MgSO4 + H2 1 моль 1 моль M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль Находим количество вещества реагента: n(Mg) = 1,2 г / 24(г/моль) = 0,05 моль Вычисляем теоретическое количество вещества (nтеор) и теоретическую массу (mтеор) продукта реакции: m = n · M mтеор (MgSO4) = M(MgSO4) · nтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г Находим массовую долю выхода продукта по формуле № 65: η = (MgSO4)=(5,5г ·100%)/6г=91,7% Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим. |
| Найти: η = ? |
Задание:
Задания представлены на стр.217, 220 № 4, 34, 35 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 14
Тема: «Подготовка отчета по практической работе: Составление формул и названий спиртов»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 15
Тема: «Составление уравнений реакций получения альдегидов, составление структурных формул карбоновых кислот»
Цель работы: развитие навыков по составлению уравнений реакций получения альдегидов, составлению структурных формул карбоновых кислот.
Задание:
Задания представлены на стр.225 № 7, 8, стр.231 № 5 в «Сборнике задач и упражнений по химии» Ю.М.Ерохина, В.И.Фролова.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 16
Тема: «Подготовка отчета по лабораторной работе: Свойства глицерина. Свойства уксусной кислоты»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 17
Тема: «Подготовка отчета по практической работе: Составление формул и названий альдегидов, карбоновых кислот»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Ход работы;
5. Результаты работы;
6. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 18
Тема: «Составление творческого отчета по теме: Сравнительная характеристика мыла и синтетических моющих средств»
Цель работы: научиться выполнять поиск литературы, использовать информацию для эффективного выполнения задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Основная часть;
5. Выводы;
6. Литература.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 19
Тема: «Выполнение реферата на тему: Биологическое значение кислородсодержащих органических соединений»
Цель работы: привить студентам навыки самостоятельного исследования.
Структура реферата
По структуре реферат подразделяется на:
Титульный лист;
Оглавление с указанием соответствующих страниц;
Введение;
Разделы и подразделы;
Заключение;
Библиография;
Приложения.
Во введении автор должен показать актуальность проблемы, степень ее разработанности и сформулировать те задачи, которые будут решаться в работе. Введение должно быть кратким (1-2 страницы).
В основной части излагается содержание темы. Эту часть рекомендуется разделить на 2 - 4 вопроса, раскрывающих сущность проблемы. Увеличивать число вопросов не следует, так как это приведет к их поверхностной разработке или значительному превышению объема реферата. Изложение каждого вопроса надо четко ограничивать с тем, чтобы можно было ясно видеть, где начинается и где кончается их освещение. Основная часть работы может быть изложена на 18-20 страницах.
Третья часть работы – заключение, содержит краткие выводы, которые излагаются на 1-2 страницах. В заключении студент также может изложить собственные впечатления и мнения, указать те проблемные вопросы, которые остались невыясненными и заслуживают дополнительного исследования.
Любые цитаты, статистика и другие данные должны быть снабжены сноской с указанием номера и страницы источника, название которого находится в библиографии.
Этапы работы над рефератом
Выполнение реферата целесообразно разделить на 6 следующих этапов:
выбор темы;
подбор и изучение литературы;
составление плана работы;
собрание и обработка фактического и статистического материала;
написание реферата;
защита реферата.
Необходимо составить список литературы, подобрать ее и изучить. Начинать эту работу следует с исследования перечня рекомендованной литературы, При составлении библиографического указателя рекомендуется пользоваться источниками библиотеки учебного заведения: библиографическими каталогами, тематическими библиографиями, перечнями статей за год, опубликованных в последнем номере того или иного журнала. При этом главная задача студента - из огромной массы российской и зарубежной литературы отобрать только те книги, журналы и статьи, в которых освещаются вопросы, относящиеся к выбранной теме реферата.
Изучение периодической литературы следует начинать с работ, опубликованных в последние годы и наиболее полно раскрывающих вопросы реферата, а затем уже переходить и к более ранним изданиям. Такая последовательность изучения литературы обусловлена не только глубоким реформированием всех сторон нашей жизни в последнее десятилетие, но и тем, что химия - наука творческая, она, как и любая другая наука не может стоять на месте, постоянно развивается.
При изучении литературы можно рекомендовать делать выписки из книг и статей основных положений, теоретических выводов, определений, доказательств, статистических данных и т. п.
После подбора и изучения литературы студент должен составить тщательно продуманный план реферата, который призван способствовать более полному раскрытию основных ее вопросов. План работы тесно связан с её структурой. Но раз дана структура работы, состоящая из введения, основного раздела и заключения, то задача студента состоит в том, чтобы определить 3-4 вопроса основной ее части, соблюдая их взаимосвязь и последовательность изложения.
Для написания реферата нужны не только литературные источники, но и статистические, нормативные материалы, на основе которых можно сделать обоснованные выводы о происходящих процессах и явлениях.
Требования к оформлению реферата
Объем реферата не ограничивается, однако в среднем должен составлять 20-25 страниц машинописного текста через 1,5 интервала.
Порядок подготовки и защиты реферата
Подготовка реферата должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
До выхода на защиту на титульном листе реферата должно стоять резюме преподавателя “К защите допущен”, его подпись и дата.
Защита реферата заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты реферата выставляется оценка за выполненный реферат, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы, дается аргументированная критика и самостоятельный анализ фактического материала на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы темы, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания рецензента, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие рефераты, к дифференцированному зачету не допускаются.
Тема 2.4. Азотсодержащие органические соединения. Полимеры
Самостоятельная работа № 20
Тема: «Составление схем генетических связей органических и неорганических веществ»
Цель работы: развитие навыков по составлению схем генетических связей веществ.
Основной теоретический материал
Генетической связью – называется связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ.
Генетическим называют ряд веществ – представителей разных классов веществ, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающими общность происхождения этих веществ.
Признаки генетического ряда веществ
1. Все вещества генетического ряда должны быть образованы одним химическим элементом.
2. Вещества, образованные одним и тем же химическим элементом, должны принадлежать к разным классам ( т.е. отражать разные формы существования химического элемента).
3. Вещества, образующие генетический ряд одного химического элемента, должны быть связаны взаимопревращениями.
По этому признаку можно различать полные и неполные генетические ряды. Рассмотрим вначале генетическую связь неорганических веществ и разделим их на 2 разновидности генетических рядов:
а) генетический ряд металла
б) генетический ряд неметалла.
Генетический ряд металла.
а) Рассмотрим ряд меди:
Cu → CuO → CuSO4 → Cu(OH)2 → CuO→ Cu. (67)
| медь | оксид меди(1I) | сульфат меди (II) | гидроксид меди (II) | оксид меди (II) | медь |
| металл | основной оксид | соль | основание | основной оксид | металл |
1. 2Cu + O2 → 2CuO, (68)
2. CuO + H2SO4 → CuSO4 + H2O, (69)
3. CuSO4 + 2KOH → Cu(OH)2 + K2SO4, (70)
4. Cu(OH)2 → CuO + H2O, (71)
5. CuO + C→Cu + CO. (72)
б) Генетический ряд неметалла рассмотрим на примере генетического ряда фосфора.
P → P2O5 → H3PO4 → Ca2(PO4)2 (73)
| фосфор | оксид фосфора(v) | фосфорная кислота | фосфат кальция |
| неметалл | кислотный оксид | кислота | соль |
1. 4P + 5O2 → 2P2O5, (74)
2. P2O5 + 3H2O → 2H3PO4, (75)
3. 2H3PO4 + 3Ca → Ca3(PO4)2 + 3H2. (76)
В основу генетического ряда в органической химии (химии углеродных соединений) составляют соединения с одинаковым числом атомов углерода в молекуле.
Например:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3COOH →CH2Cl – COOH →NH2CH2COOH. (77)
Этан этен этанол этаналь уксусная кислота хлорэтановая кислота аминоэтановая к-та
алкан алкен алканол алканаль карбоновая к-та хлоркарбоновая к-та аминокислота
1. C2H6 → C2H4 + H2, (78)
2. C2H4 + H2O → C2H5 OH, (79)
3. C2 H5OH + [O] → CH3CHO + H2O, (80)
4. CH3CHO + [O] → CH3COOH, (81)
5. CH3COOH + Cl2 → CH2Cl -COOH, (82)
6. CH2Cl -COOH + NH3 → NH2 CH2 –COOH + HCl. (83)
Задание:
Осуществить схему превращения веществ:
1. FeS → SO2 → SO3 → H2SO4 → MgSO4 → BaSO4;
2. Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3;
3. СН4 → СН3Сl → CH3OH → HCHO → HCOOH → HCOOC2H5;
4. С2H6 → C2H5Cl → C2H5OH → CH3COH → CH3COOH → CH2Cl-COOH → NH2-CH2COOH.
Требования к оформлению самостоятельной работы
Расчетные задания должны быть выполнены в рабочей тетради №2.
Критерии оценки за самостоятельную работу
Зачет ставится в случае, если выполнено не менее 50% заданий, выполнены требования к оформлению задач и сроки сдачи.
Незачет ставится, если студент не справился с заданием (выполнено менее 50% задания).
Самостоятельная работа № 21
Тема: «Выполнение реферата на тему: Строение и функции белков»
Цель работы: привить студентам навыки самостоятельного исследования.
Структура реферата
По структуре реферат подразделяется на:
Титульный лист;
Оглавление с указанием соответствующих страниц;
Введение;
Разделы и подразделы;
Заключение;
Библиография;
Приложения.
Во введении автор должен показать актуальность проблемы, степень ее разработанности и сформулировать те задачи, которые будут решаться в работе. Введение должно быть кратким (1-2 страницы).
В основной части излагается содержание темы. Эту часть рекомендуется разделить на 2 - 4 вопроса, раскрывающих сущность проблемы. Увеличивать число вопросов не следует, так как это приведет к их поверхностной разработке или значительному превышению объема реферата. Изложение каждого вопроса надо четко ограничивать с тем, чтобы можно было ясно видеть, где начинается и где кончается их освещение. Основная часть работы может быть изложена на 18-20 страницах.
Третья часть работы – заключение, содержит краткие выводы, которые излагаются на 1-2 страницах. В заключении студент также может изложить собственные впечатления и мнения, указать те проблемные вопросы, которые остались невыясненными и заслуживают дополнительного исследования.
Любые цитаты, статистика и другие данные должны быть снабжены сноской с указанием номера и страницы источника, название которого находится в библиографии.
Этапы работы над рефератом
Выполнение реферата целесообразно разделить на 6 следующих этапов:
выбор темы;
подбор и изучение литературы;
составление плана работы;
собрание и обработка фактического и статистического материала;
написание реферата;
защита реферата.
Необходимо составить список литературы, подобрать ее и изучить. Начинать эту работу следует с исследования перечня рекомендованной литературы, При составлении библиографического указателя рекомендуется пользоваться источниками библиотеки учебного заведения: библиографическими каталогами, тематическими библиографиями, перечнями статей за год, опубликованных в последнем номере того или иного журнала. При этом главная задача студента - из огромной массы российской и зарубежной литературы отобрать только те книги, журналы и статьи, в которых освещаются вопросы, относящиеся к выбранной теме реферата.
Изучение периодической литературы следует начинать с работ, опубликованных в последние годы и наиболее полно раскрывающих вопросы реферата, а затем уже переходить и к более ранним изданиям. Такая последовательность изучения литературы обусловлена не только глубоким реформированием всех сторон нашей жизни в последнее десятилетие, но и тем, что химия - наука творческая, она, как и любая другая наука не может стоять на месте, постоянно развивается.
При изучении литературы можно рекомендовать делать выписки из книг и статей основных положений, теоретических выводов, определений, доказательств, статистических данных и т. п.
После подбора и изучения литературы студент должен составить тщательно продуманный план реферата, который призван способствовать более полному раскрытию основных ее вопросов. План работы тесно связан с её структурой. Но раз дана структура работы, состоящая из введения, основного раздела и заключения, то задача студента состоит в том, чтобы определить 3-4 вопроса основной ее части, соблюдая их взаимосвязь и последовательность изложения.
Для написания реферата нужны не только литературные источники, но и статистические, нормативные материалы, на основе которых можно сделать обоснованные выводы о происходящих процессах и явлениях.
Требования к оформлению реферата
Объем реферата не ограничивается, однако в среднем должен составлять 20-25 страниц машинописного текста через 1,5 интервала.
Порядок подготовки и защиты реферата
Подготовка реферата должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
До выхода на защиту на титульном листе реферата должно стоять резюме преподавателя “К защите допущен”, его подпись и дата.
Защита реферата заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты реферата выставляется оценка за выполненный реферат, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы, дается аргументированная критика и самостоятельный анализ фактического материала на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы темы, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания рецензента, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие рефераты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 22
Тема: «Подготовка отчета по лабораторной работе: Свойства белков»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Самостоятельная работа № 23
Тема: «Подготовка отчета по практической работе: Распознавание пластмасс и волокон»
Цель работы: привить студентам навыки самостоятельного выполнения поставленных задач.
Структура отчета
По структуре отчет подразделяется на следующие пункты:
1. Вид работы;
2. Название работы;
3. Цель работы;
4. Оборудование и реактивы;
5. Ход работы;
6. Результаты работы;
7. Выводы.
Порядок подготовки и защиты отчета
Подготовка отчета должна быть завершена до начала зачетной недели с учетом возможной доработки замечаний преподавателя.
Защита отчета заключается в кратком изложении проделанной работы и ответах на вопросы преподавателя по указанной теме.
По результатам защиты отчета выставляется оценка за выполненный отчет, которая учитывается при приеме дифференцированного зачета.
Оценку «отлично» получают работы, в которых делаются самостоятельные выводы на основе глубоких знаний литературы по данной теме.
Оценка «хорошо» ставится тогда, когда в работе, выполненной на достаточном теоретическом уровне, полно и всесторонне освещаются вопросы темы, но нет должной степени самостоятельности.
Оценку «удовлетворительно» имеют работы, в которых правильно освещены основные вопросы отчета, но не проявилось умение логически стройного их изложения, самостоятельного анализа источников, содержатся отдельные ошибочные положения.
Оценку «неудовлетворительно» студент получает в случае, когда не может ответить на замечания преподавателя, не владеет материалом работы, не в состоянии дать объяснения выводам и теоретическим положениям данной проблемы. В этом случае студенту предстоит повторная защита.
Лица, в установленный срок не защитившие отчеты, к дифференцированному зачету не допускаются.
Учебно-методическое и информационное обеспечение
а) основная литература:
1. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
2. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
3. Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред.
проф. образования. — М., 2014.
б) дополнительная литература:
1. Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
2. Сладков С. А., Остроумов И. Г., Габриелян О. С., Лукьянова Н. Н. Химия для профессий и специальностей технического профиля. Электронное приложение (электронное учебное издание) для студ. учреждений сред. проф. образования. — М., 2014.
в) информационно-справочные и поисковые системы
1. www. chem. msu. su (Электронная библиотека по химии).
2. www. hij. ru (журнал «Химия и жизнь»).
3. www. chemistry-chemists. com (электронный журнал «Химики и химия»).
66


 Получите свидетельство
Получите свидетельство Вход
Вход







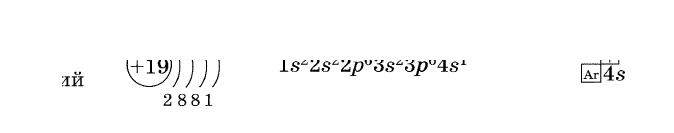
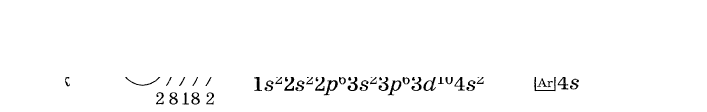
 . (5)
. (5) . (6)
. (6)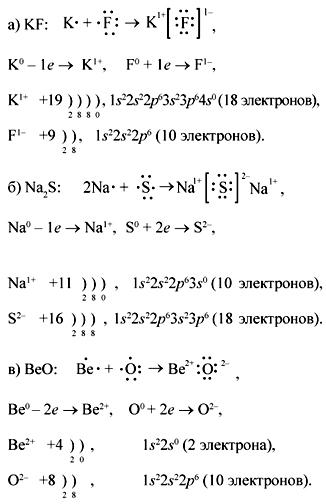
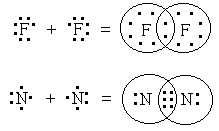
 . (7)
. (7) . (8)
. (8)
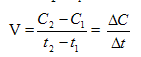 , (49)
, (49)
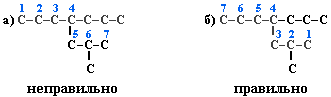 . (60)
. (60)

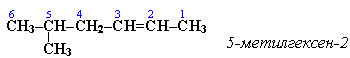 (61)
(61)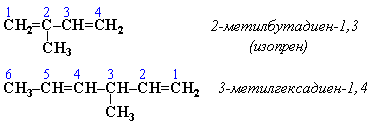 (62,63)
(62,63)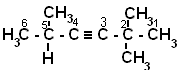 . (64)
. (64)








 Методические указания к самостоятельным работам по химии (2.49 MB)
Методические указания к самостоятельным работам по химии (2.49 MB)
 0
0 1142
1142 117
117 Нравится
0
Нравится
0