При изучении темы в 9 - м классе «Электролитическая диссоциация кислот, солей, оснований» мне очень помогли рекомендации более опытных на тот момент учителей. Поэтому я хочу поделиться с начинающими учителями этими знаниями.
Рассматривая возможный вариант методики изучения электролитической диссоциации веществ с ионной и ковалентной полярной связью.
Вначале учащиеся отвечают на следующие вопросы:
1. Какие вещества относятся к классу кислот?
2. Приведите формулы известных вам кислот.
3. Выясните, что общего в составе всех кислот, как можно обнаружить кислоту в растворе?
4. Будет ли изменяться окраска индикатора в кислоте, если ее растворить не в воде, а в другом растворителе (например, в ацетоне)?
Для ответа на поставленный вопрос демонстрируем опыт 1.
В первую сухую пробирку наливаем 1 мл концентрированной серной кислоты и добавляем 1 - 2 капли метилоранжевого индикатора на ацетоне. Окраска индикатора не изменяется. Во вторую наливаем 1 - 2 мл воды и добавляем часть раствора из первой пробирки (осторожно – концентрированная серная кислота!) Наблюдаем, что окраска становится красной.
Вывод: кислоты изменяют окраску индикатора только в одном растворе.
Затем выясняем с учащимися следующие вопросы: какие вещества относятся к классу оснований и как их классифицируют по растворимости в воде?
Предлагаем записать формулы известных нам щелочей и ответить на вопросы:
Что общего в их составе? Как можно обнаружить щелочь в растворе? Будет ли изменять окраску индикатора сухая щелочь?
Для ответа на поставленный вопрос демонстрируем опыт 2.
В две сухие пробирки насыпаем немного кристаллического гидроксида кальция (для опыта лучше брать оксид кальция) и добавляем в обе пробирки кристаллы фенолфталеина, встряхиваем. Никаких изменений не наблюдаем. В одну из пробирок добавляем небольшое количество воды и наблюдаем изменение окраски фенолфталеина в малиновую.
Вывод: индикатор изменяет окраску только в водном растворе щелочи.
Затем выясним, какие вещества называют солями и как соли реагируют с металлами.
Ставим перед учащимися вопрос: будет ли более активный металл вытеснять из соли менее активный, если соль растворена не в воде, а в ацетоне?
Для ответа на поставленный вопрос демонстрируем опыт 3.
- В две пробирки насыпаем обезвоженный сульфат меди (II).
(Для получения обезвоженного сульфата меди необходимо нагреть медный купорос (СuSO4*5H2O) до получения белого кристаллического вещества; при сильном нагревании сульфат меди разлагается с образованием черного порошка оксида меди (II) - CuO)
- В одну из пробирок приливаем 1 мл ацетона, в другую – 1 мл воды.
- Встряхиваем обе пробирки и опускаем в растворы очищенные железные гвозди. Наблюдаем выделение меди в водном растворе соли, а соль, растворенная в ацетоне, не взаимодействует с железом.
Вывод: более активный метал, может вытеснять менее активный металл только из водного раствора соли.
Что же за волшебное вещество вода?
Почему кислоты, щелочи, соли, т. е. вещества с ковалентной полярной и ионной связью проявляют свои качества в водных растворах?
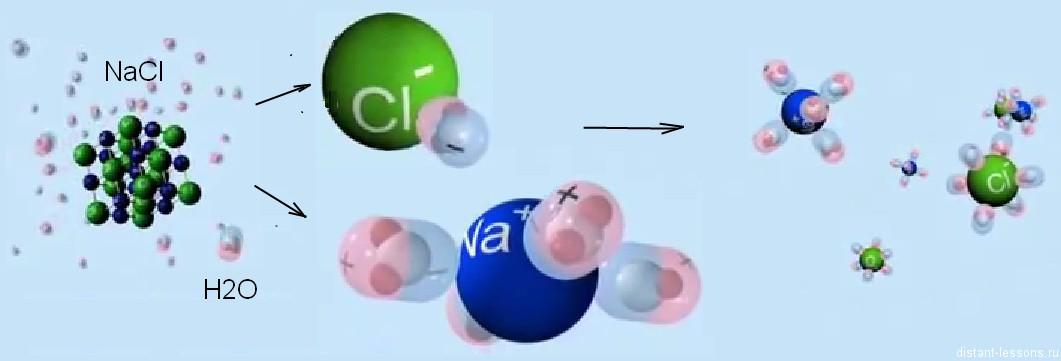
Вспоминаем строение молекулы воды. Говорим о виде химической связи в молекулах воды и отмечаем полярность этих молекул. Объясняем механизм диссоциации веществ с ионной связью на примере хлорида натрия и ковалентной полярной связью на примере хлороводорода.
Механизм электролитической диссоциации рассматриваем с учетом теплового эффекта.
Делаем вывод, что волшебная сила воды заключается в значительной полярности её молекулы в отличие от ацетона, молекула которого малополярная, или бензина (неполярная).
На основании вышерассмотренного делаем следующие выводы:
- Вещества с ионной и ковалентной полярной связью под действием полярных молекул воды диссоциируют на гидротированные ионы.
- Свойства веществ с иным видом химической связи (солей, щелочей) и ковалентной полярной (кислот) в водных растворах определяются свойствами соответствующих гидротированных ионов.
- Диссоциации веществ с ионной и ковалентной полярной связью способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (спирт, аммиак и др. ), также являются ионизирующими растворителями: соли, щелочи и кислоты, растворенные в этих жидкостях, также диссоциируют на ионы.
Затем испытываем кристаллические вещества и их растворы на электропроводность.
На основании химического эксперимента делаем вывод: вещества с ионной и ковалентной полярной связью 9 соли, щелочи, кислоты) в водных растворах диссоциируют на ионы и поэтому проводят электрический ток.

 Получите свидетельство
Получите свидетельство Вход
Вход













 Методические рекомендации к уроку химии по теме «Электролитическая диссоциация кислот, солей, оснований» (0.14 MB)
Методические рекомендации к уроку химии по теме «Электролитическая диссоциация кислот, солей, оснований» (0.14 MB)
 0
0 825
825 18
18 Нравится
0
Нравится
0


