УПРАВЛЕНИЕ ОБРАЗОВАНИЯ И НАУКИ ТАМБОВСКОЙ ОБЛАСТИ
ТОГБОУ СПО «ЖЕРДЕВСКИЙ КОЛЛЕДЖ САХАРНОЙ ПРОМЫШЛЕННОСТИ»
РАБОЧАЯ ТЕТРАДЬ
Руководство по проведению лабораторных работ по дисциплине
«Химия»
Для студентов, обучающихся по специальности 19.02.04 Технология сахаристых продуктов

ЖЕРДЕВКА
2015
| Рассмотрен на заседании цикловой комиссии гуманитарных и математических дисциплин Протокол №___от_________________ Председатель комиссии __________________Л.В. Бредищева
| УТВЕРЖДАЮ Зам. директора по учебной работе
Н.В.Зингер |
Рецензенты:
Насонова О.С. – преподаватель спецдисциплин Жердевского колледжа сахарной промышленности
Прокофьева Е.Ю. – главный технолог ОАО «Знаменский сахарный завод» - Филиал «Жердевский»
Печатается по решению методического совета ТОГБОУ СПО «Жердевский колледж сахарной промышленности»
Белолипецкая Т.Н.
Руководство по проведению лабораторных работ по физической и коллоидной химии: учебное пособие / Т.Н. Белолипецкая – Жердевка: Жердевский колледж сахарной промышленности 2015.
Изложен ход лабораторных работ по физической и коллоидной химии, дается вводный инструктаж, методические рекомендации для выполнения работ, справочная литература, вопросы к зачету.
Рабочая тетрадь предназначена для студентов колледжа 3-х курсов по специальности 19.02.04 Технология сахаристых продуктов.
ТОГБОУ СПО « ЖЕРДЕВСКИЙ КОЛЛЕДЖ САХАРНОЙ ПРОМЫШЛЕННОСТИ»
РАБОЧАЯ ТЕТРАДЬ
ДЛЯ ЛАБОРАТОРНЫХ РАБОТ ПО ДИСЦИПЛИНЕ
«ХИМИЯ»
______________________________________________________________
Ф.И.О. студента
______________________________________________________________
Группа Специальность
______________________________________________________________
Вариант
Учебный год_________________
ОГЛАВЛЕНИЕ
Введение……………………………………………………………………………… 6
Вводный инструктаж………………………………………………………………… 7
Лабораторные работы:
1. Определение поверхностного натяжения растворов……………… 8
2. Определение относительной вязкости……………………………10
3. Адсорбция уксусной кислоты активированным углем………….. 12
4. Получение и очистка коллоидных систем………………………… 16
5. Определение порога коагуляции…………………………………… 18
6. Влияние на набухание желатина различных соединений……….20
Литература…………………………………………………………………………..22
Введение
Физическая химия – наука, объясняющая строение и химические превращения веществ на основе законов физики. М.В.Ломоносов писал: «Химик без знания физики подобен человеку, который всего искать должен ощупом. И сие две науки так едины между собой, что одна без другой в совершенстве быть не могут».
Физическая химия является научным фундаментом химической технологии. Она позволит создавать вещества с заданными свойствами, получить особо чистые вещества, разрабатывать новые источники энергии, решать проблемы очистки отходов различных производств. Все большую роль играет физическая химия в развитии биологии и биотехнологии. Охрана окружающей среды, освоение богатств Мирового океана, покорение космоса непосредственно связаны с решением ряда конкретных физико-химических задач.
Физическая химия – количественная наука. Используя законы физической химии, можно получить количественные ответы на вопросы о том:
-сколько может получиться продуктов реакции,
- какую часть тепловой энергии можно использовать для получения работы с помощью тепловой машины,
- как используется энергия пищи для совершения работы в живых организмах,
- как произвести разделение смесей на индивидуальные вещества,
- под действием какой силы происходит обмен веществ между биологической клеткой и окружающей ее средой,
- с какой скоростью можно провести реакцию при данной температуре,
- как очистить металлы с помощью электрического тока и многие другие вопросы.
Вводный инструктаж
Поскольку физическая и коллоидная химия является научным фундаментом химической технологии, студенты должны научиться экспериментально подтверждать приобретенные теоретические знания. Рабочая тетрадь должна конкретизировать работу студента, сократить механическую работу по оформлению. В рабочей тетради шесть лабораторных работ. Первые три – по разделу «Физическая химия», следующие три – по разделу «Коллоидная химия».
Прежде чем приступить к выполнению работы студенты должны ответить на теоретические вопросы, затем внимательно прочитать выполнение анализа, инструкцию по технике безопасности и только после этого приступать к выполнению работы.
Студенты выполняют работы малыми группами по два – четыре человека. В процессе выполнения студенты должны научиться пользоваться приборами, правильно записывать результаты измерений, выполнять расчеты и делать выводы. После выполнения работы студенты должны ответить устно на контрольные вопросы или письменно на вопросы тестов.
Оценка за лабораторную работу складывается из оценки за выполнение работы, за ответ на теоретические вопросы или вопросы тестов и собеседования студента и преподавателя в процессе выполнения работы.
ЛАБОРАТОРНОЯ РАБОТА №1
Тема: Агрегатное состояние вещества
Наименование работы: ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ РАСТВОРОВ
Цель работы: Формирование умений по определению поверхностного натяжения жидкости сталагмометром.
Приобретаемые навыки и умения: Студенты смогут определять поверхностное натяжение растворов, выполнять расчеты и делать выводы.
Оснащение рабочего места: Сталагмометр с грушей, штативы, стаканчики на 50 мл, исследуемые растворы воды, спирта, янтарной кислоты
Техника безопасности: Общая при работе в лаборатории.
Литература: Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия,1988 с. 82 – 89.
Краткий справочник физико-химических величин / Под редакцией Равделя
и А.М. Пономаревой – Ленинград.: Химия, 1983.- 232 с.
Контрольные вопросы при допуске к лабораторной работе
Понятие поверхностной энергии?
Определение поверхностного натяжения.
Зависимость поверхностного натяжения от температуры?
Методические рекомендации
Перед началом работы сталагмометр тщательно промывают хромовой смесью, затем несколько раз споласкивают дистиллированной водой. Сталагмометр закрепляют в штативе в вертикальном положении.
Рисунок сталагмометра:

1. Выполнение анализа.
Сначала опыт проводят с дистиллированной водой, для которой известна величина поверхностного натяжения. Через резиновую трубку, надетую на верхний конец сталагмометра, грушей засасывают жидкость так, чтобы она стояла выше метки «а» (в трубке не должно быть пузырьков воздуха), при вытекании жидкости из сталагмометра, когда мениск дойдёт до метки «б», прекращают счёт капель. Опыт повторяют три раза, подсчитывают среднее число капель.
Разница между отдельными отсчётами не должна превышать 1-2 капели. Так же определяют число капель исследуемой жидкости.
2. Расчет результатов анализа.
1. ρ этилового спирта ρ = 789.5 кг/м³
2. ρ (0.5 М раствор янтарной кислоты) = 1001 кг/см3
Плотность кислоты устанавливают ареометром. Зная число капель воды и исследуемой жидкости и их плотности, вычисляют поверхностное натяжение по формуле:
nводы ·ρис
σис = σводы
nис ·ρводы
σводы – поверхностное натяжение воды
nводы – число капель воды
ρводы – плотность воды
ρис – плотность исследуемой жидкости
nис - число капель исследуемой жидкости
σводы = 72,13·10³ Дж/м² или Н/м (24°с)
Или рассчитывается по формуле:
σводы = [ 72,75+ 0,15(20-t°)]·10־³
Результаты сводим в таблицу
t° опыта =
| № опыта | Плотность ρг/см³ | Число капель | Среднее значение | Поверхностное натяжение |
| 1 | 2 | 3 |
| 1. 2. 3. 4. |
|
|
|
|
|
|
| Среднее |
|
|
|
|
|
|
3.Выводы.___________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
1. На каком принципе основано определение поверхностного натяжения в
сталагмометре и на приборе Ребиндера?
2. Расчётные формулы поверхностного натяжения?
Дата Оценка Подпись
ЛАБОРАТОРНАЯ РАБОТА №2
Тема: Агрегатное состояние вещества
Наименование работы: ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНОЙ ВЯЗКОСТИ ЖИДКОСТИ.
Цель работы: Формирование умений по определению относительной вязкости жидкости.
Приобретаемые навыки и умения: Студенты смогут определять вязкость жидкостей вискозиметром Гепплера, выполнять расчеты, делать выводы.
Оснащение рабочего места: секундомер, дистиллированная вода, металлический
шарик /свинцовый/, термостат, мерный цилиндр на 100 мл, стакан с водой, глицерин, меласса
или карамельная патока.
Техника безопасности: общая для работы в лаборатории.
Литература: Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия, 1988 с.82 – 89.
Краткий справочник физико-химических величин /Под редакцией А.А. Равделя
и А.М. Пономаревой – Ленинград.: Химия, 1983.- 232 с.
Контрольные вопросы при допуске к лабораторной работе
Вязкость. Определение вязкости.
Какое значение имеет вязкость жидкостей в производстве сахара?
Что такое внутреннее давление? Единица вязкости?
Методические рекомендации
При определении вязкости жидкости вискозиметром с падающим шариком учитывают следующее:
- шарик из известного материала, падающий в вязкой среде под
действием силы тяжести, встречает сопротивление, величина которого
выражается законом Стокса;
- снизу на шарик действует сила выталкивания, которая по закону
Архимеда равна массе вытесненной жидкости.
Учитывая равномерность падения шарика, вязкость рассчитывается по формуле Стокса.
1. Определение вязкости.
Определение относительной вязкости жидкости состоит в наблюдении скорости падения шарика в жидкости, вязкость которой измеряют и вычисляют по формуле Стокса:
2r²(ρ-ρ0) q
=
9u
Для измерения относительной вязкости опыт проводят с двумя жидкостями, у одной из которых удельная вязкость известна.
Из формулы Стокса следует:
ηводы (ρш –ρж)u2
η отн = 
(ρш –ρв)u1
где: η воды – коэффициент вязкости воды, Па*с
ρш – плотность шарика; ρш = 11336 кг/м³ для свинца
ρж – плотность жидкости; ρж = 1415 кг/м³ для карамельной
патоки
ρв – плотность воды; ρв = 1000 кг/м³
u1 – скорость падения шарика в жидкости, м/с
u2 – скорость падения шарика в воде, м/с
Скорость падения шарика вычисляют по формуле:
ℓ
u =  ,
,
τ
где ℓ – расстояние между метками (м)
τ – время падения шарика (сек)
2. Расчет результатов
2.1 Опыт с водой и карамельной патокой повторяют 4-5 раз и находят среднее значение. Полученные данные заносят в таблицу:
Таблица 1
| № опыта | ℓ | τ р-ра | τ воды | u1 | u2 | η отн |
| 1. 2. 3. 4. 5. |
|
|
|
|
|
|
| Среднее |
|
|
|
|
|
|
2.2. Расчет среднего значения скорости.
2.3. Расчет вязкости.
3.Вывод:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
1. Для каких жидкостей применим метод определения вязкости жидкости по
Стоксу? Расчётная формула?
2. Что такое удельная вязкость, относительная вязкость, единицы измерения?
3. Какие факторы влияют на величину вязкости?
Дата Оценка Подпись
ЛАБОРАТОРНАЯ РАБОТА №3
Тема: Поверхностные явления.
Наименование работы: АДСОРБЦИЯ УКСУСНОЙ КИСЛОТЫ АКТИВИРОВАННЫМ УГЛЕМ.
Цель работы: Формирование умений по определению количества адсорбированной кислоты, по определению зависимости величины адсорбции от равновесной концентрации.
Приобретаемые навыки и умения: Студенты смогут провести адсорбцию, определить количество адсорбированной кислоты, построить изотерму адсорбции, объяснить условия адсорбционного равновесия.
Оснащение рабочего места:12 колб конических на100-150 мл, 6 конических колб с пробками , 6 воронок, фильтры бумажные, бюретка для титрования, цилиндры на 5 и 10 мл, колбы для титрования цилиндры на25,50,100 мл, весы технические, груши резиновые, раствор 0,4 Н СН3СООН, 0,1 Н раствор NаОН, фенолфталеин, уголь активированный.
Техника безопасности: Для отбора пробы раствора кислоты пипеткой необходимо пользоваться резиновой грушей.
Норма времени: 180 минут или 4 академических часа.
Литература: 1. Краткий справочник физико-химических величин /Под редакцией А.А.
Равделя и А.М. Пономаревой – Ленинград.: Химия, 1983- 232 с.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия , 1988 – 288с
Контрольные вопросы при допуске к лабораторной работе
1. Адсорбция и ее виды
2. Характеристика твердых адсорбентов
3. Зависимость адсорбции от вида адсорбента, адсорбтива, растворителя
4. Зависимость адсорбции от концентрации адсорбтива и температуры
5. Дифильные молекулы и их ориентация на поверхности адсорбента.
Методические рекомендации
Зависимость адсорбции от концентрации адсорбируемого вещества в растворе при данной температуре выражается уравнением Лэнгмюра
Г = Г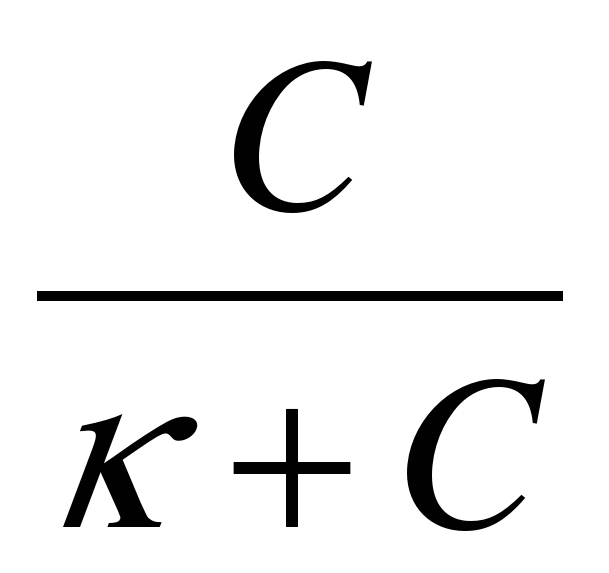
где: Г – концентрация адсорбируемого вещества на 1см2
поверхности адсорбента в момент адсорбционного равновесия;
Г - концентрация адсорбируемого вещества на 1см2 поверхности
адсорбента в момент адсорбционного равновесия;
С – молярная концентрация раствора в момент адсорбционного
равновесия (равновесная концентрация).
В сравнительно широких пределах концентраций зависимость адсорбции от концентрации выражается уравнением Фрейндлиха:
х/ m = аСn ,
где: х – общее количество растворенного вещества, адсорбированное массой m поглотителя и находящегося в равновесии с раствором концентрации С;
а и n – константы, характерные для данного процесса адсорбции и определяемых пределах, причем n
Адсорбированное количество вещества следовало бы относить не к единице массы, а к единице поверхности, но для мелкораздробленных веществ и однородных суспензий (например, суспензия активированного угля) эта поверхность растет пропорционально общей массе адсорбента.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Приготовление растворов
Пронумеровать 6 колб на 100 мл. Приготовить растворы уксусной кислоты путем разбавления исходного раствора концентрацией 0,4 моль/л в соответствии с данными таблицы 1. Объемы измеряют цилиндрами.
Таблица 1
| № колбы | 1 | 2 | 3 | 4 | 5 | 6 |
| Vсн3соон | 100 | 80 | 60 | 40 | 20 | 10 |
| V Н2Омл | 0 | 20 | 40 | 60 | 80 | 90 |
2. Определение концентраций растворов
2.1 Приготовленные растворы кислоты титруют 0,1 н раствором щелочи (титрованным) в присутствии фенолфталеина . Для титрования отбирают из первых двух колб по 5 мл кислоты. Из остальных по 10 мл. Проводят по три параллельных титрования. По среднему значению объемов щелочи, вычисляют концентрацию кислоты для каждого раствора.
Результаты сводим в таблицу 2.
Таблица 2
| Раствор 1 | Раствор 3 | Раствор 5 |
| № |
|
|
| № |
|
|
| № |
|
|
|
| 1 |
|
|
| 1 |
|
|
| 1 |
|
|
|
| 2 |
|
|
| 2 |
|
|
| 2 |
|
|
|
| 3 |
|
|
| 3 |
|
|
| 3 |
|
|
|
| ср |
|
|
| ср |
|
|
| ср |
|
|
|
| Раствор 2 | Раствор 4 | Раствор 6 |
| № |
|
|
| № |
|
|
| № |
|
|
|
| 1 |
|
|
| 1 |
|
|
| 1 |
|
|
|
| 2 |
|
|
| 2 |
|
|
| 2 |
|
|
|
| 3 |
|
|
| 3 |
|
|
| 3 |
|
|
|
| ср |
|
|
| ср |
|
|
| ср |
|
|
|
2.2. Проведение адсорбции
Взвешивают на технических весах по одному грамму порошкообразного активированного угля помещают в 6 пронумерованных колб с пробками. Мерной колбой отбирают по 50 мл соответствующих растворов кислот после установления концентраций их, помещают в колбы с активированным углем. Колбы закрывают пробками и периодически встряхивают течение 15-20 мин. Этого времени достаточно для достижения адсорбционного равновесия. В 6 следующих сухих пронумерованных колб устанавливают воронки с фильтрами. Растворы после адсорбции фильтруют в колбы под теми же номерами, отбрасывают первые2-3 мл фильтрата.
2.3. Определение равновесной концентрации кислоты.
Далее отбирают из первых 2 колб по 5 мл, из остальных по10 мл для титрования щелочью. Титрованием устанавливают концентрацию кислоты после проведения адсорбции, т.е. равновесную концентрацию. Результаты записывают в таблицу 3.
Таблица 3
| Раствор 1 | Раствор 3 | Раствор 5 |
| № |
|
|
| № |
|
|
| № |
|
|
|
| 1 |
|
|
| 1 |
|
|
| 1 |
|
|
|
| 2 |
|
|
| 2 |
|
|
| 2 |
|
|
|
| 3 |
|
|
| 3 |
|
|
| 3 |
|
|
|
| ср |
|
|
| ср |
|
|
| ср |
|
|
|
| Раствор 2 | Раствор 4 | Раствор 6 |
| № |
|
|
| № |
|
|
| № |
|
|
|
| 1 |
|
|
| 1 |
|
|
| 1 |
|
|
|
| 2 |
|
|
| 2 |
|
|
| 2 |
|
|
|
| 3 |
|
|
| 3 |
|
|
| 3 |
|
|
|
| ср |
|
|
| ср |
|
|
| ср |
|
|
|
3. Расчет количества адсорбированной кислоты и построение изотермы адсорбции.
3.1. Количество адсорбированной кислоты рассчитывают по формуле:
Г = 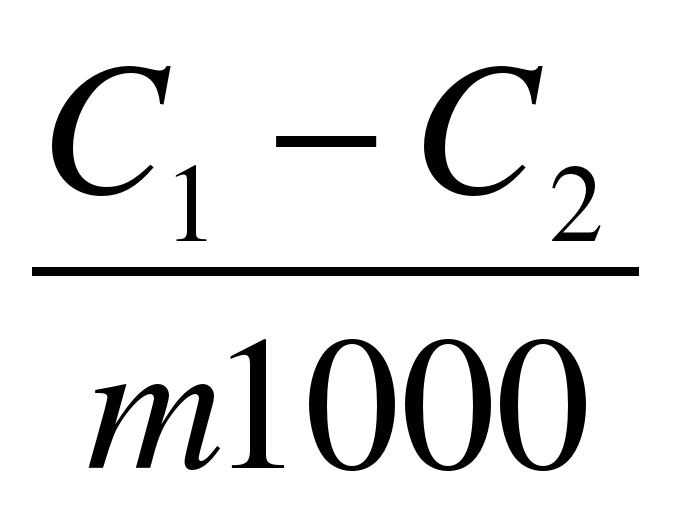 V СH3CCOH
V СH3CCOH
где C1 CH3COOH-концентрация кислоты до адсорбции, моль/л.
С2 СH3COOH-равновесная концентрация кислоты после адсорбции, моль/л.
V СH3CCOH-объем кислоты, взятый для адсорбции, 50 мл.
my-масса активированного угля, 1 г
Результаты сводим в таблицу 4.
Таблица 4
| № | С1СН3СООН | С2СН3СООН | Г моль/г |
| 1 |
|
|
|
| 2 |
|
|
|
| 3 |
|
|
|
| 4 |
|
|
|
| 5 |
|
|
|
| 6 |
|
|
|
3.2. Построение изотермы адсорбции

Г
моль/г

С2, моль/л
4. Вывод:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
1. Основные положения теории мономолекулярной адсорбции.
2. Объяснить строение изотермы адсорбции.
3. В какой момент достигается максимальная адсорбция при разных
температурах.
Дата Оценка Подпись
ЛАБОРАТОРНАЯ РАБОТА № 4
Тема: Получение и свойства коллоидных систем
Наименование работы: ПОЛУЧЕНИЕ КОЛЛОИДНЫХ СИСТЕМ.
Цель работы: Формирование умений по получению коллоидных систем разными методами, проводить очистку золей диализом.
Приобретаемые навыки и умения: Студенты смогут получать растворы гидрозоля гидроксида железа (III) методом пептизации и гидролиза, проводить очистку золя диалезом.
Оснащение рабочего места: Колбы плоскодонные на 200 мл, водяная баня, воронки для фильтрования, фильтры бумажные, пипетка, пробирки, дистиллированная вода, хлорид железа 3, 2%-ный ( по массе ) хлорид железа 3, 1М., р-р аммиака, хлорид железа 3 насыщенный, хлорид железа – 50%-ный р-р ( по массе ), щавелевая кислота 20% ( по массе ), диализатор.
Техника безопасности: Необходимо выполнять правила безопасности при работе с электроприборами, реактивы отбирать только мензурками, мерными цилиндрами, пипетками.
Норма времени: 90 мин
Литература:1.Краткий справочник физико-химических величин /Под редакцией
А.А. Равделя и А.М. Пономаревой – Ленинград.: Химия, 1983.- 232 с.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия,1988 – 288 с.
Контрольные вопросы при допуске к лабораторной работе
Укажите характерные свойства коллоидных систем и их отличие от истинных растворов.
Что такое агрегативно и кинетически устойчивые системы?
Признаки коллоидного состояния?
Как освобождают коллоидные растворы от примесей электролитов?
Методические рекомендации
Для выполнения работы необходимо усвоить материал темы 2.1 «Получение и свойства коллоидных систем», «Строение мицеллы гидрозоля».
ВЫПОЛНЕНИЕ РАБОТЫ
1. ПОЛУЧЕНИЕ ЗОЛЯ ГИДРОКСИДА ЖЕЛЕЗА (III) МЕТОДОМ ГИДРОЛИЗА.
Нагреть до кипения 50 мл. дистиллированной воды. Добавить 10 мл. 2%-ного (по массе) хлорида железа (III) и кипятить ещё несколько минут. Мицелла образуется за счет адсорбции ионов FeO+, получившихся в результате гидролиза, на поверхности частиц Fe(OH)3.
Противоионами служат Cl¯. Формула мицеллы:
2. ПОЛУЧЕНИЕ ЗОЛЯ ГИДРОКСИДА ЖЕЛЕЗА (III) МЕТОДОМ ПЕПТИЗАЦИИ.
В колбу на 200 мл. поместить 5 мл. 1 М FeCl3 и добавить 100 мл. воды. Осадить Fe3+ небольшим избытком раствора аммиака. Колбу заполнить водой доверху. Дать осадку отстояться и многократно деконтировать до исчезновения запаха аммиака. Объем раствора довести до 150 мл. Добавить пептизатор -15 – 20 капель насыщенного раствора хлорида железа(III), нагреть раствор на водяной бане, взбалтывая. Если осадок останется, то добавить ещё несколько капель пептизатора, продолжая нагревание.
Уравнение реакции:
________________________________________________________________________________
Формула мицеллы:
3. ПОЛУЧИТЕ ЗОЛЬ ГИДРОКСИДА ЖЕЛЕЗА (III) И ОЧИСТИТЕ ЕГО МЕТОДОМ ДИАЛИЗА.
Получите удобным способом в условиях вашей лаборатории золь гидроксида железа (III). Затем в коллоидной мешочек налейте горячий золь Fe(OH)3. Подвесьте мешочек на стеклянной палочке и погрузите в стакан с горячей дистиллированной водой. Повышенная температура способствует ускорению процесса. Через 15 – 10 мин. Определите присутствие ионов Cl¯ и отсутствие окрашивания в воде, омывающей мешочек. Отметьте по окраске, прошли ли мицеллы Fe(OH)3 через мембрану?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
1. Какими методами получают коллоидные системы?
2. Основные условия получения коллоидных систем?
3. Строение мицеллы гидрозоля на примере гидроксида железа (III).
Дата Оценка Подпись
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема: Электрические свойства, стабилизация и коагуляция золей.
Наименование работы: Определение порога коагуляции золя гидроксида железа.
Цель работы: Формирование умений по определению порога коагуляции золя, проверка правила Шульца-Гарди.
Приобретаемые навыки и умения: Студенты смогут определить и рассчитать порог коагуляции гидрозоля под действием электролитов, не взаимодействующих с ионами мицеллы.
Оснащение рабочего места: 24 пробирки в штативах, бюретки, растворы: хлорида калия 2 молярный, сульфата калия 0,05 молярный, гексацианоферрата (III) калия 0,0005 молярный.
Техника безопасности: общая для работы в лаборатории.
Норма времени: 90 минут.
Литература:1. Краткий справочник физико-химических величин / Под редакцией
А.А.Равделя и А.М. Пономаревой – Ленинград.: Химия, 1983.- 232 с.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия,1988 – 88 с.
Контрольные вопросы при допуске к лабораторной работе
1.Какие системы называются золями?
2.Что называют коагуляцией?
3.Виды коагуляции.
4.Концентрационная коагуляция.
5.Нейтрализщационная коагуляция.
Методические рекомендации
Для выполнения работы необходимо хорошо освоить правила образования гидрозолей, уметь составлять формулы мицелл гидрозолей. Необходимо повторить способы получения и разрушения золей.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Получить золь Fe(OH)3.
Для этого нагреть до кипения 50мл. дистиллированной воды. Добавить 10мл. 2%-ного хлорида железа ( III) и кипятить ещё несколько минут. Мицелла образуется за счет адсорбции ионов FeO+, получившихся в результате гидролиза на поверхности частиц Fe(OH)3. Противоионам служат ионы Cl¯. Формула мицеллы:
Можно использовать коллоидные растворы, полученные на предыдущей лабораторной работе.
2.Проведение коагуляции.
Подготовить три серии пробирок по восемь в каждой. Налить в четыре пробирки по 5 мл. золя. В другие четыре – соответствующие количества дистиллированной воды и раствор электролита (см. таблицу 1).
Таблица 1
|
№ пробы |
золь, мл. |
вода, мл. |
электролит | Помутнение через 30 минут |
| KCl | K2SO4 | K3[Fe(CN)6)] |
| 1 | 5 | 4,5 | 0,5 |
|
|
|
| 2 | 5 | 4 | 1 |
|
|
|
| 3 | 5 | 3 | 2 |
|
|
|
| 4 | 5 | 1 | 4 |
|
|
|
Смешать попарно раствор электролита и золя при встряхивании. Получить четыре раствора, в которых концентрация золя одинакова (1:1), концентрация электролита в каждой следующей пробирке больше, чем в предыдущей в два раза. Через 30 мин. отметить, в каких пробирках произошла явная коагуляция (помутнение). При помутнении поставить в таблице знак (+). Объём золя, растворов солей и воды необходимо отмерять бюретками. Пробирки с одним и тем же электролитом размещать в штативах в ряд от более низкой концентрации к более высокой. Отметить минимальную концентрацию, необходимую для коагуляции, и рассчитать приближенное значение порогов коагуляции.
 С·V
С·V
Спор. =  Vобщ. Vобщ = V+Vзоля
Vобщ. Vобщ = V+Vзоля
Где: С – концентрация электролита, моль/л.
V - наименьший объём раствора электролита, достаточный для коагуляции, мл.
Vзоля – объём золя, мл.
3. Вывод.
В отчете указать коагулирующие ионы и соблюдение правила Шульца-Гарди.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
1.Определение порога коагуляции.
2. Факторы, влияющие на порог коагуляции.
3. Правила определения порога коагуляции.
Дата Оценка Подпись
ЛАБОРАТОРНАЯ РАБОТА № 6
Тема: Высокомолекулярные соединения и их растворы.
Наименование работы: ВЛИЯНИЕ ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА НАБУХАНИЕ ЖЕЛАТИНА.
Цель работы: Формирование умений по определению степени набухания высокомолекулярных соединений.
Приобретаемые навыки и умения: Студенты смогут определять степень набухания высокомолекулярных соединений.
Норма времени: 90 минут
Техника безопасности: Общая для работающих в лаборатории.
Оснащение рабочего места: пробирки мерные 7 шт, желатин, 0,025
нормальные растворы HCl и NaOH, 0,1нормальные растворы KCl, NaCl, К2SO4, KCNS.
Литература:1. Краткий справочник физико-химических величин /Под редакцией
А.А.Равделя и А.М. Пономаревой – Ленинград.: Химия, 1983 - 232 с.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М: Химия, 1988 – 288 с.
Контрольные вопросы при допуске к лабораторной работе
1. Характеристика полимеров.
2. Какой процесс называют набуханием.
3. Набухание ограниченное и неограниченное.
4. Что называется студнем? Методы получения.
5. Применение студнеобразования в пищевой промышленности.
Методические рекомендации
Для выполнения работы необходимо знать строение и свойства полимеров. Условия набухания полимеров в различных средах. Какие по составу полимеры набухают в большей степени в полярных и неполярных растворителях.
ВЫПОЛНЕНИЕ РАБОТЫ
1. В семь мерных пробирок одинакового диаметра вносят по 0,3 г порошка желатина. Из соответствующих бюреток в каждую пробирку наливают по 5 мл различных растворов (см. таблицу 1). Пробирки осторожно встряхивают, чтобы частицы желатина опустились на дно, определяют высоту осадка желатина до набухания. После этого, встряхнув пробирки несколько раз, оставляют их в покое на 40 – 50 мин. По истечении этого времени каждую пробирку ещё раз встряхивают, дают осадку осесть, измеряют высоту набухшего осадка желатина (с каждой пробиркой измерения повторяют 2 раза). Данные заносят в таблицу.
Таблица 1
| № пробирки | Концентрация моль/ л | Приливаемый раствор | Высота осадка, мм |
| до набухания | после набухания |
| 1 | - | Вода |
|
|
|
|
| 2 | 0,025 | HCl |
|
|
|
|
| 3 | 0,025 | NaOH |
|
|
|
|
| 4 | 0,1 | NaCl |
|
|
|
|
| 5 | 0,1 | KCl |
|
|
|
|
| 6 | 0,1 | К2SO4 |
|
|
|
|
| 7 | 0,1 | KCNS |
|
|
|
|
2. Вывод.
На основании полученных данных делают вывод о влиянии кислоты, щелочи и солей на процесс набухания, а также о влиянии природы анионов.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для защиты лабораторной работы
Чем отличается высаливание высокомолекулярного вещества от коагуляции золей электролитами?
Как влияет на свойства растворов белков изменение рН?
Где используются особенности диффузии низкомолекулярных веществ в студнях?
Явление синерезиса.
5. Как влияет на растворы высокомолекулярных соединений действие
кислот, оснований, солей и почему?
Дата Оценка Подпись
ЛИТЕРАТУРА
Белик В.В.
Физическая и коллоидная химия: учебник для студ. сред. проф. учеб. заведений / В.В. Белик, К.И. Киенская. – 3-е изд., стер. – М.: Издательский центр «Академия», 2007.
Белик В.В.
Физическая и коллоидная химия: учебник для студ. учреждений сред. проф. образования / В.В. Белик, К.И. Киенская. – 5-е изд., стер. – М.: Издательский центр «Академия», 2010.
Ипполитов Е.Г.
Физическая химия: Учебник для студ. высш. учеб. заведений / Е.Г. Ипполитов, А. В. Артемов, В.В. Батраков; под ред. Е.Г. Ипполитова. – М.: Издательский центр «Академия», 2010.
Лукьянов А.Б.
Физическая и коллоидная химия: Учебник для техникумов. – 2-е изд., перераб. И доп. – М.: Химия.
24


 Получите свидетельство
Получите свидетельство Вход
Вход







 С·V
С·V








 Материал "Руководство по проведению лабораторных работ по дисциплине «Химия»" (0.24 MB)
Материал "Руководство по проведению лабораторных работ по дисциплине «Химия»" (0.24 MB)
 0
0 594
594 71
71 Нравится
0
Нравится
0


