
ПРАКТИКУМ
ДЛЯ УЧАЩИХСЯ 8 КЛАССА

Данное методическое пособие по ХИМИИ «Практикум для 8 класса» составлено в соответствии с действующей рабочей программой и разработан на основе обязательного минимума содержания химии для основной общеобразовательной школы и требований к уровню подготовки учащихся, что явилось главным принципом его структурирования.
Во введении изложены правила техники безопасности при работе в химической лаборатории, сведения о посуде, оборудовании и приборах, используемых при проведении лабораторных работ.
Первая часть практикума посвящена практическим работам по всем темам курса, вторая часть – контролю знаний, в которой даны разнообразные самостоятельные и контрольные работы согласно действующей рабочей программе.
Предлагаемые варианты проверки знаний учитывают оценку не только теоретических знаний, но и практических умений. На лабораторных и практических занятиях устанавливается связь между теоретическими и практическими знаниями и умениями, облегчается понимание фактического материала.
Проверяются знания материала по химии при решении задач, в форме тестов, текущих самостоятельных и контрольных работ. На итоговой контрольной работе осуществляется учет знаний учащихся по всему курсу предмета

Соблюдать все указания учителя (преподавателя) по безопасному обращению с реактивами и растворами, порядку выполнения работы.
Подготовленный к работе прибор, установку показать учителю (преподавателю) или лаборанту.
Запрещается самостоятельно проводить любые опыты, не предусмотренные данной работой.
Запрещается выносить из кабинета и вносить в него любые вещества без разрешения учителя (преподавателя).
Постоянно поддерживать порядок на рабочем месте, обо всех разливах растворов, а также о рассыпанных твердых реактивах немедленно сообщить учителю преподавателю) или лаборанту. Самостоятельно убирать любые химреактивы запрещается.
Обо всех неполадках в работе оборудования необходимо ставить в известность учителя (преподавателя) или лаборанта, устранять самостоятельно неисправности запрещается.
Перед проведением работы с нагреванием жидкости, использованием едких paстворов надеть защитные очки. Не оставлять без присмотра работающие нагревательные приборы.
Для нагревания жидкостей использовать только тонкостенные сосуды, наполненные жидкостью не более чем на треть. В процессе нагревания не направлять горлышко сосудов на себя и на своих товарищей, не наклоняться над сосудами и не заглядывать в них.
Запрещается пробовать любые растворы и реактивы на вкус, а также принимать пищу и напитки в кабинете химии.

При разливе водного раствора кислоты или щелочи, а также при рассыпании твердых реактивов немедленно сообщить об этом учителю (преподавателю) или лаборанту. Не убирать самостоятельно любые вещества.
При разливе легковоспламеняющихся жидкостей или органических веществ немедленно погасить открытый огонь спиртовки и сообщить об этом учителю (преподавателю) или лаборанту.
При разливе легковоспламеняющейся жидкости и ее воспламенении немедленно сообщить об этом учителю (преподавателю) и по его указанию покинуть помещение.
В случае, если разбилась лабораторная посуда, не собирать ее осколки незащищенными руками, а использовать для этой цели щетку и совок.
При получении травмы сообщить об этом учителю (преподавателю), которому немедленно оказать первую помощь пострадавшему и сообщить администрации учреждения.
Погасить спиртовку специальным колпачком, не задувать пламя спиртовки ртом, а также не гасить его пальцами
Привести в порядок рабочее место, сдать все оборудование, приборы, реактивы учителю (преподавателю) или лаборанту, отработанные водные растворы слить в стеклянный сосуд вместимостью не менее
л. Проветрить помещение и тщательно вымыть руки с мылом.
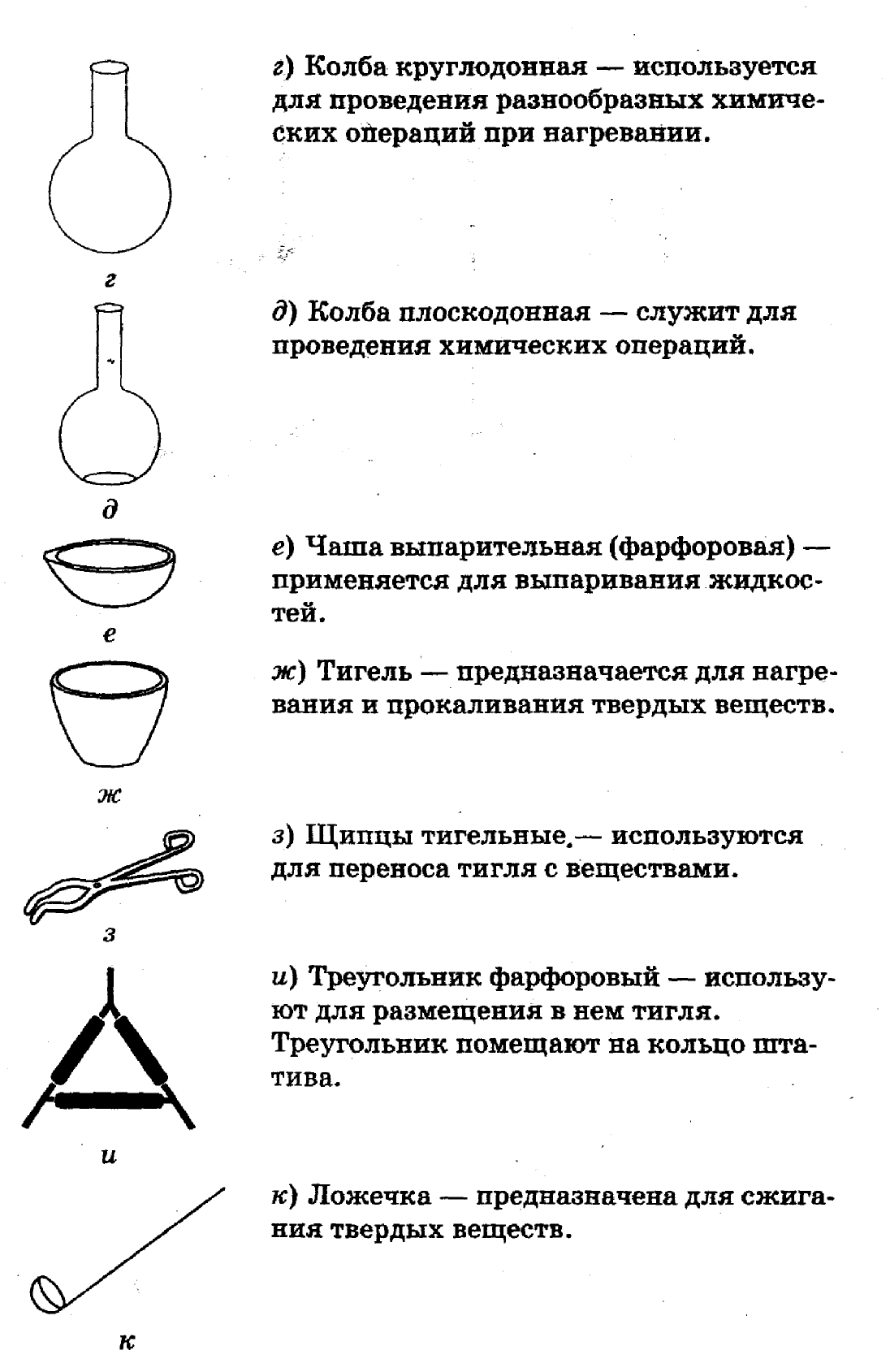
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
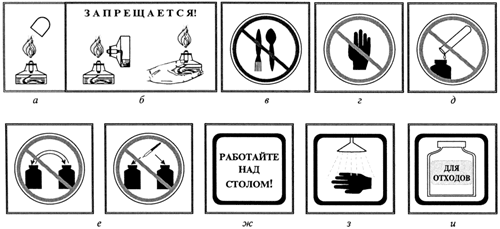
Тушить спиртовку только колпачком (а);
запрещается зажигать одну спиртовку от другой,
передавать спиртовку в зажженном виде (б);
запрещается пробовать вещества на вкус (в);
запрещается брать вещества руками (г);
запрещается выливать или высыпать
остатки реактивов в склянки и банки,
из которых они были взяты (д);
запрещается менять пробки и пипетки
от различных банок или склянок (е);
работать только над столом (ж);
смыть водой, затем нейтрализующим веществом реактив,
если он попал на кожу или одежду (з);
собирайте остатки веществ в
специально предназначенную посуду (и)
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
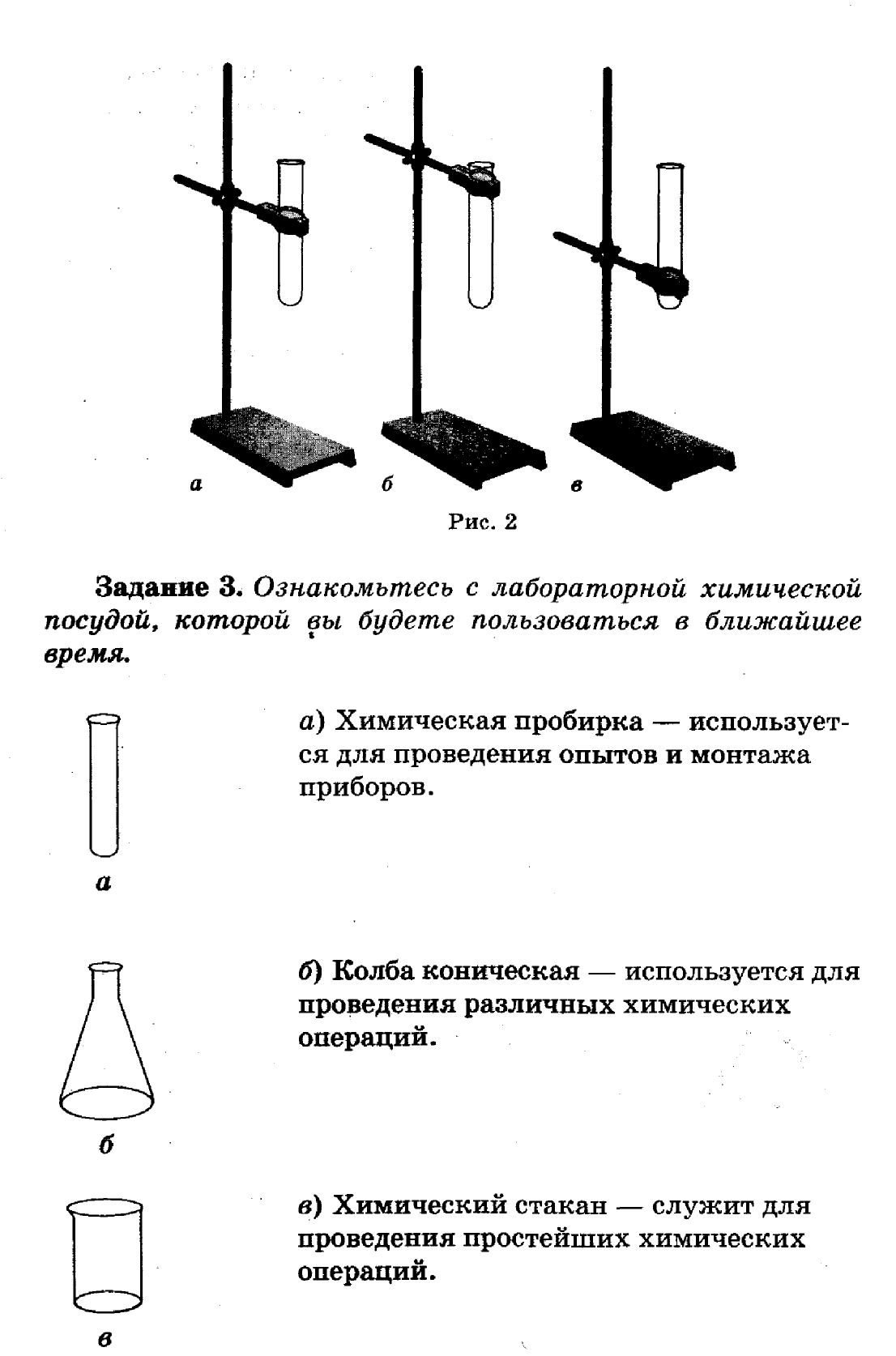


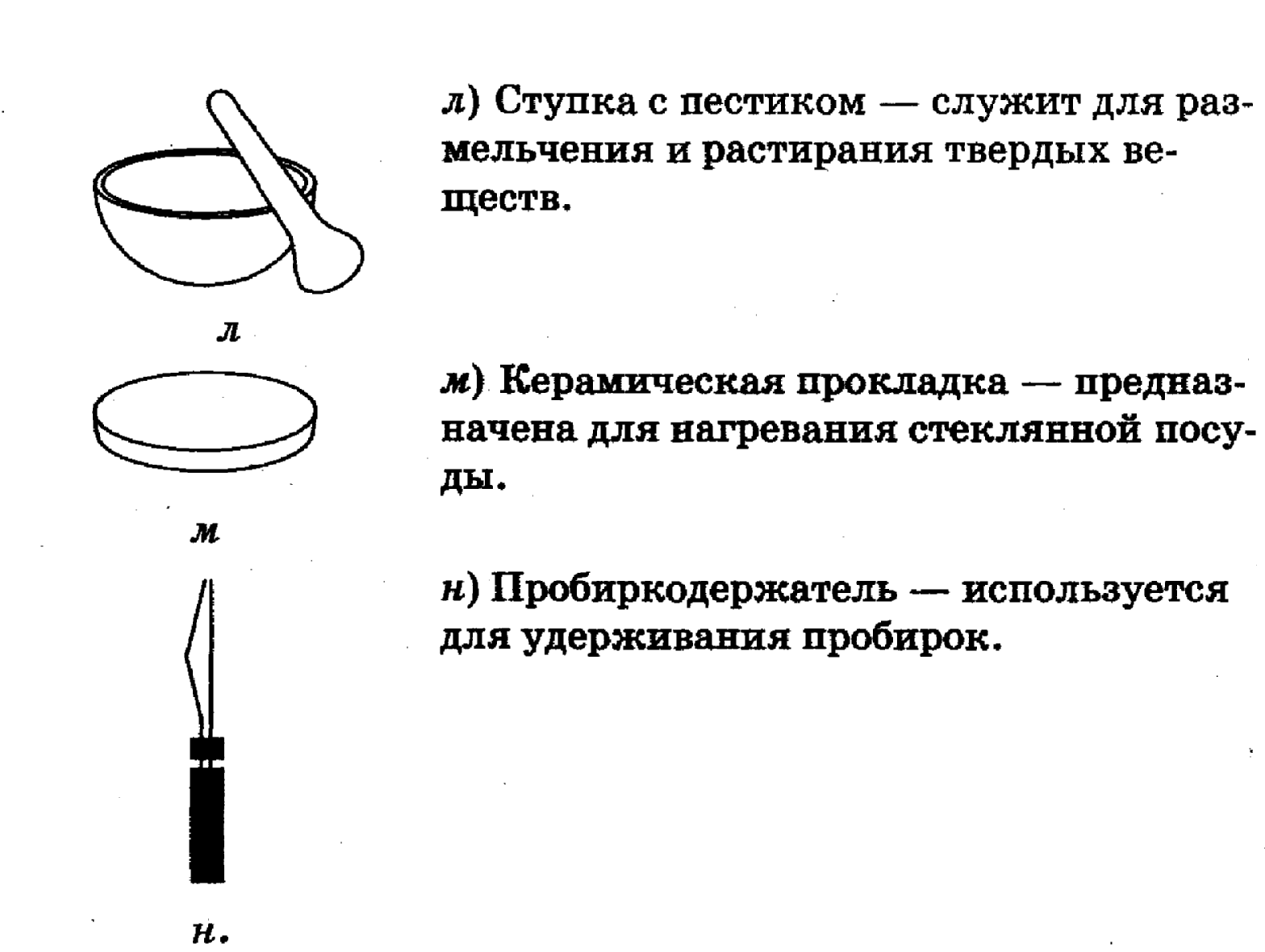

Практическая работа №1
ОЗНАКОМЛЕНИЕ С ЛАБОРАТОРНЫМ ОБОРУДОВАНИЕМ.
ПРОВЕДЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ.
Цели и задачи: познакомиться с химическим оборудованием, с правилами работы в хим. кабинете согласно инструкции в учебнике (стр. 48, 51); выполнить и проанализировать предложенные учителем опыты; сделать выводы.
Материалы и оборудование: лабораторное оборудование (назвать самостоятельно); химические реактивы для опыта: Na2SO4, BaCl2, Zn, H2SO4.
Ход работы
1 группа
1. Знакомство с предложенным лабораторным оборудованием и правилами работы в кабинете химии
Задание: нарисуйте и назовите предложенное лабораторное оборудование, заполняя таблицу.
| Рисунок | название |
|
|
|
2. Знакомство с признаками химических реакций
Реактивы: Na2SO4, BaCl2, Zn, H2SO4.
Задание: проведите предложенные опыты, выясните по каким признакам можно определить, что реакции протекли, занесите данные в таблицу
В пробирку налейте 2 мл Na2SO4 и добавьте 3-4 капли раствора BaCl2. Что наблюдаете?
В пробирку положите 2-3 гранулы цинка (Zn) и осторожно прилейте серную кислоту (H2SO4). Нагрейте пробирку на пламени спиртовки, но не доводите до кипения. Какие признаки химических реакций вы наблюдаете?
| Выполняемый опыт | Что наблюдал (а) Признаки реакций | Вывод |
|
|
|
|
3. Сделайте вывод по работе
Практическая работа №1
ОЗНАКОМЛЕНИЕ С ЛАБОРАТОРНЫМ ОБОРУДОВАНИЕМ.
ПРОВЕДЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ.
Цели и задачи: познакомиться с химическим оборудованием, с правилами работы в хим. кабинете согласно инструкции в учебнике (стр. 48, 52); выполнить и проанализировать предложенные учителем опыты; сделать выводы.
Материалы и оборудование: лабораторное оборудование (назвать самостоятельно); химические реактивы для опыта: Fe, CuCl2, CaCO3, HCl
Ход работы
2 группа
1. Знакомство с предложенным лабораторным оборудованием и правилами работы в кабинете химии
Задание: нарисуйте и назовите предложенное лабораторное оборудование, заполняя таблицу.
| Рисунок | название |
|
|
|
2. Знакомство с признаками химических реакций
Задание: проведите предложенные опыты, выясните по каким признакам можно определить, что реакции протекли, занесите данные в таблицу
Реактивы: Fe, CuCl2, CaCO3, HCl
Железный гвоздь опустите в раствор CuCl2. Осторожно нагрейте пробирку над пламенем спиртовки, что наблюдаете?
К кусочкам мела или мрамора осторожно прилейте 2-3 мл соляной кислоты (HCl), чтобы ее полностью покрылись кусочки. Зажгите лучинку и внесите ее в стакан. Какие признаки химических реакций вы наблюдаете?
| Выполняемый опыт | Что наблюдал (а) Признаки реакций | Вывод |
|
|
|
|
3. Сделайте вывод по работе
Практическая работа №1
ОЗНАКОМЛЕНИЕ С ЛАБОРАТОРНЫМ ОБОРУДОВАНИЕМ.
ПРОВЕДЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ.
Цели и задачи: познакомиться с химическим оборудованием, с правилами работы в хим. кабинете согласно инструкции в учебнике (стр 105-106); выполнить и проанализировать предложенные учителем опыты; сделать выводы.
Материалы и оборудование: лабораторное оборудование (назвать самостоятельно); химические реактивы для опыта: HCl, Na2SO3, CuSO4, NaOH
Ход работы
3 группа.
1. Знакомство с предложенным лабораторным оборудованием и правилами работы в кабинете химии
Задание: нарисуйте и назовите предложенное лабораторное оборудование, заполняя таблицу.
| Рисунок | название |
|
|
|
2. Знакомство с признаками химических реакций
Задание: проведите предложенные опыты, выясните по каким признакам можно определить, что реакции протекли, занесите данные в таблицу
Реактивы: HCl, Na2SO3, CuSO4, NaOH, (NH4Cl, KOH)
К раствору сульфата меди CuSO4 добавьте несколько капель раствора NaOH. Встряхните пробирку. Какие признаки химических реакций вы наблюдаете?
К соляной кислоте HCl прилейте раствор (по каплям) сульфита натрия Na2SO3. Осторожно понюхайте, соблюдая технику безопасности.
Или к раствору хлорида аммония NH4Cl прибавьте раствор гидроксида калия KOH. Осторожно понюхайте, соблюдая технику безопасности. Какие признаки химических реакций вы наблюдаете?
| Выполняемый опыт | Что наблюдал (а) Признаки реакций | Вывод |
|
|
|
|
3. Сделайте вывод по работе
Практическая работа № 2.
ОЧИСТКА ЗАГРЯЗНЕННОЙ ПОВАРЕННОЙ СОЛИ
Цели и задачи: овладеть способами очистки веществ от примесей: фильтрованием и выпариванием
Оборудование и реактивы: фильтровальная бумага, воронка, плоскодонная колба, химический стакан, стеклянная палочка, фарфоровая чашка или покровное стекло, спиртовка, держатель, спички; смесь поваренной соли с крупным речным песком
Ход работы
1. Вспомните правила поведения и технику безопасности при выполнении процессов растворения, фильтрования, нагревания и выпаривания.
Внимательно рассмотрите смесь поваренной соли и речного песка. Опишите их физические свойства: агрегатное состояние, цвет, запах, растворимость в воде. Заполните таблицу
| Физические свойства | соль | песок |
|
|
|
|
Какое из этих свойств можно использовать для разделения смеси песка и соли.
2. Выполните этапы работы согласно инструкции в учебнике на стр.52
Растворение загрязненной поваренной соли
Очистка раствора фильтрование
Выпаривание раствора.
Занесите результаты в таблицу:
| Выполнение работы | Описание | Вывод |
| Растворение загрязненной поваренной соли |
|
|
| Очистка раствора фильтрованием |
|
|
| Выпаривание раствора. |
|
|
3. Сделайте общий вывод по работе
Практическая работа № 3.
ПОЛУЧЕНИЕ КИСЛОРОДА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ.
Цели и задачи: познакомиться со способами получения, собирания и хранения кислорода в лаборатории, с его физическими и химическими свойствами.
Материалы и оборудование: лабораторное оборудование (назвать самостоятельно); химические реактивы для опыта.
Ход работы
А. Получение кислорода путем разложения перманганата калия методом вытеснения воздуха.
Соберите прибор, как показано на рисунке.
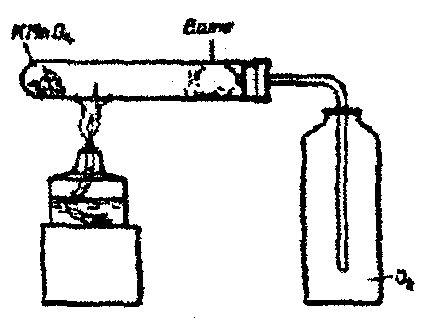
Поместите в пробирку на 1/5 ее объема перманганата калия. В отверстие пробирки вставьте неплотный кусочек ваты и закройте пробирку пробкой с газоотводной трубкой. Проверьте прибор на герметичность: опустите конец газоотводной трубки в стакан с водой, выделившийся из трубки пузырек свидетельствует о герметичности прибора. Пробирку с перманганатом калия закрепите горизонтально в лапке штатива. Газоотводную трубку, погрузите почти до дна склянки – приемника. Нагревайте пробирку по всем правилам. Полноту наполнения склянки кислородом контролируйте тлеющей лучинкой. После заполнения склянки кислородом, закройте ее стеклянной пластиной и сохраните кислород для следующих опытов.
2. Сжигание угля в кислороде
В железной ложечке нагревайте кусочек древесного угля в пламени спиртовки до красного каления. Внесите тлеющий уголек в склянку с собранным кислородом. Сделайте выводы.
3. Сжигание серы в кислороде.
4. Сжигание железной проволоки в кислороде.
(дополн – алюминий, кальций, натрий, красный фосфор)
Заполнение таблицы:
| Опыт
| Уравнение реакции | Что наблюдал (а) | Вывод – что узнал |
|
| KMnO4→K2MnO4 + MnO2 + ? | + проба лучиной |
|
Общий вывод по результатам работы.
Практическая работа № 4.
ПРИГОТОВЛЕНИЕ РАСТВОРОВ СОЛЕЙ С ОПРЕДЕЛЕННОЙ МАССОВОЙ ДОЛЕЙ РАСТВОРЕННОГО ВЕЩЕСТВА.
Цели и задачи: научиться рассчитывать массовую долю растворенного вещества в растворе, отработать навыки работы с весами, мерным цилиндром для приготовления необходимого раствора.
Материалы и оборудование: лабораторное оборудование (назвать самостоятельно); соли.
Задание:
1. См. стр. 108 – работа № 3.
1 группа:
1. Приготовьте 20 грамм водного раствора поваренной соли с массовой долей соли 5 %.
2. При полоскании горла применяют 2 % раствор борной кислоты. Приготовьте 50 грамм этого раствора.
2 группа:
1. Приготовьте 25 грамм водного раствора хлорида калия с массовой долей соли 4 %.
2. Для школьной аптечки требуется 2 % раствор соды. Приготовьте 40 грамм этого раствора.
3 группа:
1. Приготовьте 10 грамм водного раствора соды (карбоната натрия) с массовой долей соли 10 %.
2. При ожогах электрическим током накладывают повязку, смоченную 1 % раствором KMnO4 . Приготовьте 80 грамм этого раствора.
Ход работы
Для приготовления рабочего раствора решите задачу.
Заполните таблицу:
| № | опыт | Вес соли | Объем воды | Вывод |
|
|
|
|
|
|
Вывод по работе.
Практическая работа №5
РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ: «ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Цели и задачи: применить знания о свойствах основных классов неорганических соединений при экспериментальном решении задач; сформировать практические умения по превращению веществ разных классов друг в друга.
Планируемые результаты обучения: уметь подбирать вещества и проводить химические реакции, необходимые для решения определенной задачи, соблюдая правила работы в кабинете химии.
Реактивы и оборудование: Вариант 1: Гидроксид меди(II), раствор серной кислоты, вода, индикатор, раствор соляной кислоты, раствор гидроксида натрия; спиртовка, пробирки, пробиркодержатель.
Вариант 2: хлорид железа, раствор гидроксида натрия, мел (карбонат кальция), раствор соляной кислоты, раствор серной кислоты, индикатор, раствор хлорида натрия; спиртовка, пробирки, пробиркодержатель.
Ход работы:
ОСТОРОЖНО! КИСЛОТЫ И ЩЁЛОЧИ!
Вариант 1.
Осуществите превращения опытным путем:
CuSO4 ← Cu(OH)2→CuO
Докажите опытным путем, что серная кислота обладает кислотным характером
В двух пробирках находятся: вода, гидроксид натрия. Определите в какой пробирке находится каждое из веществ. К какому классу относится каждое из веществ?
Вариант 2.
Осуществите превращения опытным путем:
FeCl3 → Fe(OH)3→Fe2O3
Получите опытным путем углекислый газ из карбоната кальция.
В двух пробирках находятся: хлорид натрия, серная кислота. Определите в какой пробирке находится каждое из веществ. К какому классу относится каждое из веществ?
Данные занесите в таблицу
| № опыта | Что сделали (опыт) | Что наблюдали | Уравнение реакции
| Вывод – что узнали |
|
|
|
|
|
|
Общий вывод по работе.
Практическая работа №6
ПОЛУЧЕНИЕ СОЛЯНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЕ СВОЙСТВ
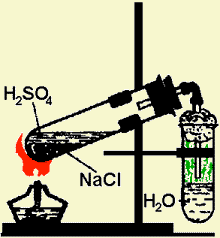
Цели и задачи: Получить соляную кислоту и изучить её свойства. Осуществить реакции, характеризующие свойства HCl, имея Mg, CaO, KOH, AgNO3
Оборудование и реактивы: металлический штатив с лапкой, две пробирки, пробирка с газоотводной трубкой, спиртовка, лопаточка, влажный тампон, пробирки; раствор серной кислоты (1:1), хлорид натрия, индикатор, нитрат серебра (1%), раствор соляной кислоты (1:3), цинк, магний, медная проволока, оксид меди (II), гидроксид натрия, карбонат натрия.
Ход работы:
1. Поместите в сухую пробирку две лопаточки хлорида натрия и прилейте 4-5 капель раствора концентрированной серной кислоты. К пробирке присоедините газоотводную трубку, её конец должен быть погружён в пробирку с 1мл воды, в которую опускают кусочек лакмусовой бумажки. Проследите за тем, чтобы конец газоотводной трубки был на расстоянии 0,5 см от поверхности воды (ни в коем случае не погружайте её в воду! Почему?). Пробирку, в которую будет поступать хлороводород, прикройте влажным ватным тампоном (почему?).
Смесь слабо нагрейте и, когда изменится окраска лакмусовой бумажки, прекратите нагревание (следите, чтобы кислоту не перебросило во вторую пробирку с водой).
2. Вынув тампон и лакмусовую бумажку, прилейте к жидкости 2-3 капли нитрата серебра. Что наблюдаете?
3. Добавьте в пробирку с соляной кислотой магниевые или цинковые опилки. Что происходит? Какой газ выделяется? Произойдет ли реакция при добавлении медной проволоки?
4. Прилейте к соляной кислоте с индикатором фенолфталеином несколько капель гидроксида кальция. Что наблюдаете? Как называется данный тип реакции?
5. К оксиду меди добавьте несколько капель соляной кислоты. Раствор нагрейте. Какие изменения произошли?
6. К карбонату кальция прилейте соляную кислоту. Какой газ выделяется?
Напишите уравнения происходящих реакций!
Данные занесите в таблицу
| № опыта | Что сделали (опыт) | Что наблюдали | Уравнение реакции
| Вывод – что узнали |
|
|
|
|
|
|
Общий вывод по работе.
Оборудование и реактивы: спиртовка, четыре пробирки; раствор соляной кислоты (1:3), цинк, оксид меди (II), гидроксид натрия, карбонат натрия.

ТЕМА. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ.
Самостоятельная работа по теме
«Вещества. Свойства веществ»
Вариант I
1. Выпишите из приведенного перечня физических тел (предметов) и веществ названия веществ: кирпич, поваренная соль, мел, железная кнопка, вода, сахар, проволока, свеча, химический стакан, стеклянная воронка.
2. В химической посуде без этикеток находятся медь, алюминий, мрамор, уксусная кислота и поваренная соль. По каким свойствам можно распознать эти вещества? Выпишите названия веществ и наиболее характерный для их распознавания признак.
Вариант II
1. В химическом кабинете используется оборудование, сделанное из разных веществ. Например: а) стеклянные пробирки, колбы, мерные цилиндры, воронки, химические стаканы; б) железные штативы, держалки для пробирок, ложечки и тигли для прокаливания веществ; в) фарфоровые ступки, пестики, шпатели. Приведите примеры предметов, используемых в быту и изготовленных из этих же веществ.
2. Приведите пример предмета, сделанного из разных веществ.
Вариант III
1. Приведите примеры двух тел, состоящих из одного вещества, и одного тела, состоящего из разных веществ.
2. Сравните свойства: а) поваренной соли и сахара; б) меди и алюминия; в) серы и угля. Какие свойства каждой пары веществ позволяют отличить их друг от друга?
Самостоятельная работа
«Вещества. Свойства веществ».
«Физические и химические явления. Лабораторное оборудование».
Вариант I
1. Приведите примеры двух тел, состоящих из одного вещества, и одного тела, состоящего из разных веществ.
2. Сравните свойства: а) поваренной соли и сахара; б) меди и алюминия; в) серы и угля. Какие свойства каждой пары веществ позволяют отличить их друг от друга?
3. Какие из перечисленных явлений относят к химическим:
1. горение дров
2. замерзание воды
3. нагревание сахара до появления сиропа
4. нагревание сахарного сиропа до обугливания
5. испарение спирта
6. появление приятного свежего запаха после грозы
4. Установите соответствие между прибором и его назначением.
1) спиртовка
2) круглодонная колба
3) шпатель
4) пипетка
5) металлическая ложечка
А. прибор для сжигания твердых веществ
Б. прибор для взятия сыпучих веществ
В. прибор для нагревания веществ
Г. прибор для проведения химических реакций при нагревании
Д. прибор для взятия определенного объема жидкости
| 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
Вариант II
1. Выпишите из приведенного перечня физических тел (предметов) и веществ названия веществ: молоко, гранит, йод, сера, спирт, шланг, углекислый газ, пробирка.
2. В химической посуде без этикеток находятся медь, алюминий, мрамор, уксусная кислота и поваренная соль. По каким свойствам можно распознать эти вещества? Выпишите названия веществ и наиболее характерный для их распознавания признак.
3. Какие из перечисленных явлений относят к химическим:
1. горение бензина
2. испарение воды
3. плавление алюминия
4. ржавление металлических конструкций
5. процесс фотосинтеза
6. образование изморози
4. Установите соответствие между лабораторным оборудованием и его назначением.
1) фарфоровая чашка
2) колба плоскодонная
3) шпатель
4) мензурка
5) тигель
А. сосуд для измерения объема жидкости или сыпучих веществ
Б. сосуд для проведения химических реакций
В. сосуд для прокаливания веществ
Г. ложечка для взятия порции вещества
Д. посуда для выпаривания растворов
| 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
Самостоятельная работа по теме
«Лабораторное оборудование, химическая посуда и правила работы с ними»
Вариант I
1. Установите соответствие между лабораторным оборудованием и его назначением.
1) фарфоровая чашка
2) шпатель
3) мензурка
4) тигель
А. сосуд для измерения объема жидкости или сыпучих веществ
Б. приспособление для перемешивания смеси
В. сосуд для прокаливания веществ
Г. ложечка для взятия порции вещества
Д. посуда для выпаривания растворов
| 1 | 2 | 3 | 4 |
|
|
|
|
|
2. Основное назначение ступки с пестиком — это
1) длительное хранение растворов или сыпучих веществ
2) растворение веществ
3) измельчение твердых веществ
4) выпаривание растворов
3. Тонкостенная химическая посуда с круглым дном (пробирки, колбы) служит
1) для нагревания или кипячения растворов веществ
2) для длительного прокаливания веществ
3) для сохранения легко испаряющихся жидкостей
4) для смешивания твердых веществ
Вариант II
1. Установите соответствие между прибором и его назначением.
1) спиртовка
2) ареометр
3) шпатель
4) пипетка
А. прибор для осушения веществ
Б. прибор для взятия сыпучих веществ
В. прибор для получения газа
Г. прибор для нагревания веществ
Д. прибор для взятия определенного объема жидкости
Е. прибор для определения плотности жидкого вещества или раствора
| 1 | 2 | 3 | 4 |
|
|
|
|
|
2. Фарфоровая чашка служит
1) для длительного хранения растворов или сыпучих веществ
2) для перемешивания и растворения веществ
3) для измельчения твердых веществ
4) для нагревания или выпаривания растворов
3. В химических опытах при нагревании пробирки с исходными веществами ее закрепляют в держателе не посередине, а у горлышка, чтобы
1) удобно было прогреть содержимое пробирки
2) легко вынуть пробирку после окончания опыта
3) легко нагреть пробирку по всей ее поверхности
4) пробирка не растрескалась при нагревании
Самостоятельная работа.
Общие сведения о веществах. Тела и вещества.
Вариант 1.
1. Приведите примеры веществ, из которых могут быть изготовлены следующие тела: стакан, линейка.
2. Зачеркните формулу вещества, не принадлежащего к указанной группе.
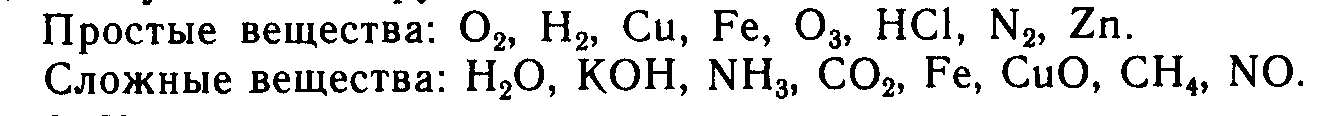
3. Укажите сходство и различие в составе углекислого газа СО2 и кремнезема SiО2.
Вариант 2.
1. Приведите примеры различных тел, которые могут быть сделаны из алюминия, стекла.
2. Зачеркните формулу вещества, не принадлежащего к указанной группе.
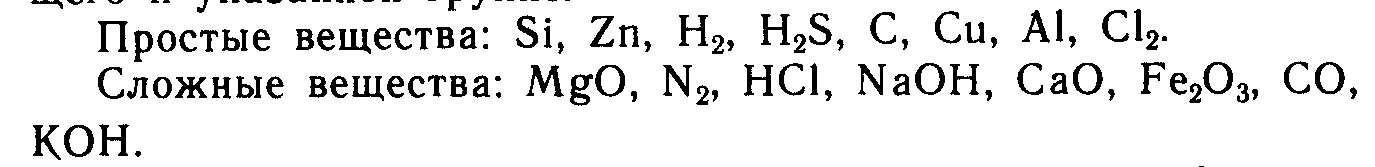
![]()
3. Укажите сходство и различие в составе воды Н2О и озона О3.
Вариант 3.
1.Зачеркните название вещества, не принадлежащего к указанной группе.
Чистые вещества: углекислый газ, воздух, кислород, медь, сера.
Смеси: молоко, гранит, морская вода, медь, кровь.
2. Из каких химических элементов состоят следующие вещества: серная кислота Н2SО4, гидроксид натрия NаОН. Сколько атомов каждого химического элемента показано в формулах веществ?
3. допишите приведенные ниже предложения, вставив вместо точек подходящие по смыслу слова: «простое вещество», «сложное вещество», «металл», «неметалл»:
а) кислород по составу — это ...;
б) кислород по свойствам — это ...;
в) вода по составу — это ...;
г) железо по свойствам — это ...;
д) железо по составу — это…
Вариант 4.
1.Даны: а) морская вода; б) гранит; в) сода; г) сахар. Какие из них — чистые вещества, а какие — смеси веществ?
2. Из каких химических элементов состоят следующие вещества: фосфорная кислота Н3РО4, оксид алюминия А12О3? Сколько атомов каждого химического элемента показано в формулах веществ?
3. Поставьте вместо точек в приведенных ниже предложениях подходящие по смыслу слова: «простое вещество», «сложное вещество», «металл», «неметалл»:
а) медь по составу — это ...;
б) медь по свойствам — это ...;
в) углекислый газ по составу — это ...;
г) сера по составу — это ...;
д) сера по свойствам —это..
Самостоятельная работа.
Химические формулы.
Относительная молекулярная масса. Массовая доля элемента
Вариант 1
1. Вычислите относительные молекулярные массы веществ: С3Н8, Cu2S, NH3, MgO.
2. Рассчитайте массовую долю каждого элемента в Cu2S и MgO.
3. Какую информацию о веществе несет его химическая формула — HN03 (азотная кислота)?
Вариант 2
1. Вычислите относительные молекулярные массы веществ: СO2, SO3, Fe2O3, H2О
2. Рассчитайте массовую долю каждого элемента в Fe2О3 и SО3.
3. Какую информацию о веществе несет его химическая формула — СаСO3 (карбонат кальция)?
Вариант 3
1. Вычислите относительные молекулярные массы веществ: НС1, СН4, СuО, А12Оэ.
2. Рассчитайте массовую долю каждого элемента в СН4 и СuО.
3. Какую информацию о веществе несет его химическая формула — СuС12 (хлорид меди)?
Вариант 4
1. Вычислите относительные молекулярные массы веществ: SO2, РН3, К20.
2. Рассчитайте массовую долю каждого элемента в SО2 и
3. Какую информацию о веществе несет его химическая формула — H2SO4(серная кислота)?
Самостоятельная работа.
Валентность
Вариант 1
1. Составьте формулы следующих соединений:
I III II III I I
СаxCly, MgxNy, AlxSy, FexCly,, SixCly
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с кислородом, зная, что в данных соединениях он двухвалентен:
N2O, Р2O5, N2O3, CaO, СO2, SO3, NO.
3. Сера образует с водородом соединение H2S. Составьте формулы соединений серы с натрием, кальцием и алюминием, в которых сера проявляет такое же значение валентности, как в указанном соединении с водородом.
Вариант 2
1. Составьте формулы сложных веществ, образованных элементом кислородом и следующими элементами:
Mn(VH), Cr(Vl), Sb(V), Sn(IV), Cr(IIl), N(II), Hg(I).
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с хлором, зная, что в
иных соединениях он одновалентен:
КС1, СаС12, FeCl3, РС15, ZnCl2, CrCl3, SiCl4.
3. Медь образует с кислородом два оксида — Cu2O и СuО. Составьте формулы соединений меди с серой, в которых сера проявляет такие же значения валентности, как в указанных соединениях с кислородом.
Вариант 3
1. Составьте формулы следующих соединений:
III I I
MgxSiy, СахРу, SixOy, А1xС1y , СхС1у.
2. Перепишите формулы и обозначьте римскими цифрами нтность элементов в соединениях с серой, зная, что в данных соединениях она двухвалентна:
A12S3, Na2S, MgS, CS2, PbS, Ag2S, ZnS.
3.Бром образует с водородом соединение НВг. Составьте формулы соединений брома с магнием, алюминием и калием, в которых бром проявляет такое же значение валентности в указанном соединении с водородом.
Вариант 4
1. Составьте формулы сложных веществ, образованных элементом кислородом и следующими элементами:
Cl(VII), S(VI), As(V), Pb(IV), B(III), Sr(II), Cu(I).
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с водородом, зная, что в данных соединениях он одновалентен:
СН4, Н2О, H3N, H2S, НС1, Н3Р, SiH4.
3. Фосфор образует с хлором соединения РС13 и РС15, в которых хлор проявляет валентность, равную единице. Составьте формулы соединений фосфора с кислородом, в которых фосфор проявляет такое же значение валентности, как и в указанных соединениях с хлором.
Самостоятельная работа.
Химические уравнения
Вариант 1
1. Расставьте коэффициенты в схемах реакций.
а) Н2 + N2 → NH3 в) Al + Cl2 →А1С13
б) СН4 + О2 → СО2 + Н2О г) Zn + О2 →ZnO
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
V I II
а) Р + О2 → РО б) Сu + S → CuS
3. Перепишите приведенные схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты.
а) ? + О2 →СаО б) HI → I2 + ?
Вариант 2
1. Расставьте коэффициенты в схемах реакций.
а) Fe + С12 → FeCl3 в) AI + S → A12S3
б) МпO2 + Н2 → Н2O + Мn г) С + O2 → СO2
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
V IV
а) Р + S → PS б) Li + O2 → LiO
3. Перепишите приведенные схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты.
а) Н2O → O2 + ? б) N2 + ? → NO
Вариант 3
1. Расставьте коэффициенты в схемах реакций.
а) Ag + S → Ag2S , в) Mg + O2 → MgO
б) С2Н4 + O2 → СO2 + Н2O г) Р + С12 → РС13
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
II
a) Al + S → A1S б) Si + O2 → SiO
3. Перепишите приведенные схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты.
a) HgO → O2 + ? б) ? + N2 → NH3
Вариант 4
1. Расставьте коэффициенты в схемах реакций.
а) Na + С12 → NaCl в) А1 + О2 → А12О3
б) H2S + O2 → S + Н2O г) С + H2 → CH4
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
а) В + O2 — ВО б) С + S — CS
3. Перепишите приведенные схемы реакций, вместо знака вопроса напишите формулы соответствующих веществ и расставьте коэффициенты.
a) AgBr — Вг2 + ? б) ? + Н2 — NaH
Самостоятельная работа.
Количество вещества. Моль.
Вариант 1
1. Какое количество вещества соответствует 306 г оксида алюминия Al2O3?
2. Рассчитайте массу 4 моль азотной кислоты HNO3
3. Сколько молекул содержится в 8 г молекулярного кислорода О2?
4. В какой массе воды содержится столько же молекул, сколько атомов в 36 граммов магния
Вариант 2
1. Какое количество вещества соответствует 1 кг карбоната кальция СаСО3?
2. Рассчитайте массу 3 моль оксида кремния SiO2.
3. Сколько атомов содержится в 80 г кальция?
4. Рассчитайте массы: а)12 • 1023 атомов серы.; б) 3 • 1023 молекул фтора F2 .
Вариант 3
1. Какое количество вещества соответствует 352 г сульфида железа FeS?
2. Рассчитайте массу 0,5 моль оксида натрия Na20.
3. Сколько молекул содержится в 280 г молекулярного азота N2?
4. Рассчитайте массы: а) хлороводорода НС1; б) углекислого газа С02, содержащих по 0,6 • 1023 молекул.
Вариант 4
1. Какое количество вещества соответствует 490 г серной кислоты H2S04?
2. Рассчитайте массу 3,5 моль оксида цинка ZnO.
3. Сколько атомов содержится в 112 г железа?
4. Сколько граммов кислорода О2 необходимо взять, чтобы там содержалось столько молекул, сколько их содержится в 10 г водорода Н2?
Контрольная работа по теме:
«Первоначальные химические понятия»
Вариант 1
1. Какое количество вещества (моль) соответствует 320 г оксида меди СuО?
2. Рассчитайте массовую долю каждого элемента в оксиде cepы (lV) и в оксиде cepы (VI). В каком из этих оксидов массовая доля серы больше?
3. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций.
а) HgO →→Hg + О2
в) Al + СuС12 → А1С13 + Сu
б) Mg + О2 → MgO
4. Перепишите приведенные ниже формулы веществ и обозначьте римскими цифрами валентность элементов:
CaO, H2S, Fe203, Na20, NH3.
5. Вычислите количество вещества и массу кислорода, образующегося при разложении 4 моль оксида ртути HgO.
Схема реакции: HgO → Hg + О2
Вариант 2
1. Чему равна масса 3 моль сульфида железа FeS?
2. Рассчитайте массовую долю каждого элемента в оксиде магния и в оксиде меди(П). В каком из этих оксидов массовая доля кислорода меньше?
3. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций.
а) СаС03 →СаО + С02
б) Li + О2 → Li2О
в) Fe2О3 + Al → А12О3 + Fe
4. Составьте химические формулы следующих соединений:
VII III
AlxOy, SixHy, MgxSIy, ClxOy, РхHу.
5. Вычислите количество вещества и массу образовавшегося оксида лития Li2O, если в реакцию с кислородом вступило 2 моль лития.
Схема реакции: Li + O2 → Li2O
Вариант 3
1. Какое количество вещества (моль) соответствует 54 г воды Н2О
2. Рассчитайте массовую долю каждого элемента в метане СН4 и этане С2Н6. В каком из этих веществ массовая доля углерода больше?
3. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относя каждая из реакций,
a) Zn + О2 → ZnO
б) Н2О →Н2 + О2
в) Mg + НС1 →MgCl2 + Н2
4. Перепишите приведенные ниже формулы веществ и значьте римскими цифрами валентность элементов: Ag2О, NH3, FeCl3, Р2О5, СН4.
5. Вычислите количество вещества и массу воды, если при разложении получили 3 моль кислорода О2. Схема реакции: Н2О → Н2 + О2
Вариант 4
1. Чему равна масса 2 моль углекислого газа СО2?
2. Рассчитайте массовую долю каждого элемента в оксиде железа(Ш) и в оксиде хрома(М). В каком из этих оксидов массовая доля кислорода меньше?
3. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций.
а) Al + S → A12S3 в) Сг2О3 + А1 →А12Оэ + Сг
б) HI → Н2 + 12
4. Составьте химические формулы сложных веществ, образованных элементом кислородом и следующими элементами:
Hg(I), C(IV), Al(III), Ba(II), Pb(IV).
5. Вычислите количество вещества и массу образующегося сульфида алюминия A12S3, если в реакцию с алюминием вступило 6 моль серы.
Схема реакции: Al + S→A12S3
Контрольная работа за 1 полугодие
1 ВАРИАНТ
1. Какое количество вещества ( в молях) представляют собой пластины из меди массой: а) 32 г, б) 128 г, в) 64 г?
2. В атомах химических элементов электроны распределены по слоям следующим образом: а) 2,8,7 б) 2,8,1. Какой их химических элементов неметалл? Почему?
3. Где больше массовая доля фосфора – в фосфине РН3 или оксиде фосфора Р2О5. Рассчитайте.
4. Количество вещества силиката натрия Na2SiO3 0,25 моль. Какова масса этого количества вещества силиката натрия?
2 ВАРИАНТ
1.Какое количество вещества ( в молях) заключено в образцах кальция массой а) 80 г, б) 8 г, в) 4г.
2. В атомах химических элементов электроны распределены по слоям следующим образом: а) 2,8,7; б) 2,8,18,8,1. Какой из элементов Металл? Почему?
3. Где больше массовая доля серы – в сероводороде H2S или сернистом газе SO2? Рассчитайте.
4.Количество вещества фосфорной кислоты H3PO4 5 моль. Какова масса этого количества вещества фосфорной кислоты?
3 ВАРИАНТ
1. Какое количество вещества составляют : а) 8 г H2SO4 ; б) CO2
2. В атомах химических элементов электроны распределены по слоям следующим образом: а) 2,8,8,2; б) 2,8,8,6. Какой из элементов Неметалл? Почему?
3. В каком веществе массовая доля меди больше – в оксиде меди CuO или хлориде меди CuCI2? Рассчитайте.
4. цинк вступает в реакцию соединения с серой, и образуется сульфид цинка: Zn + S → ZnS
Сера какой массы должна быть смешана с 6,5 г цинка, чтобы взятые вещества израсходовались полностью?
Контрольно-измерительный тест за 1 полугодие в форме ЕГЭ
1 вариант
А. Тестовые задания с выбором 1 правильного ответа. - Часть А
1.Выберите Сложное вещество
А. Натрий
Б. Углекислый газ
В. Медь
Г. Озон
2. Относительная молекулярная масса наибольшая у вещества
A. H2S Б. SO2
В. SO Г. K2S
3.Имеется водный раствор соли. Каким способом можно выделить соль из ее раствора?
А. отстаиванием Б. фильтрованием
В. выпариванием Г. магнитом
4. Магний – двухвалентный металл. Какая из приведенных формул составлена неверно:
А. MgCl2 Б. MgO В. MgS Г. Mg2O3
5. Какое вещество оксид
А. NaCl Б. H2O B. H2 Г. O3
6. Сколько атомов кислорода содержится в азотной кислоте HNO3
А. 1 Б. 2 В. 3 Г. 5
7. Сколько вещества в молях представляют собой пластины из меди массой 128 гр
А. 1 моль Б. 2 моль В. 0,5 моль Г. 3 моль
8. Молекулярная масса оксида натрия?
A. 62 Б . 40
В. 39 Г. 60
9. Сравните атомные массы магния и углерода. Во сколько раз атомная масса 1 химического элемента больше или меньше массы другого.
А. 3 Б. 2 В. 10 Г. 5
10. Медь по составу это
А. металл В. простое вещество
Б. неметалл Г. сложное веществ
Часть В.
Тестовые задания со свободным кратким ответом или на установление соответствия
1. Установите соответствие между формулами веществ и их составом
1. H2O А. простое вещество
2. O3 Б. сложное вещество
3. Fe
4. CO
5. Na
| 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
2. Установите соответствие между знаком элемента и названием элемента:
1) N А) азот
2)Al Б) железо
3)Na В) алюминий
4) Cu Г) медь
Д) натрий
| 1 | 2 | 3 | 4 |
|
|
|
|
|
3. Какая валентность серы в соединении Na2S - …
4. Cоотнесите формулу химического вещества и общее количество атомов:
1. KOH 2. H2 3. Al2O3 4. S
А. 2 Б. 5 В. 3 Г. 1
| 1 | 2 | 3 | 4 |
|
|
|
|
|
5. Соотнесите, какие вещества - 1. чистые 2. смеси
А. морская вода Б. кровь В. сода Г. сахар
| 1 | 2 |
|
|
|
Часть С.
Вопросы со свободным развернутым ответом
1. Расставьте индексы (кол-во атомов) согласно валентностям элементов
КО, SO (II), PO, HO
2. Рассчитайте массу соли и воды в 250 граммах 30% раствора сахара.
3. Закончите уравнение реакций. Расставьте коэффициенты.
Na+Cl2 →
Ca+O2→
2 вариант
Тестовые задания с выбором 1 правильного ответа. – Часть А
1. Медь по составу это
А. металл В. простое вещество
Б. неметалл Г. сложное вещество
2. Относительная молекулярная масса наибольшая у вещества
A. H2О Б. O2
В. Н2S Г. Н2
3.Имеется водный раствор песка. Каким способом можно выделить песок из ее раствора7
А. отстаиванием Б. фильтрованием
В.выпариванием Г. магнитом
4. Какую валентность проявляет Fe соединении Fe2O3
А. I Б. II В. III Г. VI
5. Какая формула соответствует оксиду углерода (II)
А. СO Б. СO2 В. Н2СO3 Г. С
6. Сколько всего атомов содержится в фосфорной кислоте Н3РО4
А. 4 Б. 5 В. 7 Г. 8
7. Химическая формула бромида неизвестного элемента XBr2. Какому элементу соответствует Х
A. Ca Б. H
В. Al Г. Fe
8. Атомная масса какого химического элемента равна 14
A. C Б . N
В. F Г. Р
9. Какое вещество в молях представляют собой пластины из меди массой 32 гр
А. 1 моль Б. 2 моль В. 0,5 моль Г. 3 моль
10. Какое из приведенных веществ оксид
А, O2 Б. HCl В. CaO Г. NaCl
Часть В.
Тестовые задания со свободным кратким ответом или на установление соответствия
1. Задание с несколькими вариантами ответов.
Какие вещества являются простыми по составу
А. Na Б. Ca В. H2O
Г. CO Д. O2 Е. CuO
2. Установите соответствие между знаком химического элемента и названием элемента:
1)Na А) углерод
2)Fe Б) железо
3)C В) цинк
4) Zn Г) калий
Д) натрий
| 1 | 2 | 3 | 4 |
|
|
|
|
|
3. Какая валентность серы в соединении SO….
4. Cсоотнесите формулу химического вещества и суммарное количество атомов
1. H2O 2. C 3. H2SO3 4. СО
А. 2 Б. 6 В. 3 Г. 1
| 1 | 2 | 3 | 4 |
|
|
|
|
|
5. Соотнесите формулу вещества и ее молекулярную массу
1. O2 2. H2O 3. CO
А. 28 Б. 32 В. 18
| 1 | 2 | 3 |
|
|
|
|
Часть С.
Вопросы со свободным развернутым ответом
1. Расставьте валентности в следующих соединениях
Al2O3 , FeO, H2S, SO3
2.Опишите в-во (NО2)по плану:
из каких элементов состоит газ
какое кол-во атомов каждого элемента содержит вещество
рассчитайте молекулярную массу в-ва
проставьте валентности
высчитайте % содержание азота в веществе.
3. Закончите уравнение реакций. Расставьте коэффициенты.
Na+O2 →
P+O2→
3 вариант
Тестовые задания с выбором 1 правильного ответа. – Часть А
1.Знак элемента, образующего простое вещество – неметалл
А. Na Б. C B. K Г. Al
2. Какая формула соответствует оксиду серы (IV)
А. SO Б. SO2 В. SO3 Г. H2S
3. Химическая формула бромида неизвестного элемента XBr. Какой элемент соответствует Х
A. Ca Б. H
В. Al Г. Fe
4. Молекулярная масса оксида углерода (IV)
А. 44 Б. 28 В. 20 Г 45
5. Какое вещество сложное по составу
А. Na Б. Si
В. CO Г. Cu
6. Масса 2 моль сероводорода Н2S равна:
А. 33 г. В.34г. В.68г. Г. 102г.
7. Запись 3О2 означает:
А. 2 молекулы кислорода. Б. 3 молекулы кислорода.
В. 5 атомов кислорода. Г. 6 атомов кислорода.
8. Относительная молекулярная масса меньшая у вещества
А. NO Б. NO2 В. N2O5 Г. P2O5
9. Сложное вещество – это
А. Кислород Б. водород В. вода Г. сера
10. Какое вещество из представленных, является оксидом
А. H2SO4 Б. SO2 В. NaNO2 Г. H
Часть В.
Тестовые задания со свободным кратким ответом или на установление соответствия
1. Задание с несколькими вариантами ответов.
Какие вещества являются сложными по составу
А. Fe Б. Ca В. H2O
Г. CO Д. O2 Е. Na2O
2. Установите соответствие между знаком элемента и названием элемента:
1) S А) серебро
2)Ca Б) железо
3)Fe В) алюминий
4) Ag Г) кальций
Д) сера
| 1 | 2 | 3 | 4 |
|
|
|
|
|
3. Какая валентность серы в соединении SO3….
4. Cоотнесите формулу химического вещества и суммарное количество атомов
1. H2O 2. Cl2 3. H2SO4 4. Na
А. 2 Б. 7 В. 3 Г. 1
| 1 | 2 | 3 | 4 |
|
|
|
|
|
5. Соотнесите, какие вещества
1. чистые 2. смеси
А. молоко Б.кислород В. воздух Г. магний.
| 1 | 2 |
|
|
|
Часть С.
Вопросы со свободным развернутым ответом
Опишите в-во (СО2)по плану:
из каких элементов состоит углекислый газ
какое кол-во атомов каждого элемента содержит вещество
рассчитайте молекулярную массу в-ва
проставьте валентности
высчитайте % содержание углерода в веществе.
2. Каковы массы соли и воды:
В 400 гр 20 % раствора соли.
3. Закончите уравнение реакций. расставьте коэффициенты.
H2+Cl2 →
Mg+HCl→
ТЕМА. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Самостоятельная работа.
Оксиды.
1. Выберите правильный ответ.
а) Формулы только оксидов приведены в ряду
1) H2SO4, СаО, CuCl2
2) Na2CO3, Na2O, N2O5
3) Р2О5, BaO, SO3
4) NaOH, Na2O, Cu(OH)2
б) Формулы только основных оксидов приведены в ряду
1) СО2, СаО, СuО
2) СО2, Na2O, N2O5
3) Р2О5, BaO, SO3
4) СаО, Na2O, CuO
в) Формулы только кислотных оксидов приведены в ряду
1) СО2, SO2, SO3
2) СО2, Na2O, N2O5
3) Р2О5, BaO, SO3
4) CaO, Na2O, CuO
2. Из приведенных формул веществ выпишите только те, которыми обозначены оксиды.
NaCl, Na2O, НСl, Сl2О7, Са3(РО4)2, CaO, Р2О5, Н2О, Н3РО4
3. Установите соответствие между формулой оксида и формулой соответствующего ему гидроксида.1) Na2O 2) Fe2O3 3) ВаО 4) СО2
A. Fe(OH)3
Б. Н2СО3
В. NaOH
Г. Ва(ОН)2
Д. H2SO4
| 1 | 2 | 3 | 4 |
|
|
|
|
|
4. Установите соответствие между названием оксида и его формулой.
1) оксид натрия 2) оксид серы(IV) 3) оксид железа(Ш) 4) оксид фосфора(V)
A. SO2
Б. SO3
B. Na2O
Г. Р2О5
Д. Fe2O3
| 1 | 2 | 3 | 4 |
|
|
|
|
|
5. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + Н2О →Са(ОН)2
2) SO3 + ... → H2SO4
3) MgO + ... →Mg(NO3)2 + ...
4) СО2 + ... → Na2CO3 + ...
6. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + ... →MgO
2) ... + ... → ZnO
3) ... + ... →NO
4) ... + ... → P2O5
7. Оксид натрия не взаимодействует
1) с водой
2) с кислотами
3) с основаниями
4) с кислотными оксидами
8. Оксид серы(IV) не взаимодействует
1) с водой
2) со щелочами
3) с кислотами
4) с основными оксидами
9. Установите соответствие между исходными веществами и продуктами (продуктом) химических реакций.
1) K2O + H2SO4 2) N2O5 + H2O 3) Li2O + H2O 4) SO3 + NaOH
A. LiOH
Б. Na2SO4 + H2O
B. K2SO4 + H2O
Г. HNO3
| 1 | 2 | 3 | 4 |
|
|
|
|
|
Самостоятельная работа.
Основания
1.Из приведенных формул веществ выпишите только те, которыми обозначены основания.
H2SO4, Ca(OH)2, CaO, NaOH, Na3PO4, P2O5, Fe(OH)3, Fe2O3, Cu(OH)2
2. Напишите формулу каждого из перечисленных оснований:
1) гидроксид железа(II)
2) гидроксид бария
3) гидроксид меди(II)
4) гидроксид меди(I)
3. Формулы только оснований приведены в ряду
1) Na2CO3, NaOH, NaCl 2) KNO3, HNO3, KОН
3) KОН, Mg(OH)2, Cu(OH)2 4) HCl, BaCl2, Ba(OH)2
4. Формулы только щелочей приведены в ряду
1) Fe(OH)3, NaOH, Ca(OH)2
2) KOH, LiOH, NaOH
3) KOH, Mg(OH)2, Cu(OH)2
4) Al(OH)3, Fe(OH)2, Ba(OH)2
5. Из указанных соединений нерастворимым в воде основанием является
1) NaOH
2) Ва(ОН)2
3) Fe(OH)2
4) KOH
6. Из указанных соединений щелочью является
1) Fe(OH)2
2) LiOH
3) Mg(OH)2
4) Cu(OH)2
7. Металл, который, реагируя с водой, образует щелочь, — это
1) железо
2) медь
3) калий
4) алюминий
8. Оксид, который при взаимодействии с водой образует щелочь, — это
1) оксид алюминия 2) оксид лития
3) оксид свинца(II) 4) оксид марганца(II)
9. При взаимодействии основного оксида с водой образуется основание
1) Аl(ОН)3 2) Ва(ОН)2
3) Cu(ОН)2 4) Fe(OH)3
10. Из перечисленных уравнений химических реакций выберите уравнение реакции обмена.
1) 2H2O = 2H2 + O2
2) HgCl2 + Fe = FeCl2 + Hg
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl
4) CaO + CO2 = CaCO3
Самостоятельная работа.
Соли. Названия.
Вариант 1
1. Состав нитратов лития, бария и железа отражают формулы LiNO3, Ba(NO3)2, Fe(NO3)3. Используя эти формулы, определите значение валентностей атомов металлов. Составьте формулы солей, образованных этими металлами и кислотными остатками: а) соляной кислоты;
б) сероводородной кислоты; в) фосфорной кислоты.
2. Назовите соли: CuS, CaSO4, Cu2S, K3PO4, BaCO3.
3. Установите соответствие между химической формулой соли и классом, к которому она относится.
1) NaHCO3
2) Сu(ОН)Сl
3) Na2CO3
4) Na2KPO4
А. средние соли
Б. кислые соли
В. основные соли
Г. двойные соли
| 1 | 2 | 3 | 4 |
|
|
|
|
|
Вариант 2
1. Укажите значения валентностей металла и кислотного остатка в формуле каждой соли. Валентность металла
1) K2SO4 _________________
2) FeS ___________________
3) Са3(РО4)2 ______________
4) Na2CO3 ________________
Валентность кислотного остатка
______________________________
______________________________
______________________________
2. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3 2) Cu(NO3)2 3) Al2(SO4)3 4) К2СО3
A. нитрат меди(II)
Б. карбонат калия
B. хлорид железа(III)
Г. нитрит меди(П)
Д. сульфат алюминия
| 1 | 2 | 3 | 4 |
|
|
|
|
|
3. Установите соответствие между химической формулой соли и классом, к которому она относится.
1) Na3PO4
2) Na2HPO4
3) K2NaPO4
4) Аl(ОН)2Сl
A. кислые соли
Б. двойные соли
B. средние соли
Г. основные соли
| 1 | 2 | 3 | 4 |
|
|
|
|
|
Вариант 3
Зная классификацию неорганических соединений, распределите вещества по основным классам.
NaCl, NaOH, CO2, Ba(OH)2, H2SO4, Cu(OH)2, HF, SO3, MgO, Li2O, Mg(OH)Cl, Mg(OH)2, HNO3, Na2CO3, K2HPO4, H2S.
Самостоятельная работа.
Классы веществ. Уравнения реакций.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения. Назовите вещества
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения. Назовите вещества
Проверьте себя по разделу
«Классификация неорганических веществ»:
• Заполните таблицу:
| формула | класс | название |
|
Ba(OH)2 |
|
|
|
Li2SO4 |
|
|
|
|
|
хлорид железа (III) |
|
Sb2O5 |
|
|
|
Rb2CO3 |
|
|
|
|
|
гидроксид лития |
|
HNO3 |
|
|
|
|
|
сульфид ртути (II) |
|
|
|
оксид скандия (III) |
|
|
|
мышьяк |
|
|
|
ортофосфорная кислота |
|
Sc |
|
|
|
CaSiO3 |
|
|
|
|
|
сульфит калия |
Самостоятельная работа.
Обобщение сведений о важнейших классах неорганических веществ.
Вариант 1
1. Заполните таблицу, распределив по классам предложенные соединения. Назовите вещества
| Оксиды | Соли | Основания | Кислоты |
|
|
|
|
|
Вe(ОН)2, CO2, Na2CO3, KOH, H2SO4 , AgNO3, MgSO4, Ca(OH)2, HNO3 , Fe(NO3)3, NaOH, K2O, HC1, Cu(OH)2, CO2, K2CO3
2. Напишите формулы веществ:
сульфита кальция, гидроксида алюминия, хлороводородной кислоты
3. осуществите цепочку превращений. Назовите вещества
Si→SiO2→H2SiO3→CaSiO3
Вариант 2
Заполните таблицу, распределив по классам предложенные соединения. Назовите вещества
| Оксиды | Соли | Основания | Кислоты |
|
|
|
|
|
CaSO3, Al(OH)3, Fe2(SO4)3, CaO, KNO3, MgO, Fe2O3, CuSO4, Ca3(PO4)2, CuO H2CO3, Fe(OH)3, NaNO3, N2O5, KCl, H3PO4
2. Напишите формулы веществ:
оксида углерода(II), сульфида магния, сернистой кислоты
3. осуществите цепочку превращений. Назовите вещества
Аl→Al2O3→Al(OH)3→Al2(SO4)3
Вариант 3
Заполните таблицу, распределив по классам предложенные соединения. Назовите вещества
| Оксиды | Соли | Основания | Кислоты |
|
|
|
|
|
A12(SO4)3, K3PO4, H2SO3, BaO, Cr(OH)3, HgO, H2O, CaCO3.
NaOH, HC1, HgCl2, Zn(NO3)2. Zn(OH)2, K2S LiOH, H2SiO3
2. Напишите формулы веществ:
оксида алюминия, карбоната натрия, сероводородной кислоты.
3. Допишите уравнения реакций, расставьте коэффициенты. Назовите вещества
P2O5 + H2O→
Ca(OH)2 + FeSO4→
Ca + HCl→
Вариант 4
Заполните таблицу, распределив по классам предложенных соединения.
| Оксиды | Соли | Основания | Кислоты |
|
|
|
|
|
Ca(OH)2, ZnSO4, SO2, H3PO4, Fe(OH)2, C12O7, SnCl2, FeS, ZnO, FeS, H3PO4, Ba(OH)2, H2SO4, Ca(NO3)2, HBr, P2O3,
2. Напишите формулы веществ:
оксида серы(VI), гидроксида меди (II), фосфата бериллия
3. Допишите уравнения реакций, расставьте коэффициенты. Назовите вещества
SO3+ Ca(NO3)2→
NaOH+ H3PO4→
Ca+ O2→
Контрольная работа по теме:
Важнейшие классы неорганических веществ
Вариант 1
1. Даны вещества: фосфор, оксид бария, раствор серной кислоты, гидроксид калия, оксид серы(IV), вода. Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Чем сходны и чем различаются по составу основание и соль? Ответ поясните примерами.
4.Оксид серы (VI) массой 16 грамм полностью прореагировал с водой. Найдите массу и количество вещества образовавшейся кислоты.
Вариант 2
1. Даны вещества: кальций, соляная кислота, вода, оксид кальция, медь, гидроксид натрия. Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, с помощью которых осуществить следующие превращения:
3. Чем сходны и чем различаются по составу и свойствам основные и кислотные оксиды. Ответ поясните примерами
4. Рассчитайте массу и количество вещества оксида кальция, образовавшегося при сжигании кальция массой 40 грамм.
Вариант 3
1.Даны вещества: цинк, раствор серной кислоты, оксид вода, гидроксид кальция, оксид углерода(IV). Какие будут взаимодействовать между собой? Напишите реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, позволяющих осуществить следующие превращения:
3. Чем сходны и чем различаются по составу кислота и соль. Ответ поясните примерами.
4. При разложении гидрокида меди (II) количеством вещества 3 моль образовался оксид меди и вода. Найдите их массу
Контрольная работа по теме
Важнейшие классы неорганических веществ
(тестовая форма)
Вариант I
А-1. Формулы только кислот приведены в ряду
1) НСl, NaCl, HNO3
2) H2SO3, H2SO4, H2S
3) Ca(OH)2, H3PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
А-2. Формулы только щелочей приведены в ряду
1) Fe(OH)2, KOH, Ва(ОН)2
2) NaOH, Ca(OH)2, Cu(OH)2
3) KOH, NaOH, LiOH
4) Fe(OH)3, Cu(OH)2, NaOH
A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль,—
1) Fe2O3
2) К2О
3) SO3
4) BaO
A-4. Взаимодействие оксида с водой относится к реакциям
1) соединения
2) обмена
3) разложения
4) замещения
А-5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к реакциям
1) соединения
2) разложения
3) замещения
4) обмена
А-6. Индикатор фенолфталеин в щелочной среде становится
1) бесцветным
2) малиновым
3) красным
4) желтым
А-7. Свойство, которое является общим для нерастворимых оснований и щелочей,—
1) взаимодействие с кислотными оксидами
2) взаимодействие с кислотами
3) взаимодействие с солями
4) разложение
В-8. Даны формулы веществ:
FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5
Выпишите формулы только основных оксидов.
Ответ:_______________________________
В-9. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
1) MgO 2) Н3РО4 3) Аl(ОН)3 4) NaOH
А. кислоты
Б. щелочи
В. оксиды
Г. нерастворимые основания
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В-10. Установите соответствие между исходными веществами и продуктами химических реакций.
1) HgO + HNO3 2) Al + H2SO4 3) Na2O + CO2 + H2O 4) K2O + H3PO
A. Al2(SO4)3 + Н2
Б. K3РО4 + Н2О
B. Hg(NO3)2+ Н2О
Г. Na2CO3 + Н2О
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В-11. Вставьте в схемы химических реакций недостающие формулы веществ.
1) ... + ... →Mg(NO3)2 + Н2О
2) ... + →MgCl2 + Н2
3) ... + ... →K3РО4 + Н2О
4) ... + ... →Na2S + Н2О
В-12. Допишите уравнения химических реакций.
1) LiОН + SO3 →
2) NaOH + Р2О5→
3) Са(ОН)2 + СО2 →
4) Ва(ОН)2 + SO2 →
С-13. Даны вещества: соляная кислота, гидроксид кальция, вода, оксид фосфора(V), оксид магния. С какими из перечисленных веществ может взаимодействовать: а) гидроксид натрия; б) гидроксид железа(III)? Напишите уравнения соответствующих реакций. Укажите тип каждой реакции.
С-14. Как отмыть пробирку от остатков нерастворимого в воде основания?
С-15. Составьте уравнения химических реакций, соответствующих схеме
Вариант II
А-1. Формулы только солей приведены в ряду
1) K2СО3, Н2СО3, KOH
2) АlСl3, Al(NO3)3, Al2S3
3) H2S, Ba(NO3)2, BaCl2
4) Cu(OH)2, CuSO4, CuS
A-2. Формулы только бескислородных кислот приведены в ряду
1) НСl, HNO3, H2S
2) H2SO3, H2S, HNO2
3) Н3РО4, Н2СО3, H2S
4) H2S, HF, HCl
A-3. Оксид, который реагирует с кислотой, образуя соль, — это
1) Р2О5
2) СuО
3) SO2
4) СО2
А-4. Получение оксида металла при нагревании гидроксида металла относится к реакциям
1) соединения
2) обмена
3) разложения
4) замещения
А-5. Химическая реакция, уравнение которой
K2О + 2HNO3 = 2KNO3 + Н2О, относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
А-6. Индикатор лакмус в щелочной среде становится
1) фиолетовым
2) красным
3) синим
4) бесцветным
А-7. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании?
1) NaOH, Сr(ОН)2, Са(ОН)2
2) Fe(OH)3, Cu(OH)2, Fe(OH)2
3) Ва(ОН)2, Mg(OH)2, KOH
4) KOH, LiOH, Al(OH)3
В-8. Даны формулы веществ:
СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5
Выпишите формулы только кислотных оксидов. Ответ: ____________
В-9. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3
2) Cu(NO3)2
3) Al2(SO4)3
4) K2СО3
А. нитрат меди(П) Б. карбонат калия
В. хлорид железа(III) Г. нитрит меди(II) Д. сульфат алюминия
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В-10. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
1) NaOH + СО2 2) NaOH + H2SO4 3) Fe(OH)2 + НСl 4) Fe(OH)2
A. FeO + Н2О
Б. Na2CO3 + Н2О
В. Na2SO4 + Н2О
Г. FeCl2 + Н2О
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В-11. Вставьте в схемы уравнений химических реакций недостающие формулы веществ.
1) ... + KOH → Fe(OH)3 + ...
2) ... + НСl →MgCl2 + ... + …
3) HNO3 + KOH ...→ + Н2О
4) ... + ... → BaSO4 + NaCl
В-12. Допишите уравнения химических реакций, протекающих при нагревании.
1) Mg(OH)2 2) Аl(ОН)3
3) Fe(OH)3 4) Cu(OH)2
С-13. С какими из перечисленных веществ: вода, оксид углерода(IV), азотная кислота, гидроксид кальция, поваренная соль — может вступать в реакцию: а) оксид кальция: б) оксид фосфора(V); в) оксид кремния(IV)? Запишите уравнения возможных химических реакций.
С-14. В трех склянках без этикеток находятся оксиды: в одной — оксид кальция, в другой — оксид меди(II), в третьей — оксид фосфора(V). Как их можно распознать?
С-15. Составьте уравнения химических реакций, соответствующих схеме
ТЕМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА МЕНДЕЛЕЕВА Д.И. СТРОЕНИЕ АТОМА.
Самостоятельная работа
Строение атомов.
Вариант 1
1. Как изменяются характерные свойства элементов с порядковыми номерами 3,4,5,6,7? Напишите химическую формулу высшего оксида элемента с порядковым номером 3 и затем уравнение реакции этого оксида с водой.
2.. Распределите химические элементы О, Сl, F, N, S, Р:
а) по порядку возрастания зарядов ядер их атомов;
б) на три группы сходных химических элементов;
в) на два ряда элементов, сходных по числу электронных слоев в атомах.
3. Определите число протонов, нейтронов и электронов следующих химических элементов: K, Cu, C
Вариант 2
1. Газообразные водородные соединения элементов имеют общую формулу ЭН3. Напишите общую формулу их высших оксидов. К какой группе оксидов они относятся – к основным, кислотным, амфотерным? Приведите конкретный пример оксида из числа тех, о которых говорится в этом задании.
2. Распределите химические элементы N, С, В, Р, А1, Si:
а) по порядку возрастания зарядов ядер их атомов;
б) на три группы сходных элементов;
в) на два ряда элементов, сходных по числу электронных слоев в атомах.
3. Определите число протонов, нейтронов и электронов следующих химических элементов: Al, F, Be
Контрольная работа по теме:
Периодический закон Д. И. Менделеева. Строение атомов
Вариант 1.
1. Элемент находится в УI группе и 3-м периоде периодической системы. Нарисуйте схему строения его атома. Опишите этот элемент по плану в учебнике.
2. Какой из элементов №3 или .№19 обладает более ярко выраженными свойствами металла? Ответ объясните.
3. Напишите уравнение реакции между гидроксидом элемента №19 и высшей кислородсодержащей кислотой элемента №7. Назовите все вещества.
4. Напишите формулы хлоридов, образованных элементами № 20, 37 Хлор в этих соединениях одновалентен.
Вариант 2.
1. Элемент находится в 3-м периоде и во II группе периодической системы. Нарисуйте схему строения его атома. Опишите этот элемент по плану в учебнике.
2. Какой из элементов—№11 или №13—обладает более ярко выраженными свойствами металла? Ответ объясните.
3. Напишите уравнение реакции между оксидом элемента №12 и высшей кислородсодержащей кислотой элемента №16. Назовите все вещества.
4.. Напишите формулы сульфидов, образованных элементами № 3, 56. Сера в этих соединениях двухвалентна.
Вариант 3.
1. Атомный номер химического элемента 15. Нарисуйте схему строения его атома. Опишите этот элемент по плану в учебнике.
2. Какой из элементов — №16 или № 17 — обладает более ярко выраженными свойствами неметалла? Ответ объясните.
3. Напишите уравнение реакции между следующими веществами, данными в виде растворов: водородным соединением элемента №17 и гидроксидом элемента №20. Назовите все вещества.
4. Напишите формулы высших оксидов для элементов №6, 15.
Вариант 4.
1. Атомный номер химического элемента 6. Нарисуйте схему строения его атома. Опишите этот элемент по плану в учебнике.
2. Какой из элементов — № 6 или №14 — обладает более ярко выраженными свойствами неметалла? Ответ объясните.
3. Напишите уравнение реакции между растворами следующих двух веществ: водородного соединения элемента №17 и гидроксида элемента №11. Назовите все вещества.
4. Напишите формулы хлоридов, образованных элементами № 20, 49 Хлор в этих соединениях одновалентен.
ТЕМА. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ ВЕЩЕСТВ.
Самостоятельная работа
Типы химической связи
Вариант № 1.
1. Соотнесите:
Название вещества: тип связи:
1) хлорид калия; а) ионная;
2) кислород; б) ковалентная неполярная;
3) магний; в) металлическая;
4) хлорид фосфора (Ш); г) ковалентная полярная.
5) оксид натрия;
6) тетрахлорметан;
2. Между атомами, каких элементов химическая связь будет иметь ионный характер?
1) N и О; 2) Si и Cl; 3) Nа и О; 4) Р и Вг.
3. В ряду соединений:
NаС1 - МgС12 - А1С13 - SiСl4 - РС13 - SСl2
Слева направо ионный характер связи:
1) усиливается; 2) не изменяется; 3) уменьшается; 4) закономерности нет.
4. Только ковалентная связь наблюдается в соединении с формулой:
1)Ва(ОН)2; 2) NH4NO3; 3)Н2SО4 ; 4)Li2С03.
5. Химическая связь наиболее прочна в молекуле:
1) иодоводорода; 2) хлора; 3) кислорода; 4) азота.
6. В каком из соединений, формулы которых записаны ниже, число общих электронных пар между двумя атомами максимально?
1)Н2 ; 2) N2; 3) НС1; 4) Р2.
7. Найдите название вещества, имеющего металлический тип связи:
1) мышьяк; 2) галлий; 3) фосфор; 4) иод.
Вариант №2.
1. Соотнесите:
Название вещества тип связи:
1) хлороводород; а) ионная;
2) медь; б) ковалентная неполярная;
3) сера кристаллическая; в) металлическая;
4) фторид натрия; г) ковалентная полярная.
5) оксид бария;
6) метан;
2. Между атомами каких элементов химическая связь будет иметь ионный характер?
1) Li и F; 2) С и О; 3) S и Сl; 4) Si и Н;
3. В ряду соединений: OF2 - NF3 - СF4 - ВF2 - ВеF2 - LiF слева направо ионный характер связи:
1) усиливается; 2) не изменяется; 3) уменьшается; 4) закономерности нет.
4. Ковалентная связь отличается от ионной:
1) большей длиной; 3) меньшей энергией;
2) насыщаемостью; 4) меньшей длиной.
5. Химическая связь наименее прочна в молекуле:
1) бромоводорода; 2) иодоводорода;3) хлороводорода; 4) фтороводорода
6. Наиболее прочные водородные связи образуются между атомом водорода и атомом:
1) азота; 2) кислорода; 3) хлора; 4) серы.
7. Укажите название вещества, молекулы которого способны к образованию водородных связей:
1) метанол; 2) гидрид кальция; 3) этан; 4) водород.
Самостоятельная работа
Степень окисления.
Окислительно – восстановительные реакции
1 вариант
укажите степень окисления в следующих веществах:
K2O, Al2O3, CO2, CO, Na2S.
Разберите сущность окислительно-восстановительных реакций: укажите окислитель, восстановитель, количество электронов, коэффициенты.
a) Fe + S → FeS b) CuO + H2 → Cu + H2O
Закончите уравнения тех реакций, которые идут до конца – необратимые.
CuO + HCl →
Cu(OH)2 + H2SO4→
AgNO3 + HCl→
KCl + HNO3→
2 вариант
1. укажите степень окисления в следующих веществах:
FeO, Fe2O3, SO2, SO3, NO2.
Разберите сущность окислительно-восстановительных реакций: укажите окислитель, восстановитель, количество электронов, коэффициенты.
a) Mg + Br2 → MgBr2 b) Zn + HCl → ZnCl2 + H2
Закончите уравнения тех реакций, которые идут до конца – необратимые.
CaO + HNO3 →
BaCl2 + K2SO4→
Fe(OH)2 + HCl→
K2SO4 + NaNO3→
Контрольная работа по теме:
Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома и Строение вещества. Химическая связь
Вариант 1.
1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 5; б) 2, 8, 6; в) 2, 8, 8; г) 2, 8, 5.
Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют.
2. Расположите: а) в порядке ослабления металлических свойств химические элементы Na, Li, Cu, Rb, K; б) в порядке усиления неметаллических свойств химические элементы Si, Al, Cl, P, S.
3. Определите по формулам степени окисления атомов в бинарных соединениях. Назовите вещества. Подчеркните наиболее электроотрицательный химический элемент.
АlСl3, HF, NH3, CaBr2, NO2, IF7.
4. Запишите формулу сероводорода. Определите вид химической связи. Составьте схему ее образования.
5. Поясните, какую кристаллическую решетку имеет карбид кремния (SiC), если известно, что это вещество используют как абразивный материал.
6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным?
а) 2Na + 2Н2О = 2NaOH + Н2
б) K2О + Н2О = 2KOH
в) СаО + 2НСl = СаСl2 + Н2О
г) Fe + H2SO4 = FeSO4 + H2
Вариант 2.
1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 8, 2; б) 2, 8, 7; в) 2, 8, 8; г) 2, 8, 8, 2.
Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют.
2. Расположите: а) в порядке усиления металлических свойств химические элементы Ва, Sr, Mg, Ca, Be; б) в порядке ослабления неметаллических свойств химические элементы F, В, N, О, С.
3. Составьте формулы веществ. Проставьте степени окисления над знаками химических элементов в каждой формуле. Подчеркните наиболее электроотрицательный химический элемент.
а) нитрид кальция
б) оксид марганца(VII)
в) карбид кремния
4. Какая из схем соответствует изображению химической связи, удерживающей атомы в оксиде лития
Назовите вид этой химической связи.
5. Поясните, какую кристаллическую решетку имеет йод, если известно, что это вещество легко возгоняется.
6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным?
а) Na2O + Н2О = 2NaOH
б) СаСО3 = СаО + СО2
в) Zn + 2HCl = ZnCl2 + H2
г) 2Mg + О2 = 2MgO
ТЕМА. ЗАКОН АВОГАДРО. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ
Самостоятельная работа
Закон Авогадро.
Вариант 1
1. Рассчитайте: а) плотность (н. у.) оксида углерода(IV) (г/л);
б) относительную плотность оксида азота(IV) по кислороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 0,6 моль азота;
б) 10 г водорода; в) 4,5 моль кислорода.
3. Сгорело 6 г углерода. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида углерода(IV) (н. у.).
Вариант 2
1. Рассчитайте: а) плотность (н. у.) оксида серы(IV) (г/л); б) относительную плотность сероводорода H2S по водороду.
2. Рассчитайте, какой объем (н. у.) займут: а) 38 г фтора; б) 0,4 моль хлора; в) 1,5 моль кислорода.
3. Сгорело 8 г серы. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида серы(IV) (н. у.).
ТЕМА. ГАЛОГЕНЫ.
Проверочная работа
Галогены.
Вариант 1
С какими из веществ, формулы которых приведены ниже, будет реагировать соляная кислота?
CuО, СО2, Cu, Mg, H2SO4, Cu(OH)2, AgNO3.
Ответ подтвердите записью уравнений химических реакций.
Вариант 2
С какими из веществ, формулы которых приведены ниже, будет реагировать соляная кислота?
SiO2, AgNO3, Zn(OH)2, Ag, Al, BaO, LiOH, Na2CO3.
Ответ подтвердите записью уравнений химических реакций.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА
Вариант 1
1. B ряду: Na Mg Al Si, что происходит с металлическими свойствами? Объясните
2. Определить тип связи и степень окисления атомов в соединениях N2 , H2SO3, Na 2SO4 , HCl, N2O , NH3 , K 3PO4, Al.
3. Напишите химические уравнения следующих превращений, назовите все вещества:
Какая из реакций окислительно-восстановительная? Составьте электронный баланс этого уравнения
4. Произошла реакция нейтрализации гидроксида натрия с соляной (хлороводородной) кислотой. Известно, что масса израсходованного гидроксида натрия 20 г. Какова масса образовавшейся соли?
Вариант 2.
1. B рядах химических элементов Na K; Ca Mg, что происходит с металлическими свойствами?: Поясните
2. Определить тип связи и степень окисления атомов в данных соединениях:
KCl , H 2, H 2SO3 , SO3 , Na3 PO4 , HNO2, N O2 . Fe
3. Напишите химические уравнения следующих превращений и назовите все вещества:
Какая из реакций окислительно-восстановительная? Составьте электронный баланс этого уравнения
4. Какова масса оксида меди, прореагировавшего с серной кислотой, если получился сульфат меди массой 80 г?
Вариант 3.
1. B ряду химических элементов F O N C, что происходит с неметаллическими свойствами?: Поясните
2. Определить тип связи и степень окисления атомов в данных соединениях
K2O, Al2O3, CO2, CO, Na2S, Fe, H2, Na NO3
3. допишите химические уравнения, назовите образовавшиеся вещества
Какая из реакций окислительно-восстановительная? Составьте электронный баланс этого уравнения
4. Сколько молей водорода выделится при реакции 12 г магния с раствором серной кислоты?
Вариант 4.
1. Какой из 2 названных элементов в каждом варианте будет иметь более ярко выраженные свойства металла а) Al и Mg b) K и Rb . Ответ поясните
2. Определить тип связи и степень окисления атомов в данных соединениях
BaSO4 , AgCl, SiO2, FeCl3, Cu, O3, CuO, S .
3. допишите химические уравнения, назовите образовавшиеся вещества
Cu(OH)2 + H2SO4 →
CO2+H2O→
BaCl2 + K2SO4→
Zn+HCl→
Какая из реакций окислительно-восстановительная? Составьте электронный баланс этого уравнения
4. При разложении 50 кг известняка (карбоната кальция) выделился газ. Определите его массу.
Вариант 5
1. Какой из 2 названных элементов в каждом варианте будет иметь более ярко выраженные свойства металла а) Al и B b) Ca и K . Ответ поясните
2. Определить тип связи и степень окисления атомов в данных соединениях
H3PO4, Co, CO, P , Al2O3, P2O5, HCl, MgBr2
3. Напишите химические уравнения следующих превращений и назовите все вещества:
O2 → SO2 →SO3→H2SO4→BaSO4
Какая из реакций окислительно-восстановительная? Составьте электронный баланс этого уравнения
4. По приведенной ниже краткой записи условия задачи составьте дано задачи и решите ее.
116 гр х моль
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
| № | РАЗДЕЛ. ТЕМА. | Стр. | |
| I. | Практические работы | 3-17 | |
|
| Требования охраны труда во время работы | 3 | |
|
| Требования охраны труда в аварийных ситуациях | 4 | |
|
| Требования охраны труда при окончании работы | 5 | |
|
| Правила техники безопасности | 6 | |
|
| Лабораторное оборудование | 7-8 | |
| 1. | П.Р. №1. ОЗНАКОМЛЕНИЕ С ЛАБОРАТОРНЫМ ОБОРУДОВАНИЕМ. ПРОВЕДЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ. | 9-11 | |
| 2. | П.Р. №2. ОЧИСТКА ЗАГРЯЗНЕННОЙ ПОВАРЕННОЙ СОЛИ | 12 | |
| 3. | П.Р. №3. ПОЛУЧЕНИЕ КИСЛОРОДА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | 13 | |
| 4. | П.Р. № 4. ПРИГОТОВЛЕНИЕ РАСТВОРОВ СОЛЕЙ С ОПРЕДЕЛЕННОЙ МАССОВОЙ ДОЛЕЙ РАСТВОРЕННОГО ВЕЩЕСТВА. | 15 | |
| 5. | П.Р. №5. РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ: «ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ» | 15 | |
| 6. | П.Р. №6. ПОЛУЧЕНИЕ СОЛЯНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЕ СВОЙСТВ | 16-17 | |
| II. | Контрольные и проверочные работы | 18-60 | |
| ТЕМА 1. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ. | 18-26 | ||
| 1 | С/р. Вещества. Свойства веществ» | 18-19 | |
| 2 | С/р. Вещества. Свойства веществ. Физические и химические явления. Лабораторное оборудование». | 20 | |
| 3 | Лабораторное оборудование, химическая посуда и правила работы с ними» | 21 | |
| 4 | С/р. Общие сведения о веществах. Тела и вещества. | 22 | |
| 5 | С/р. Химические формулы. Относительная молекулярная масса. Массовая доля элемента | 20 | |
| 6 | C/р. Валентность | 21-22 | |
| 7 | С/р. Химические уравнения | 22-23 | |
| 8 | С/р. Количество вещества. Моль. | 24 | |
| 9 | Контрольная работа по теме: «Первоначальные химические понятия» | 25-26 | |
| ТЕМА 2-4. КИСЛОРОД. ВОДОРОД. ВОДА. РАСТВОРЫ. | 27-33 | ||
| 1 | Контрольная работа за 1 полугодие | 27 | |
| 2 | Контрольно-измерительный тест за 1 полугодие в форме ЕГЭ | 28-33 | |
| ТЕМА 5. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ | 34-49 | ||
| 1 | С/р. Оксиды. | 34-35 | |
| 2 | С/р. Основания | 36-37 | |
| 3 | С/р. Соли. Названия. | 37-38 | |
| 4 | С/р. Классы веществ. Уравнения реакций. | 38 | |
| 5 | Проверьте себя по разделу «Классификация неорганических веществ»: | 40 | |
| 6 | С/р. Обобщение сведений о важнейших классах неорганических веществ.
| 41-42 | |
| 7 | Контрольная работа по теме: Важнейшие классы неорганических веществ | 43-44 | |
| 8 | Контрольная работа по теме Важнейшие классы неорганических веществ (тестовая форма)
| 45-49 | |
| ТЕМА 6. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА МЕНДЕЛЕЕВА Д.И. СТРОЕНИЕ АТОМА. | 50-52 | ||
| 1. | С/р. Строение атомов. | 50 | |
| 2. | Контрольная работа по теме: Периодический закон Д. И. Менделеева. Строение атомов | 51-52 | |
| ТЕМА 7. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ ВЕЩЕСТВ. | 53-57 | ||
| 1 | С/р. Типы химической связи | 53-54 | |
| 2 | С/р. Степень окисления. Окислительно – восстановительные реакции | 54-55 | |
| 3 | Контрольная работа по теме: Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома и Строение вещества. Химическая связь | 56-57 | |
| ТЕМА 8. ЗАКОН АВОГАДРО. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ | 58 | ||
| 1 | С/р. Закон Авогадро. | 58 | |
| ТЕМА. 9. ГАЛОГЕНЫ | 58 | ||
| 1 | С/р. Галогены | 58 | |
| Итоговая контрольная работа за курс химии 8 класса. | 59-60 | ||
75

 Получите свидетельство
Получите свидетельство Вход
Вход











 Лабораторная работа по химии 8 класс (1.11 MB)
Лабораторная работа по химии 8 класс (1.11 MB)
 0
0 7998
7998 162
162 Нравится
0
Нравится
0


