КОНСПЕКТ ЗАНЯТИЯ
УГЛЕВОДЫ
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4.
НЕКОТОРЫЕ ВАЖНЕЙШИЕ УГЛЕВОДЫ
| Моносахариды | Олигосахариды | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Галактоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 | Дисахариды: Сахароза С12Н22О11 Лактоза (молочный сахар) С12Н22О11 Мальтоза (солодовый сахар) С12Н22О11
| Целлюлоза Крахмал Гликоген |
Физические свойства
Моно- и олигосахариды – твердые, белые кристаллические вещества, имеют сладкий вкус, хорошо растворимы в воде. Полисахариды – твердые, без сладкого вкуса, практически нерастворимые в воде (кроме крахмала).
Моносахариды
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных.
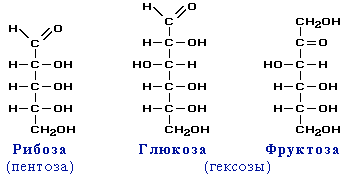
ГЛЮКОЗА
Строение
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами - α и β и линейной формой:
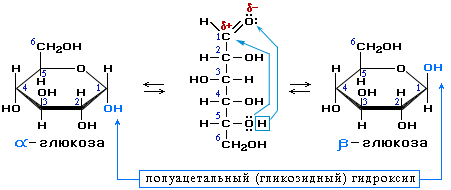
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится втранс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении.
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией
В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
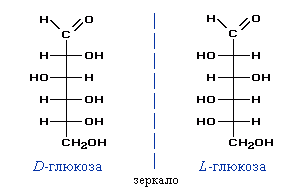
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий):
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Получение.
В промышленности
Гидролиз крахмала:
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории
Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе
Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
Другие способы
Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
Химические свойства глюкозы.
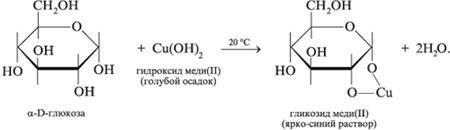
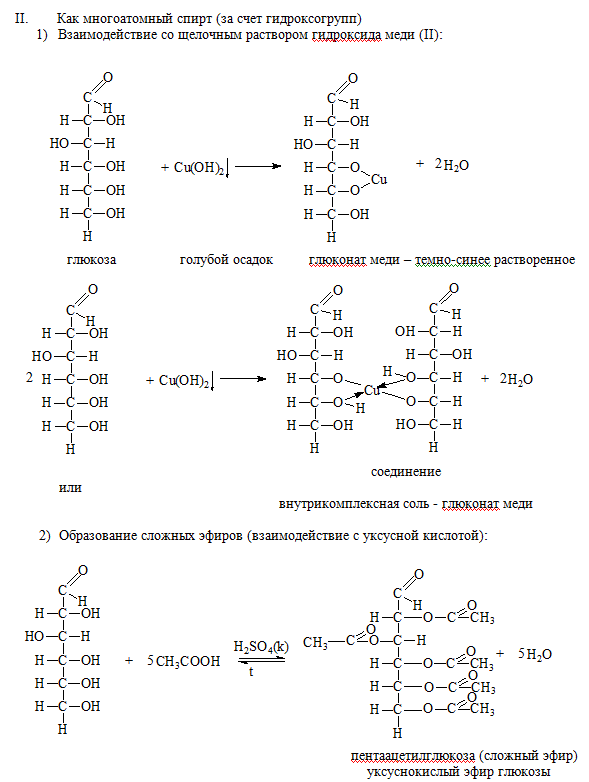
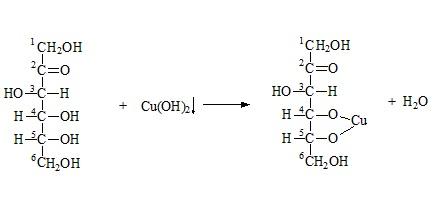
Реакция комплексообразования с гидроксидом меди (II).
Глюкоза как многоатомный спирт
При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
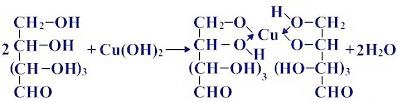
(глюкозат меди (II) – синий раствор)
2. Глюкоза как альдегид
а) реакция серебряного зеркала. Образуется соль глюконовой кислоты.
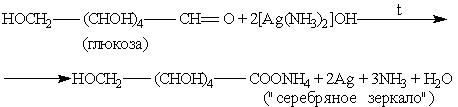
б) реакция с гидроксидом меди (II) при нагревании. Образуется глюконовая кислота.
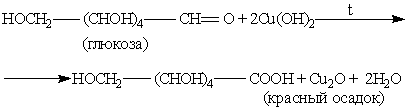
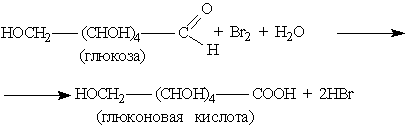
в) Глюкозу также можно окислить до глюконовой кислоты бромной водой, хлором, азотной кислотой (разб.):
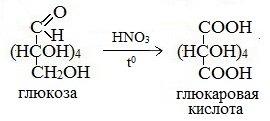
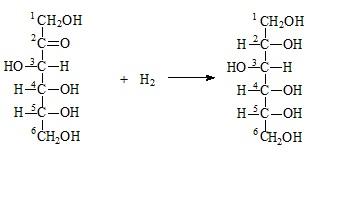
г) Каталитическое гидрирование глюкозы – происходит восстановление карбонильной группы до спиртового гидроксила, получается шестиатомный спирт – сорбит.
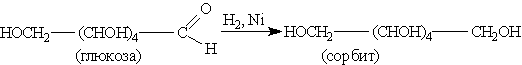
д) С NaHSO3 – НЕ реагирует!!!
3. Реакции брожения.
а) спиртовое брожение C6H12O6 2C2H5OH + 2CO2
этанол
б) молочнокислое брожение C6H12O6 2CH3-CH(OH)-COOH
молочная кислота
в) маслянокислое брожение C6H12O6 C3H7COOH + 2CO2 + 2H2O
масляная кислота
г) лимоннокислое брожение 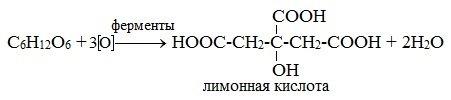
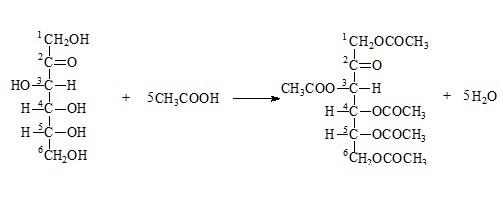
4. Реакции образования эфиров глюкозы.
Глюкоза способна образовывать простые и сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила:
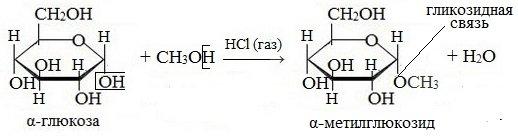
Простые эфиры получили название гликозидов.
В более жестких условиях (например, с CH3-I ) возможно алкилирование и по другим оставшимся гидроксильным группам.
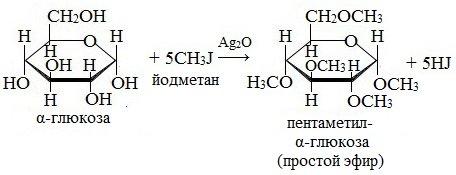
Моносахариды способны образовывать сложные эфиры с карбоновыми кислотами (реакция проходит с ангидридами, а не с самими кислотами) и с минеральными кислотами.
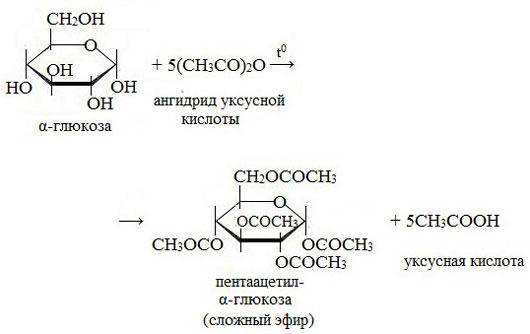
5. Реакция горения глюкозы.
C6H12O6 + 6О2 6CO2 + 6H2O
Фруктоза
Это структурный изомер глюкозы - кетоноспирт:
СН2- СН- СН- СН - С - СН2
| | | | ║ |
OH OH OH OH O OH
Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп. Так же, как и глюкоза, реагирует с гидроксидом меди (ярко-синий раствор) без нагревания; образует простые и сложные эфиры, горит. При гидрировании фруктозы также получается СОРБИТ. С бромной водой, Сu(OH)2 при нагревании, аммиачным раствором оксида серебра – не реагирует.
Реакция восстановления:
Реакция многоатомных спиртов:
Образование сложных эфиров:
Дисахариды
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Физические свойства и нахождение в природе
1. Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде.
2. Температура плавления сахарозы 160 °C.
3. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике.
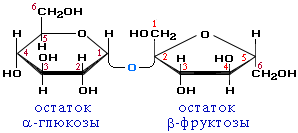
Строение
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом.
Химические свойства
В молекуле сахарозы гликозидный атом углерода глюкозы СВЯЗАН, поэтому она не образует ОТКЫТУЮ (альдегидную) форму. (альдегидная группа α-глюкозы, входящей в состав сахарозы, участвует в образовании связи с β-фруктозой)
Вследствие этого сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Подобные дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза реагирует с Сu(OH)2 без нагревания (ярко-синий раствор), с Са(ОН)2 (образуется сахарат кальция).
Сахароза подвергается гидролизу подкисленной водой:
С12Н22О11 + Н2О С6Н12О6 (глюкоза) + С6Н12О6 (фруктоза)
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
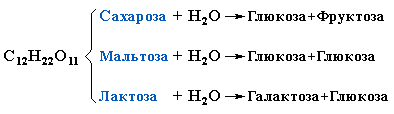
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
Применение сахарозы
· Продукт питания;
· В кондитерской промышленности;
· Получение искусственного мёда
2. Мальтоза
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
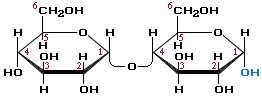
остаток остаток
α-глюкозы α-глюкозы
Мальтоза – является восстанавливающим дисахаридом и вступает в реакции, характерные для альдегидов.
К восстанавливающим сахаром относятся также целлобиоза
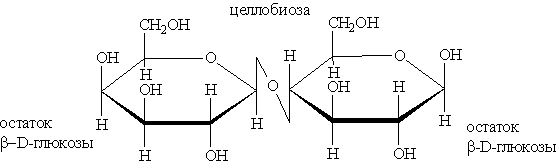
и лактоза
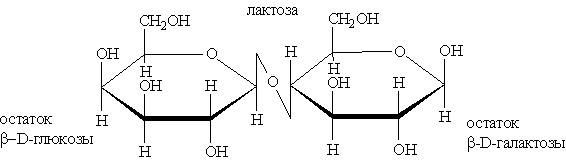
Эти дисахариды так же могут гидролизоваться.
Полисахариды.
Полисахариды - это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Основные представители - крахмал и целлюлоза - построены из остатков одного моносахарида - глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу (C6H10O5)n, но совершенно различные свойства. Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы (выделена цветом):
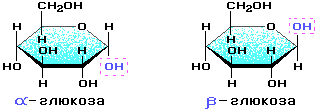
Крахмал.
Крахмалом называется смесь двух полисахаридов, построенных из остатков циклической α-глюкозы.
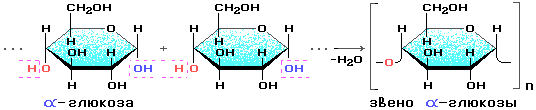
В его состав входят:
амилоза (внутренняя часть крахмального зерна) – 10-20%
амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200-1000 остатков α-глюкозы (средняя Mr=160 000) и имеет неразветвленное строение.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
Свойства крахмала:
1. Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется.
2. Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
3. Качественная реакция на крахмал: синее окрашивание с раствором йода.
Получение
Получают крахмал из природных крахмалосодержащих продуктов, чаще всего картофеля и кукурузы. Он широко используется в качестве продукта питания, а также как сырье для производства глюкозы и этилового спирта.
Целлюлоза
Физические свойства
Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II)
Нахождение в природе
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Древесина состоит на 50% из целлюлозы, а хлопок и лён, конопля практически чистая целлюлоза.
Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
Получение
Получают из древесины
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Молекулярная масса целлюлозы – от 400 000 до 2 млн.
Свойства целлюлозы.
1. Горение
(С6Н10О5)n + О2 CO2 + Н2О
Без доступа кислорода – до угля и воды
(С6Н10О5)n C + Н2О
2. С йодом целлюлоза сине-фиолетовое окрашивание не дает.
3. Образование сложных эфиров с азотной и уксусной кислотами.
а) нитрование целлюлозы. Т.к. в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
(С6Н7О2(ОН)3)n + 3n HNO3 3nH2O + (С6Н7О2(ОNO2)3)n
целлюлоза тринитрат целлюлозы (пироксилин)
б) ацилирование целлюлозы. При действии на целлюлозу уксусного ангидрида происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН. Получается ацетат целлюлозы – ацетатное волокно.
(С6Н7О2(ОН)3)n +3n(СН3СО)2О 3nСН3-СООН + (С6Н7О2(ОСОСН3)3)n
целлюлоза уксусный ангидрид уксусная кислота триацетат целлюлозы
|
+ 3n | |
→ |
|
+ 3n СH3СOOН |
4. Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде гидролизуется:
Применение
Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и др.
· Получение ацетатного шёлка – искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
· Получение бездымного пороха из триацетилцеллюлозы (пироксилин).
· Получение коллодия (плотная плёнка для медицины) и целлулоида ( изготовление киноленты, игрушек) из диацетилцеллюлозы.
· Изготовление нитей, канатов, бумаги.
· Получение глюкозы, этилового спирта (для получения каучука)

 Получите свидетельство
Получите свидетельство Вход
Вход











 Конспект занятия "Углеводы" (412.5 KB)
Конспект занятия "Углеводы" (412.5 KB)
 0
0 739
739 4
4 Нравится
0
Нравится
0


