| Министерство образования и науки Самарской области |
| государственное бюджетное профессиональное образовательное учреждение Самарской области «Сызранский медико-гуманитарный колледж» |
| |
| | УТВЕРЖДАЮ |
|
| Заместитель директора по УВР |
| | _________________Н.Г. Бурлова |
| | «__6___»_______05__________2019 |
| КОМПЛЕКТ |
| КОНТРОЛЬНО-ОЦЕНОЧНЫХ СРЕДСТВ |
| по учебной дисциплине |
| ОУД.11. Химия |
| программы подготовки специалистов среднего звена |
| 34.02.01 сестринское дело |
| базовая подготовка |
| |
| |
г.о. Сызрань, 2019
Комплект контрольно-оценочных средств разработан в соответствии с требованиями ФГОС СПО по специальности 34.02.01 Сестринское дело (базовая подготовка).
Составитель:
преподаватель ГБПОУ «СМГК» Захарова С.Г.
Комплект контрольно-оценочных средств рассмотрен и одобрен на заседании
цикловой методической комиссии по специальности 34.02.01 Сестринское дело
протокол № 9 от « _5__» ______05_______ 2019
| Председатель ЦМК | _________________________ подпись | Захарова С.Г. |
СОДЕРЖАНИЕ
| 1. | Пояснительная записка | 4 | |
| 2. | ПАСПОРТ КОМПЛЕКТА КОНТРОЛЬНО-ОЦЕНОЧНЫХ СРЕДСТВ | | |
| | 2.1. | Наименование УД, МДК | 4 |
| | 2.2. | Предметы оценивания | 4 |
| | 2.3. | Требования к деятельности обучающегося и соответствующих форм и методов оценивания | 6 |
| | 2.4. | Требования к кадровому обеспечению оценки | 9 |
| 3. | ПРОЦЕДУРЫ ОЦЕНКИ | 9-14 | |
| | 3.1. | Инструментарий оценки освоения УД, МДК | 9 |
| | 3.2. | Кодификация тестовых и практических заданий | 9 |
| | 3.3. | Итоги сформированности | 11 |
| | 3.4. | Критерии оценки знаний обучающихся | 12 |
| 4. | ПРИЛОЖЕНИЯ | 13-23 | |
| | 4.1. | Контрольные вопросы по дисциплине | 13-15 |
| | 4.2. | Инструкции по выполнению работы, тесты | 16-21 |
| | 4.3. | Эталон ответов | 22 |
| | 4.4. | Литература | 23 |
1. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Основной целью оценки освоения учебной дисциплины «Химия» является оценка умений и знаний.
Оценка осуществляется с использованием письменного опроса в форме дифференцированного зачета, и предусматривает использование 5-балльной системы оценивания.
2. Паспорт комплекта оценочных средств
2.1. Учебная дисциплина
ОУД.11 Химия
2.2. Предметы оценивания
В результате изучения учебной дисциплины обучающийся должен:
уметь:
У.1. называть: изученные вещества по «тривиальной» или международной номенклатурам;
У.2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
У.3. характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов).
У.4. объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
У.5. проводить расчеты по химическим формулам и уравнениям реакций;
У.6. осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
У.7. использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
• для понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
• объяснения химических явлений, происходящих в природе, быту и на производстве;
• экологически грамотного поведения в окружающей среде;
• оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
• безопасной работы с веществами в лаборатории, быту и на производстве;
• определения возможности протекания химических превращений в различных условиях и оценки их последствий;
• распознавания и идентификации важнейших веществ и материалов;
• оценки качества питьевой воды и отдельных пищевых продуктов;
• критической оценки достоверности химической информации, поступающей из различных источников.
знать:
З.1. роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
З.2. важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-основные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, основные типы реакций в неорганической и органической химии;
З.3. основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, периодический закон Д.И. Менделеева, закон Гесса, закон Авогадро;
З.4. основные теории химии: строение атома, химической связи, электролитической диссоциации кислот и оснований, строения органических и неорганических соединений, химическую кинетику и химическую термодинамику;
З.5. классификацию и номенклатуру неорганических и органических соединений;
З.6. природные источники углеводородов и способы их переработки;
З.7. вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводы, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства.
2.3. Требования к деятельности обучающегося и соответствующих форм и методов оценивания
| Предмет оценивания (перечень ОР: знания, умения, опыт практической деятельности с ФГОС) | Объект (ы) оценивания | Показатели оценки сформированности ОР | Тип задания/ Методы оценки |
| У.1. называть: изученные вещества по «тривиальной» или международной номенклатурам | Номенклтура химических веществ | Владение навыком называть вещества по разным видам номенклатур | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| У.2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии | Умение различать и описывать химические вещества | Умение определять валентность и степень окислеия химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии; | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| У.3. характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов) | Умение идентифицировать изучаемые объекты | Умение характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов). | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| У.4. объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул | Умение различать и описывать химические вещества | Владение логическим мышлением и способностью объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул; | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| У.5. проводить расчеты по химическим формулам и уравнениям реакций | Умение применять методы познания для описания химических явлений | Владение навыком математических вычислений, умение проводит расчеты по химическим формулам и химическим уравнениям | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| З.1. важнейшие химические понятия | Умение идентифицировать изучаемые объекты | Знают и понимают смысл важнейших химических понятий | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| З.2. основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, периодический закон Д.И. Менделеева, закон Гесса, закон Авогадро | Умение применять методы познания для описания химических явлений | Знают и понимают смысл важнейших химических законов | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| З.3. основные теории химии: строение атома, химической связи, электролитической диссоциации кислот и оснований, строения органических и неорганических соединений, химическую кинетику и химическую термодинамику; | Умение применять методы познания для описания химических явлений | Знают и понимают смысл важнейших химических теорий | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| З.4. классификацию и номенклатуру неорганических и органических соединений; | Умение идентифицировать изучаемые объекты | Знают классификацию и номенклатуру неорганических и органических соединений | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
| З.5. вещества и материалы, широко используемые в практике | Умение применять методы познания для описания химических явлений | Знают вещества и материалы, широко используемые в практике | Теоретическое задание/письменный ответ Оценка результатовдиффеиинцированного зачета |
2.4. Требования к кадровому обеспечению оценки
| Кадровое обеспечение | Характеристика |
| Эксперт-экзаменатор | Преподаватель дисциплин общеобразовательного цикла, осуществляющий подготовку по данному учебной дисциплине |
| Ассистент | Преподаватель дисциплин профессионального цикла, не осуществляющий подготовку по учебной дисциплине |
3. Процедуры оценки.
3.1. Задания для оценки освоения учебной дисциплины
Задания для оценки освоения учебной дисциплины представлены в 2 равнозначных вариантахВарианты содержат вопросы по неорганической и органической химии, разделены на 3 блока
Блок "А" состоит из 25 вопросов на выбор единственно верного ответа и задания.
Блок "Б" состоит из 2 заданий на соответствие заданных параметров
Блок «С» содержит 2 расчетные задачи
Время выполнения теста – 45 минут.
3.2. Кодификация тестовых заданий
| № п/п | Показатели оценки сформированности ОР | Номер вариант | |
| 1 | 2 | ||
| Номер вопросов | |||
|
| У.1. называть: изученные вещества по «тривиальной» или международной номенклатурам | А5, А6, А 15, А16 | А5, А6, А 15, А16 |
|
| У.2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии | А4, А 7, А8, А 13, А14, А 21 А22, А23 | А4, А 7, А8, А 13, А14, А 21 А22, А23 |
|
| У.3. характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов) | А1,А2, А7. А8, А17, А18, А 19, А24, А25 | А1,А2, А7. А8, А17, А18, А 19, А24, А25 |
|
| У.4.объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул | А3,А 9, А 10, А11 А 12 | А3,А 9, А 10, А11 А 12 |
|
| У.5. проводить расчеты по химическим формулам и уравнениям реакций | С1, С2 | С1, С2 |
|
| З.1. важнейшие химические понятия | А 4, А 9. А 13 А 22а 24 | А 4, А 9. А 13 А 22а 24 |
| 7. | З.2. основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, периодический закон Д.И. Менделеева, закон Гесса, закон Авогадро | С1, А2. | С1, А2. |
| 8. | З.3. основные теории химии: строение атома, химической связи, электролитической диссоциации кислот и оснований, строения органических и неорганических соединений, химическую кинетику и химическую термодинамику | А 1, А2. А9 | А 1, А2. А9 |
| 9. | З.4. классификацию и номенклатуру неорганических и органических соединений | А 5, А6, А 15. А16. А 17. А18. А 21 В1,В2 | А 5, А6, А 15. А16. А 17. А18. А 21 В1,В2 |
| 10. | З.5. вещества и материалы, широко используемые в практике | А 5, А 6, А 9, А11, А14, А24, А25 | А 5, А 6, А 9, А11, А14, А24, А25 |
3.3. Итоги сформированности
| Предмет оценивания (перечень ОР:Знания,Умения, Опыт практической деятельности в соответствии с ФГОС) | Показатели оценки сформированности ОР | Номер задания |
| У.1.называть: изученные вещества по «тривиальной» или международной номенклатурам | Умеет называть изученные вещества по разным видам номенклатур | см п 3.2 |
| У.2.определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии | Умеет определять основные химические показатели для различных веществ | |
| У.3. характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов) | Умеет применять химическую информацию для объяснения химических явлений | |
| У.4.объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул | Умеет применять химическую информацию для объяснения химических явлений и процессов | |
| У.5. проводить расчеты по химическим формулам и уравнениям реакций | Умеет проводить математические расчеты и применять их для химических явлений | |
| З.1. важнейшие химические понятия | Знает важнейшие химические понятия | |
| З.2. основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, периодический закон Д.И. Менделеева, закон Гесса, закон Авогадро | Знает основные химические законы и использует их для конкренных химических задач | |
| З.3. основные теории химии: строение атома, химической связи, электролитической диссоциации кислот и оснований, строения органических и неорганических соединений, химическую кинетику и химическую термодинамику | Знает основные химические теориии и применяет их для конкрентных химических задач | |
| З.4. классификацию и номенклатуру неорганических и органических соединений | Знает различные виды номенклатур | |
| З.5. вещества и материалы, широко используемые в практике | Знает области применения различных химических веществ |
3.4. Критерии оценки знаний
Задания блока «А» оцениваются 1 баллом. Максимальное количество баллов по блоку 25
Задания блока «В» оцениваются 2 баллами. Максимальное количество баллов по блоку 4
Задания блока «С» оцениваются 3 баллами. Максимальное количество баллов по блоку 6
Общее количество баллов по работе – 35 баллов
| Процент правильных ответов, % | Количество правильных ответов | Оценка знаний |
| 90-100 | 35-32 | 5 «отлично» |
| 80-89 | 31-28 | 4 «хорошо» |
| 70-79 | 27-24 | 3 «удовлетворительно» |
| Менее 70 | Менее 23 | 2 «неудовлетворительно» |
ПРИЛОЖЕНИЯ
4.1. Контрольные вопросы
Вопросы по неорганической химии
1. Предмет и задачи химии. Значение неорганической химии в подготовке будущего медика. Основные законы химии.
2.Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. Научный и гражданский подвиг Д. И. Менделеева
3.Современные представления о строении атомов химических элементов и закономерности в изменении их свойств на примере: элементов одного периода. Электронные формулы и графические схемы строения электронных слоев атомов этого периода.
4.Современные представления о строении атомов химических элементов и закономерности в изменении их свойств на примере:
5. Элементов одной главной подгруппы. Электронные формулы и графические схемы строения электронных слоев атомов этой подгруппы.
6.Химическая связь, типы химической связи, примеры веществ с разными типами связи
7.Химическое равновесие и условия его смещения: изменение концентрации реагирующих веществ, температуры, давления.
8.Скорость химических реакций. Зависимость скорости от природы реагирующих веществ, температуры, катализатора.
9. Металлы, их положение в периодической системе химических элементов Д.И.Менделеева, строение их атомов, металлическая связь, металлическая кристаллическая решётка и физические свойства металлов. Общие химические свойства металлов.
10. Неметаллы, их положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
11. Классификация химических реакций в неорганической и органической химии.
12. Растворы. Способы выражения концентрации растворов (массовая доля, молярная концентрация)
13. Теория электролитической диссоциации. Диссоциация веществ с ионной и сильнополярной ковалентной связями.Гидролиз солей, его типы.
14.Окислительно- восстановительные процессы, их значение.
15.Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
16.Основания , их классификация и свойства на основе представлений об электролитической диссоциации.
17.Соли, их состав, свойства на основе представлений об электролитической диссоциации.
18.Оксиды, их состав, свойства на основе представлений об электролитической диссоциации.
19.Электрохимический ряд металлов. Вытеснение металлов из растворов солей другими металлами. Коррозия металлов. Способы защиты металлов от коррозии.
20.Электролиз как окислительно-восстановительный процесс. Электролиз расплавов и растворов на примере хлорида натрия.
21.Типы кристаллических решеток веществ. Зависимость свойств веществ от типа кристаллической решетки.
22.Вода. Ее потребление в быту и на производстве. Роль воды в химических реакциях.
23.Общая характеристика элементов YII группы главной подгруппы. Ответ подтвердите уравнениями реакций.
24.Общая характеристика элементов VI группы, главной подгруппы. Кислород и сера как простые вещества. Аллотропия. Наиболее важные соединения кислорода и серы, их значение для человека.
25.Общая характеристика элементов V группы, главной подгруппы на основании их положения в периодической системе Д.И. Менделеева и строения атомов. Азот и фосфор как простые вещества. Аллотропные видоизменения фосфора, их строение и свойства. Наиболее важные соединения азота и фосфора, их применение. Биологическая роль азота и фосфора.
26.Общая характеристика элементов V группы, главной подгруппы на основании их положения в периодической системе Д.И. Менделеева и строения атомов. Азот и фосфор как простые вещества. Аллотропные видоизменения фосфора, их строение и свойства. Наиболее важные соединения азота и фосфора, их применение. Биологическая роль азота и фосфора.
27. Реакции ионного обмена. Признаки реакций ионного обмена
Вопросы по органической химии
Основые положения теории химического строения органических веществ А.М. Бутлерова. Изомерия органических веществ, ее виды.
Предельные углеводороды, общая формула гомологов данного ряда, строение. Химические свойства метана. Практическое применение алканов.
Непредельные углеводороды ряда этилена, общая формула и химическое строение. Свойства и применение этилена.
Алкины, их химическое строение, свойства, нахождение в природе, практическое значение.
Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение.
6.Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов.
7.Предельные одноатомные спирты, их строение, физические и химические свойства. Получение и применение этилового спирта.
8.Фенол, его химическое строение, свойства, получение и применение.
9.Альдегиды, их химическое строение и свойства. Получение и применение муравьиного и уксусного альдегидов.
10.Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
11.Жиры, их состав и свойства. Биологическая роль жиров. Переработка жиров.
12.Многоатомные спирты. Глицерин и этиленгликоль как представители многоатомных спиртов.
13.Углеводы. Классификация.Глюкоза, строение, свойства, применение.
16.Углеводы, классификация
17.Аминокислоты, состав, свойства, биологическая роль, применение.
18.Белки как биополимеры. Свойства и биологические функции белков
19.Амины. Анилин, строение, свойства, применение.
20.ВМС. Полимеры, получение и применение
Государственное бюджетное профессиональное образовательное учреждение Самарской области
«Сызранский медико-гуманитарный колледж»
| Рассмотрено на заседании ЦМК Протокол № 9 "__7__"___05____2019 г. Председатель ЦМК ООД __________ С.Г.Захарова
| Зачетное задание по дисциплине «Химия» по специальностям: 34.02.01 Сестринское дело 31.02.02 Акушерское дело 31.02.03 Лабораторная диагностика Курс: I Группа: 121, 122, 123, 124, 131,141 | Утверждаю Зам.директора по УВР ________ Н.Г. Бурлова
«___»________ 2019 г. |
Вариант 1 Часть А Выберите один правильный ответ
1. Число электронов, которые содержатся в атоме углерода равно:
1) 6; 2) 12; 3) 8
2. Электронная формула атома 1s 22s 22p 63s 23p2 . Химический знак этого элемента:
1) C; 2) O; 3) Si
3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий:
1) увеличиваются; 2) уменьшаются; 3) не изменяются.
4. Химическая связь в молекуле воды:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
5. Формулы кислотных оксидов:
1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
6. Формула сероводородной кислоты: 1) H2S; 2) H2SO4; 3) H2SO3
7. К реакциям обмена относится:
1) CaO + H2O= Ca(OH)2; 2) Сu(OH)2= CuO + H2O; 3) KOH + HNO3= KNO3 + H2O
8. Горение аммиака 4NH3(r) + 3О2(г) = 2N2(r) + 6Н2О(Ж) + Q является реакцией
соединения, каталитической, эндотермической
замещения, каталитической, экзотермической
окислительно-восстановительной, некаталитической, экзотермической
обмена, некаталитической, эндотермической
9. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются:
1) кислотами; 2) солями; 3) основаниями.
| 10.Сокращенное ионное уравнение Ba2+ + SO42- = BaSO4 соответствует реакции между: | |
| а) раствором Ba(OH)2 и раствором H2SO4; | в) BaCO3 u раствором H2SO4; |
| б) раствором Ba(NO3)2 и раствором H2SO4; | г) BaO и раствором Na2SO4; |
11. Осадок образуется при взаимодействии раствора КОН с
HNO3 2. NH4Cl 3. SO3 4. FeSO4
12. Химическое равновесие в системе СО(г) + 2Н2(г) → СН3ОН(г) + Q сместится в сторону продукта реакции при
1) понижении температуры 2) понижении концентрации СО
3) повышении концентрации СН3ОН 4) повышении температуры
13.. Какая степень окисления хрома в К2Сr2О7?
1) +6; 2) +3; 3) -3; 4) -6.
14. Лакмус становится красным в водном растворе
1) Ca(NO3)2 2) Na2SiO3 3) CrCl3 4) K2S
15. Вещества с общей формулой CnH2n относятся к классу
1) алканов 2) алкенов 3) алкинов 4) аренов
16. Вещество, формула которого С2Н6 относится к классу
1) алканов 2) алкенов 3) алкинов 4) Аренов
17. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
18. Вещество, формула которого СН2 = СН – СН – СН3 называется
СН3
1) 2-метилбутен-3 2) 2-метилбутин-3 3) 3-метилбутен-1 4) 3-метилбутин-1
19. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция
1) замещения 2) гидрирование 3) присоединение 4) дегидрирование
20.Укажите «лишнее» вещество в ряду:
1) 3 -метилбутаналь; 2) изопропанол;
3) метаналь; 4) ацетальдегид.
21. Дайте название соединению
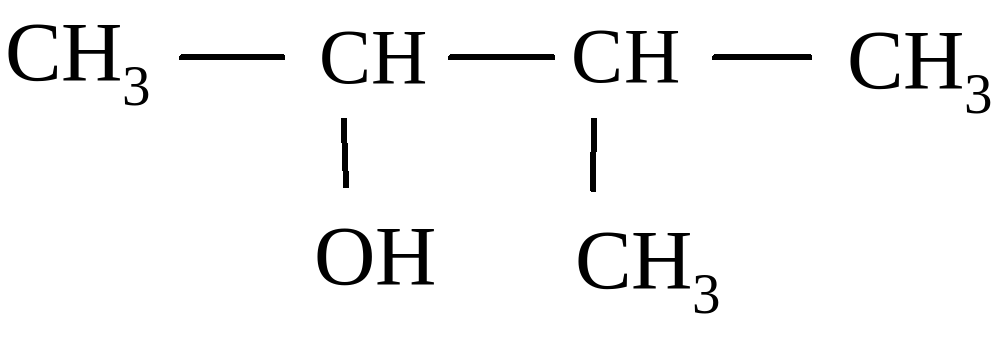
1) 3-метилбутанол-2; 2) 2-метилбутанол-3;
3) 3-метилпропанон-2; 4) 2-метилпропаналь-2.
22. Функциональная группа – СОН характерна для:
1) альдегидов; 2) сложных эфиров;
3) простых эфиров; 4) спиртов.
23. Вещество, относящееся к аминам, имеет формулу
1)С6Н5—NO2 2) С6Н5—NH2
3)С6Н5—СН3 4) С6Н5—OH
24. Мономерами белков выступают:
1) аминокислоты; 2) моносахариды;
3) нуклеотиды; 4) остатки фосфорной кислоты.
25. Какие вещества можно использовать для последовательного осуществления следующих превращений С2H5Cl → С2Н5ОН → С2Н5Оna
1) KOH, NaCl 3) KOH, Na
2) HOH, NaOH 4) O2, Na
Часть В
В1. Установите соответствие между формулой вещества и его принадлежностью к определенному классу (группе), неорганических соединений.
| ХИМИЧЕСКАЯ ФОРМУЛА: А) Н3РО4 Б) Fе(ОН)3 В) LiВr Г) АlОН(NО3)2 F) | КЛАСС (ГРУППА): 1) кислота; 2) основание; 3)амфотерный гидроксид; 4) средняя соль; 5) кислая соль; 6) основная соль. |
В 2. Установите соответствие между формулой вещества и названием.
1) C2H5OH а) уксусная кислота
2) CH3COOH б) глюкоза
3) C12H22O11 в) этиловый спирт
4) C6H5OH г) фенол
д) сахароза
е) глицерин
Часть С Решите расчетные задачи
С 1. Соединение содержит 57.5% натрия, 40% кислорода, 2.5% водорода. Определите простейшую формулу вещества
С 2. Смешали 150 г 10% и 300 г 25% раствора. Вычислите массовую долю полученного раствора.
Государственное бюджетное профессиональное образовательное учреждение Самарской области
«Сызранский медико-гуманитарный колледж»
| Рассмотрено на заседании ЦМК Протокол № 9 "__7__"___05____2019 г.
Председатель ЦМК ООД __________ С.Г.Захарова
| Зачетное задание по дисциплине «Химия» по специальностям: 34.02.01 Сестринское дело 31.02.02 Акушерское дело 31.02.03 Лабораторная диагностика Курс: I Группа: 121, 122, 123, 124, 131,141 | Утверждаю Зам.директора по УВР ________ Н.Г. Бурлова «___»________ 2019 г. |
Вариант 2 Часть А Выберите один правильный ответ
1. Число нейтронов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 :
1) N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) H2O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ; 2) NaOH и KHSO4; 3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + H2SO4= CaSO4 + H2; 2) Сu(OH)2= CuO + H2O; 3) KOH + HNO3= KNO3 + H2O
8. Реакция, уравнение которой 3H2 + N2 ↔ 2NH3 + Q, является
1) обратимой и экзотермической 2) необратимой и экзотермической
3)обратимой и эндотермической 4) необратимой и эндотермической
9. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основания
10. Сокращенное ионное уравнение Са2+ + СО32- = СаСО3 соответствует взаимодействию между веществами
Са(ОН)2 и СО2 3. СаО и СО2
СаСl2 и Na2CO3 4. CaSO4 и K2CO3
11. Осадок выпадает при взаимодействии растворов
HCl (р-р) и CuO 2. NaOH (р-р) и H3PO4
H2SO4 (р-р) и Al(OH)3 4. AgNO3 и KCl (р-р)
12. Химическое равновесие в системе 2NО(г) + О2(г) → 2NО2(г) + Q смещается в сторону образования продукта реакции при
1) повышении давления 2) повышении температуры
3) понижении давления 4) применении катализатора
13. Какая степень окисления железа в Fe2(SO4)3 ?
1) +6; 2) +3; 3) -3; 4) -6.
14. Кислую среду имеет водный раствор
1) Na3PO4 2) KCl 3) Na2CO3 4) ZnSO4
15. Для алканов характерна общая формула
1)CnH2n 2)CnH2n+2 3)CnH2n-2 4)CnH2n-6
16. К классу алкенов относится вещество с молекулярной формулой
1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14
17. Вещество, формула которого СН3 – С ≡ С – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
18. Гомологом этана является
1) С2Н4 2) С2Н6 3) С3Н8 4) С3Н6
19. Укажите название соединения СН2 = СН - СН2 - СН2 - СН2 - СН3
1) 3,3-диметилбутин-1; 2) октин-1; 3) 3,3-диметилпентин-1; 4) гексен-1
20. Для алкенов характерна реакция
1) замещения 2) обмен 3) присоединения 4) дегидратации
21. Дайте название соединению:
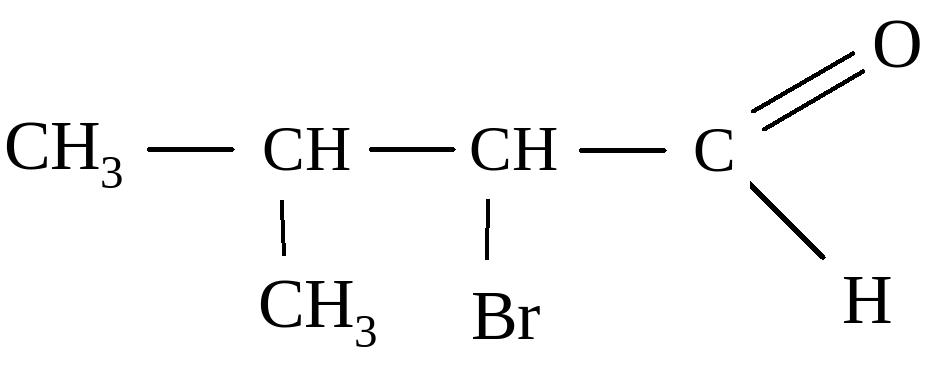
1) 2-метил-3-бромбутанол-1; 2) 2-бром-З-метилбутаналь;
3) 2-бром-З-метилпропаналь; 4) 2-метил-З-бромбутаналь.
22.Укажите «лишнее» вещество в ряду:
1) метанол; 2) этаналь; 3) пентанол; 4) бутиловый спирт.
23. Функциональная группа – СОО- характерна для
1) альдегидов; 2) сложных эфиров; 3) углеводов; 4) спиртов.
24.В состав белков может входить
1)пять аминокислот; 2) двадцать аминокислот;
3)десять аминокислот; 4) тридцать аминокислот
25. Какие вещества можно использовать для последовательного осуществления следующих превращений С2Н5ОН → С2Н5Сl → С4Н10
1)NaCl, Na 3) O2, Na
2) HСl, Na 4) HСl, NaОН
Часть В
В 1. Установите соответствие между формулой вещества и его принадлежностью к определенному классу (группе), неорганических соединений.
| ХИМИЧЕСКАЯ ФОРМУЛА: А) Н2S Б) NаНСО3 В) NН4СI Г) Са(ОН)2 F) | КЛАСС (ГРУППА): 1) кислота; 2) основание; 3)амфотерный гидроксид; 4) средняя соль; 5) кислая соль; 6) основная соль. |
В 2. Установите соответствие между названием вещества и его формулой.
1) уксусная кислота а) C2H5OH
2) сахароза б) CH3COOH
3) этаналь в) C12H22O11
4) этиловый спирт г) C6H5OH
д) CH3COH
е) C6H12O6
Часть С Решите расчетные задачи
С 1. Соединение содержит 24.7% калия, 34,8% марганца, 40.5% кислорода. Определите простейшую формулу вещества.
С 2. Смешали 300 г 30% и 150 г 25% раствора. Вычислите массовую долю полученного раствора.
4.3. Эталон ответов.
| Варианты | №1 | №2 | | №1 | №2 | | №1 | №2 |
| А1 | 1 | 3 | В1 | А-1 | А-1 | С1 | NaOH | KmnO4 |
| А2 | 3 | 2 | | Б-2 | Б-5 | | | |
| А3 | 1 | 2 | | В-4 | В-4 | С2 | 20% | 28.3% |
| А4 | 2 | 1 | | Г-6 | Г-2 | | | |
| А5 | 2 | 3 | | | | | | |
| А6 | 1 | 2 | В2 | 1-в | 1-б | | | |
| А7 | 3 | 1 | | 2-а | 2-в | | | |
| А8 | 3 | 1 | | 3-д | 3-д | | | |
| А9 | 2 | 3 | | 4-г | 4-а | | | |
| А10 | 2 | 2 | | | | | | |
| А11 | 4 | 4 | | | | | | |
| А12 | 1 | 1 | | | | | | |
| А13 | 1 | 2 | | | | | | |
| А14 | 3 | 4 | | | | | | |
| А15 | 2 | 2 | | | | | | |
| А16 | 1 | 3 | | | | | | |
| А17 | 1 | 3 | | | | | | |
| А18 | 3 | 3 | | | | | | |
| А19 | 1 | 4 | | | | | | |
| А20 | 2 | 3 | | | | | | |
| А21 | 2 | 2 | | | | | | |
| А22 | 1 | 2 | | | | | | |
| А23 | 2 | 2 | | | | | | |
| А24 | 1 | 2 | | | | | | |
| А25 | 3 | 2 | | | | | | |
4.4. Литература
Основные источники:
Габриелян. О.С. Химия. М.: Дрофа,2015.
Ерохин.Ю.М. Химия. М.: Издательский центр «Академия», 2013.
Ерохин Ю.М., Фролов В.И.. Сборник задач и упражнений по химии (с дидактическим материалом). М.: Высшая школа, 2017.
Дополнительные источники:
Цветков Л.А.. Органическая химия. М.: Гуманитарное изд. центр ВЛАДОС, 2003.
Рудзитис Г.Е., Фельдман Ф.Г. М.: Просвещение, 2007.
Кузьменко Н.Е., Еремин В.В. Химия. М.: Экзамен: Издательский дом "ОНИКС 21 век", 2010.
1

 Получите свидетельство
Получите свидетельство Вход
Вход












 Комплект контрольно-оценочных средств по дисциплине ОУД.11 Химия для специальности 34.02.01Сестринское дело (230.5 KB)
Комплект контрольно-оценочных средств по дисциплине ОУД.11 Химия для специальности 34.02.01Сестринское дело (230.5 KB)
 0
0 614
614 20
20 Нравится
0
Нравится
0


