
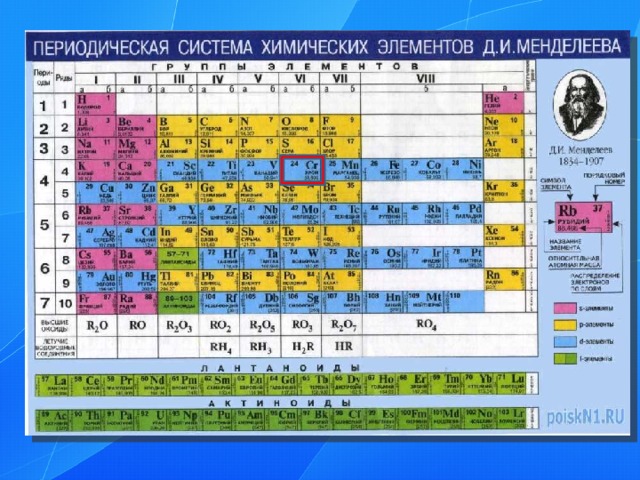
Периодическая таблица Д.И. Менделеева
Элемент № 24
ХРОМ
Учитель химии Стасенко О.А.
ряды
периоды
Группы элементов
VIII
III
VII
VI
V
IV
I
II
1
I
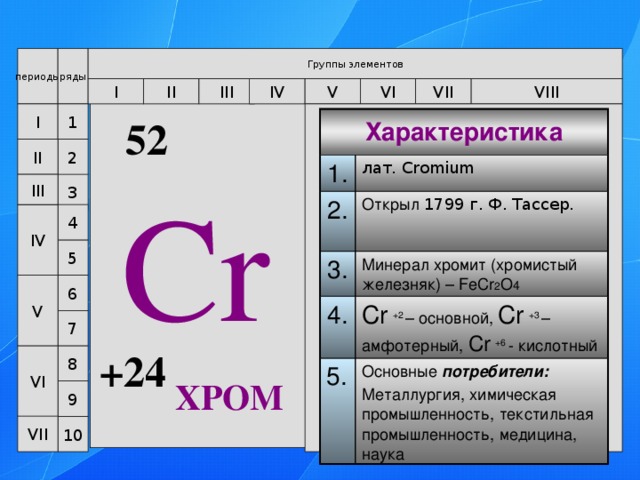
52
Характеристика
1.
лат. Cromium
2.
3.
Открыл 1799 г. Ф. Тассер.
Минерал хромит (хромистый железняк) – FeCr 2 O 4
4.
Cr +2 – основной, Cr +3 – амфотерный, Cr +6 - кислотный
5.
Основные потребители:
Металлургия, химическая промышленность, текстильная промышленность, медицина, наука
II
2
Cr
III
3
IV
4
5
V
6
7
+24
VI
8
ХРОМ
9
VII
10

хром
1.
Электронное строение
2.
Нахождение в природе
3.
Физические свойства
4.
Химические свойства
5.
Применение
хром
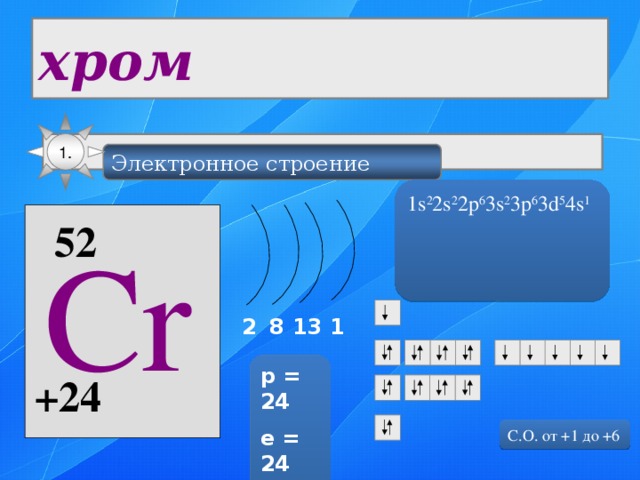
1.
Электронное строение
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
52
Cr
2
1
13
8
p = 24
e = 24
n = 28
+24
С.О. от +1 до +6

Месторождения хрома
- В земной коре хрома довольно много – 0,03%.
- Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо).
- Наша страна обладает огромными запасами хромитов.
- Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г.
- Значительные запасы хромовых руд есть и на Урале.
- Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.

Физические свойства
- В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой;
- Температура плавления – 1855 0 С;
- Хром (с примесями) является одним из самых твердых металлов, легко царапает стекло,
уступая лишь вольфраму (твердость по шкале Мооса 8.5).
- Очень чистый хром достаточно хорошо поддаётся механической обработке.
- Электро – теплопроводность небольшая
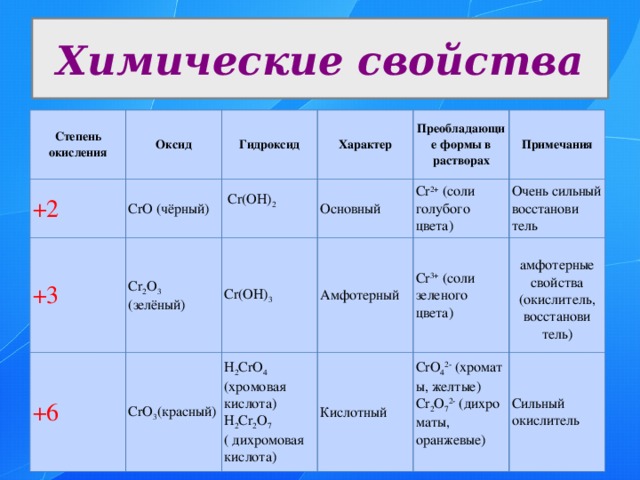
Химические свойства
Степень окисления
Оксид
+2
CrO (чёрный)
Гидроксид
+3
+6
Cr 2 O 3
Cr(OH) 2
Характер
(зелёный)
CrO 3 (красный)
Основный
Преобладающие формы в растворах
Cr(OH) 3
Примечания
H 2 CrO 4 (хромовая кислота) H 2 Cr 2 O 7
Амфотерный
Cr 2+ (соли голубого цвета)
Очень сильный восстанови
Кислотный
( дихромовая кислота)
Cr 3+ (cоли зеленого цвета)
тель
CrO 4 2- (хроматы, желтые) Cr 2 O 7 2- (дихроматы, оранжевые)
амфотерные свойства
Сильный окислитель
(окислитель, восстанови
тель)

Применение
- Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии.
- Больше всего хрома применяют для выплавки хромистых сталей.
- Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия.
- Широкое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов.
- Хром в виде иона Cr3+ - примесь в рубине, который используется как драгоценный камень и лазерный материал.
- Соединениями хрома протравливают ткани при крашении.
- Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия.

Наглядное применение

Роль хрома
в живых организмах
- Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
- В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.

Продукты, содержащие хром
- пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черный перец, мелисса, пивные дрожжи.

Основная роль хрома в организме - это регуляция сахара в крови.
- Хром работает вместе с инсулином по
перемещению сахара из крови в ткани
организма для использования или сох-
ранения. Этот микроэлемент настолько
важен для переносимости сахара, что
сильная его недостаточность приводит
к развитию диабетоподобного заболевания .
- Уровень хрома снижается при дет-
ском диабете, при коронарном арте-
риальном заболевании (склерозиро-
вании артерий, ведущим к сердцу).
- Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.


 Получите свидетельство
Получите свидетельство Вход
Вход
























 Хром (0.58 MB)
Хром (0.58 MB)
 2
2 1931
1931 244
244 Нравится
0
Нравится
0



