Задания по химии областной предметной олимпиады учителей 2016 г.
(необходимо предоставить справочный материал – таблицы электронных потенциалов сединений)
1. Состояние гомогенного равновесия H2 + I2D 2HI +Q установилось при равновесных концентрациях всех веществ, равных 2,0 моль/л. Составьте выражение для константы равновесия (по закону действующих масс) и рассчитайте ее значение. Сместится ли равновесие: а) при повышении температуры; б) при повышении давления
(Т = const); в) при добавлении водорода (V, T=const). Изменится ли при этих воздействиях значение константы равновесия? Дайте обоснованные ответы. (20 баллов)
2. Составьте уравнение реакции и подберите коэффициенты с помощью метода электронно-ионных полуреакций:
K2Cr2O7 + H2SO4(разб.) + H2O2 =
(0,2М; 200 мл) (избыток)
Используя справочные данные, подтвердите возможность самопроизвольного протекания реакции в стандартных условиях. По уравнению реакции рассчитайте объем газообразного продукта (л, н.у.), образовавшегося в результате полного протекания реакции. (20 баллов)
3. Составьте уравнения реакций, протекающих при растворении в воде следующих веществ: а) NH3.H2O ; б) KOH ; в) K2S. Используя справочные данные, расположите заданные соединения в порядке увеличения значения рН их растворов (температура и концентрация растворов одинаковые). (20 баллов)
4. В чем причина различия дипольных моментов молекул SO2 и SO3? Дайте обоснованный ответ, используя метод валентных связей. (25 баллов)
5. Составьте уравнение фазового равновесия в насыщенном растворе CaF2. Приведите название, значение и выражение (по закону действующих масс) для константы этого равновесия. (15 баллов)
Ответы на задания по химии областной предметной олимпиады учителей 2016 г.
1. (20 баллов)
Константа равновесия для данной гетерогенной реакции такова:
KC = [HI]2 / {[H2] [I2]} = 2,02 / (2,02,0) = 1
а) Данная реакция экзотермическая (Q 0), поэтому, в соответствии с принципом Ле-Шателье, нагревание приведет к смещению ее равновесия влево (в сторону реагентов). Выход продуктов при этом понизится, значение константы равновесия при нагревании уменьшится: KC = f(T).
б) при повышении давления равновесие не смещается, т.к. количества (моль) газообразных реагентов и продуктов равны (1+1=2); константа равновесия при Т = const не меняется;
в) при добавлении водорода (V=const) его концентрация увеличится, что по принципу Ле-Шателье ведет к смещению равновесия в сторону реагентов (вправо), константа равновесия при Т = const не меняется.
2.(20 баллов)
K2Cr2O7 + 4H2SO4(разб.) + 3H2O2 = Cr2(SO4)3 + 3O2 + 4H2O + K2SO4
Cr2O72+ 14H+ + 6e = 2Cr3++ 7H2O
H2O2 2e = O2 + 2H+
Разность потенциалов окислительно-восстановительных пар составляет:
= ОКВС= 1,33 В – 0,69 В = 0,64 В ; 0 В. Следовательно, данная реакция в стандартных условиях протекает самопроизвольно.
Количество газообразного продукта реакции O2 (моль) в соответствии с коэффициентами уравнения реакции равно количеству (моль) K2Cr2O7, умноженному на 3:
n(O2) = 3 n(K2Cr2O7) = 3 c(K2Cr2O7) V(K2Cr2O7) = 3 0,2моль/л0,2л = 0,012моль
Отсюда объем газообразного продукта (л, н.у.) O2 рассчитывается с учетом молярного объема газа при н.у.: V(O2) = n(O2)Vm газа =0,12моль22,4л/моль = 2,688л
3. (20 баллов)
а) Уравнение протолиза гидрата аммиака NH3.H2O (слабое основание):
NH3.H2O + H2ONH4++OH+ H2O; KO (NH4+/ NH3.H2O) =
=KB / KK(NH4+/ NH3.H2O) = {11014} / {5,561010} = 1,78105
б) Уравнение диссоциации гидроксида калия (сильное основание):
KOH = K+ + OH; реакция протекает нацело,
концентрация OH равна исходной концентрации KOH
в) Уравнения гидролиза сульфида калия K2S:
диссоциация: K2S = 2K+ + S2 ; K+ - непротолит, S2 - слабое основание
Протолиз слабого основания:
S2 + H2OHS + OH ; KO (HS/S2) = 3
= KB / KK(HS/S2) = {11014} / {1,231013} = 8,1102
При одинаковых температуре и концентрации растворов слабых оснований (а) и (б) рН раствора будет тем выше, чем больше значение KO. Еще выше будет рН раствора сильного основания. Таким образом, рН(б) рН(в) рН(а)
4. (25 баллов)
В SO2 иSO3центральным является атом серы. Его электронная конфигурация в нулевой степени окисления: S0 [Ne] 3s23p4.
Степени окисления центрального атома в данных молекулах таковы:
S+IVO2 иS+VIO3
Для молекулы SO2
Электронная формула S+IV: [Ne] 3s2 3p0, энергетическая диаграмма валентного уровня:
| 3s2 |
| 3p0 | ||
| |
|
|
|
|
OIIOII ;
Типгибридизации sp2(незавершенный треугольник):

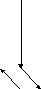
Векторная диаграмма дипольных моментов связей инеподеленных электронных пар показывает, что их сумма не равна 0:
(SO)+ (эл.пар) 0
Для молекулы SO3
Электронная формула S+VI: [Ne] 3s0 3p0, энергетическая диаграмма валентного уровня:
| 3s0 |
| 3p0 | ||
|
|
|
|
|
|
OIIOIIOII ;
Типгибридизации sp2(правильный треугольник):
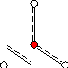
Векторная диаграмма дипольных моментов связей показывает, что их сумма равна 0:
(SO)= 0
5. (15 баллов)
Уравнение фазового равновесия: CaF2(т) Ca2+ + 2F ; константа этого равновесия – произведение растворимости: ПР = [Ca2+][F]2 = 4,01011.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Химия пәнінен тапсырмалар (54.61 KB)
Химия пәнінен тапсырмалар (54.61 KB)
 0
0 429
429 4
4 Нравится
0
Нравится
0


