Смотреть презентацию к уроку
Тема: «Факторы, влияющие на скорость химической реакции»
Тип урока: урок развития знаний, умений, навыков
Цель: усвоение умений самостоятельно в комплексе применять знания, умения, навыки, осуществлять их перенос в новые условия
Задачи:
образовательная – рассмотреть, как изменяется скорость реакции в зависимости от условий ее проведения; подвести учащихся к пониманию закономерностей, с помощью которых можно управлять химическими реакциями;
воспитательная – продолжить формирование мировоззренческих понятий: причинно-следственные связи и познаваемость мира; воспитывать у учащихся интерес к учению, стремление добиваться успехов за счет добросовестного отношения к своему труду;
развивающие – в процессе выполнения лабораторных опытов продолжить развитие мыслительных умений: анализировать, сравнивать и делать выводы.
Оборудование: учебник О. С. Габриелян, Г. Г. Лысова «Химия – 11»; учебное электронное издание «Химия (8-11 класс) Виртуальная лаборатория» 2004 год, МарГТУ, Лаборатория систем мультимедиа; персональные компьютеры.
Ход урока:
I. Организация начала занятия
II. Подготовка к основному этапу занятия
III. Конкретизация знаний, закрепление способов действий, систематизация знаний о закономерностях, с помощью которых можно управлять химическими реакциями.
IV. Подведение итогов занятия, информация о домашнем задании
I. Организация начала занятия
Задача этапа: подготовить учащихся к работе на занятии.
Учитель: сегодня мы продолжим изучение темы «Скорость химической реакции» и выясним, может ли человек, обладая определенными знаниями, управлять химической реакцией. Для решения этой проблемы мы отправляемся в виртуальную лабораторию. Чтобы войти в нее, необходимо показать свои знания о скорости химической реакции.
II. Подготовка к основному этапу занятия
Задачи этапа: актуализация опорных знаний и умений, обеспечение мотивации и принятия учащимися цели урока.
Актуализация знаний учащихся
Учитель организует фронтальную беседу:
Вопрос 1: что изучает химическая кинетика?
Предполагаемый ответ: химическая кинетика – наука о закономерностях протекания химических реакций во времени.
Вопрос 2: на какие две группы можно разделить реакции в зависимости от состояния химических веществ?
Предполагаемый ответ: если химические реакции происходят в однородной среде, например в растворе или газовой фазе, их называют гомогенными. А если реакция идет между веществами, находящимися в разных агрегатных состояниях, их называют гетерогенными.
Вопрос 3: как определить скорость гетерогенной реакции?
Предполагаемый ответ: скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности (учащийся записывает формулу на доске)
Вопрос 4: как определить скорость гомогенной реакции?
Предполагаемый ответ: Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени (учащийся записывает формулу на доске).
Учитель: теперь, используя свой жизненный опыт, предположите:
Вопрос 5: что сгорит быстрее: деревянная доска или древесные стружки?
Предполагаемый ответ: древесные стружки сгорят быстрее.
Вопрос 6: где быстрее сгорит уголь: на воздухе или в кислороде?
Предполагаемый ответ: быстрее уголь сгорит в кислороде.
III. Конкретизация знаний, закрепление способов действий, систематизация знаний о закономерностях, с помощью которых можно управлять химическими реакциями.
Задача этапа: обеспечить усвоение знаний и способов действий, организовав активную продуктивную деятельность учащихся.
Вводный рассказ учителя (сопровождается компьютерной презентацией):
Учитель: используя свой жизненный опыт, вы правильно предположили. Действительно, скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление, температура, поверхность соприкосновения реагирующих веществ, действие катализаторов. А как именно они изменяют скорость реакции: понижают или повышают, мы сейчас и узнаем, выполнив опыты в виртуальной лаборатории (Приложение №1)
По мере работы вы в своих рабочих тетрадях оформляете наблюдения в виде таблицы:
| Фактор, влияющий на скорость | Вывод о влиянии фактора на скорость | Обоснование влияния |
| | | |
По мере работы мы также будем использовать информацию учебника
на стр. 132-136.
Учащиеся под руководством учителя решают каждую экспериментальную задачу, и учитель, используя компьютерную презентацию (Приложение №2) подводит учащихся к обоснованным заключениям.
Результат работы:
| Фактор, влияющий на скорость | Вывод о влиянии фактора на скорость | Обоснование влияния |
| Концентрация реагирующих веществ | Прямая зависимость: чем выше концентрация, тем быстрее протекает реакция. Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции (закон действующих масс). Для реакции А+В=Д этот закон выразится так: U= K Х CA Х CB | Чтобы осуществилось химическое взаимодействие между частицами, они должны столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и соответственно скорость реакции. |
| Природа реагирующих веществ | Значение энергии активации определяет влияние природы вещества на скорость реакции. Например, энергия активации соляной кислоты меньше, чем уксусной и поэтому скорость реакции цинка с соляной кислотой выше. | Энергия активации - минимальный избыток энергии, который должна иметь частица, чтобы произошло эффективное соударение |
| Температура | При повышении температуры скорость реакции увеличивается согласно правилу Вант – Гоффа: повышение температуры на каждые 10 градусов приводит к увеличению скорости реакции в 2-4 раза. | Повышение температуры увеличивает долю «активных» молекул, способных преодолеть энергетический барьер реакции. |
| Действие катализатора | Катализатор – вещество, ускоряющее химическую реакцию, и остающееся неизменным по окончании реакции. Например, оксид ванадия, оксид марганца, ферменты. Ингибитор – вещество, замедляющее скорость реакции. | Катализатор изменяет механизм реакции, направляя ее по энергетически более выгодному пути с меньшей энергией активации. |
| От поверхности соприкосновения | При измельчении веществ, при растворении их в воде перед реакцией, скорость ее будет выше | Измельченные или растворенные вещества имеют больше площадь контакта для молекул |
Учитель: итак, какой вывод мы можем сделать: может ли человек управлять скоростью реакций?
Предполагаемый ответ: да, может, если обладает знаниями о химической кинетике.
IV. Подведение итогов занятия, информация о домашнем задании
Задачи этапа: оценить работу на уроке и показать значение проделанной работы для последующего изучения темы.
Учитель: давайте вспомним ход урока, что мы сегодня узнали, чему научились?
Рефлексия. Высказывания учащихся.
Учитель: домашнее задание: параграф 13, выучить информацию таблицы. Выполнить упражнения 1, 2, 5 стр. 140
Решение задачи по теме «Химическое равновесие»
| Задача Укажите, как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на равновесие системы: 2CO (г) + O2 (г) ↔ 2CO2 (г) + Q Решение: а) Изменение давления смещает равновесие реакций с участием газообразных веществ (г). Определим объёмы газообразных веществ до и после реакции по стехиометрическим коэффициентам: По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→). б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции – реакции разложения СО2 (←), т.к. по закону сохранения энергии: Q - 2CO (г) + O2 (г) ↔ 2CO2 (г) + Q в) При увеличении концентрации кислорода равновесие системы смещаетсяв сторону получения СО2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции. Дополнительно: Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) = 2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с. Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема: vпр = Ка2b vобр = К1с2. После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции: v’пр = К(3а)2(3b) = 27Ка2b v’обр = К1(3с)2 = 9К1с2 Отсюда: 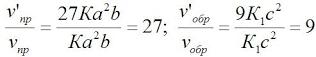
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3. Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2. Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле: 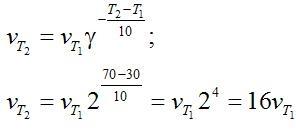
Следовательно, скорость реакции νТ2 при температуре 70оС больше скорости реакции νТ1 при температуре 30оС в 16 раз. Пример 3. Константа равновесия гомогенной системы: СО(г) + Н2О(г) = СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л. Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы: vпр = К1 [СО][Н2О] vобр = К2[СО2][Н2]
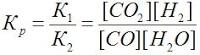
В условии задачи даны исходные концентрации, тогда как в выражениеКр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ: [СО2]р = [Н2]р = х моль/л; [СО]р = (3 – х) моль/л; [Н2О]р = (2 – х) моль/л. Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ: 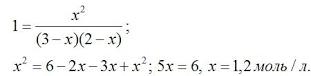
Таким образом, искомые равновесные концентрации: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 3 – 1,2 = 1,8 моль/л; [Н2О]р = 2 – 1,2 = 0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCl5(г) = РСl3(г) + Сl(г); ΔН = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5? Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесно, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (ΔН 0) то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РСl3 или Сl2. |
Задание.
Для равновесной системы:
2SO2 + O2 2SO3 + Q
определить, в какую сторону сместится равновесие при:
а) увеличении давления,
б) увеличении температуры
в) увеличении концентрации кислорода.
Решение.
Из принципа Ле-Шателье следует, что:
а) При увеличении давления равновесие должно сместиться таким образом, чтобы скомпенсировать это увеличение, т.е. в ту сторону, которая повлечет за собой снижение давления. Из уравнения видно, что слева 3 моль газов, а справа - 2. Значит, сместив равновесие вправо, кол-во моль газов уменьшится и давление снизится. Вывод: сместится вправо.
б) При увеличении температуры равновесие должно сместиться таким образом, чтобы скомпенсировать это увеличение, т.е. в ту сторону, которая повлечет за собой снижение температуры. Видно (+ Q), что реакция идет с выделением тепла. Значит, для отвода тепла должна идти обратная реакция. Вывод: сместится в сторону обратной реакции, т.е. влево.
в) При увеличении концентрации кислорода, как очевидно, должен идти процесс, в котором кислород расходуется, чтобы скомпенсировать увеличение его концентрации. То есть, прямая реакция. Вывод: сместится вправо.
Задание.
Константа равновесия реакции А + В = С + D равна 1. Начальная концентрация [В]0 = [А]0 = 2 моль/л. Сколько процентов вещества А подвергается превращению?
Решение.
Запишем выражение для константы равновесия. К = [С]*[D]/[А]*[В].
Поскольку К = 1, значит, [А]*[В] = [С]*[D ]
Обозначим количество прореагировавшего вещества как Х.
Из уравнения следует, что В прореагирует столько же, сколько и А, т.е. тоже Х.
И из уравнения же следует, что образуется Х моль [С] и Х моль [D].
Тогда равновесные концентрации составят:
[A]= (2 - x) моль/л.
[В ]= (2 - x) моль/л.
[с]= x моль/л.
[D]= x моль/л.
Из выражения [А]*[В] = [С]*[D],
(2-х)(2-х) = х2
Решая уравнение, получаем: Х = 1.
Значит, вещества А прореагировало 1 моль/л, что составляет w = 1*100%/2 = 50%.
Задание.
Константа равновесия химической реакции H2 + I2 = 2HI при некоторой температуре равна 4. Рассчитайте равновесную концентрацию HI, если исходные концентрации H2 и I2 соответственно равны 0,08 моль/л и 0,1 моль/л.
Решение.
Запишем выражение для K.
K = [HI]2/[H2][I2]
Обозначим количество прореагировавшего вещества как Х.
Йодоводорода образуется, по уравнению, [HI]= 2Х. С учетом этого, подставим данные в уравнение.
4 = (2х)2/(0,08 - x)(0,1 - x)
Решая уравнение, получим: х = 0,044
Определим равновесную концентрацию HI:
[HI]= 2x = 0,088 моль/л.
Задание.
Вычислите, сколько моль водяного пара необходимо ввести на каждый моль оксида углерода (II), чтобы 90% CO превратить в CO2 по реакции
CO(г) + H2O(г) = H2(г) + CO2(г), если константа равновесия реакции K = 1.
Решение.
Пусть изначально было 1 моль СО и х моль воды. Когда 90% CO превратить в CO2 , останется 0,1 моль СО. Следовательно, его прореагирует 0,9 моль.
Тогда, по уравнению реакции, прореагирует столько же воды, которой останется (х - 0,9) моль и образуется по 0,9 моль водорода и СО2.
K = [H2][CO2]/[CO][H2O]
1 = 0,1*(x - 0,9)/0,9*0,9
x = 7,2 моль.
Задание.
Исходная смесь состоит из 0,30 моль/л H2 и 0,20 моль/л N2. Равновесие наступит, когда прореагирует 0,24 моль/л H2, вычислите константу равновесия (К) химической реакции 3H2(г) + N2(г) = 2NH3(г).
Решение.
Запишем выражение для константы равновесия. K = [NH3]2/[H2]3[N2]
Из условия: [H2] = 0,30 - 0,24 = 0,06.
Далее, из уравнения видно, что соотношение H2 : N2 = 3:1,
Значит, если прореагировало 0,24 моль водорода, то азота прореагировало - 0,24/3 = 0,08 моль.
[N2] = 0,2 - 0,08 = 0,12 моль/л.
Наконец,
[NH3] = 0,24*(2/3) = 0,16 моль/л.
Подставляем все числа в уравнение:
K = [NH3]2/[H2]3[N2] = 0,162/(0,063*0,12) = 987.
8.4. Равновесные концентрации.
Задание.
Исходные концентрации А и В равны 0,05моль/дм3.
Вычислите равновесные концентрации А, В, и Д в системе А + В = С + D, если равновесная концентрация С равнялась 0,01 моль/дм3. Вычислите константу равновесия.
Решение.
Т.к. в начальный момент времени С0( С) = C0(D) = 0, то равновесные концентрации веществ будут равны:
[A]= 0,04 моль/дм3
[В ] = 0,04 моль/дм3
[С] = 0,01 моль/дм3
[D]= 0,01 моль/дм3
Константа равновесия:
Kc = [С]*[D]/ ([A]*[В ]) = 0,01*0,01 / (0,04*0,04) = 6,25 * 10-2.
8.5. Константа равновесия, равновесные концентрации.
Задание.
Равновесие реакции 2NО + О2 2NО2 при некоторой температуре установилось при следующих концентрациях реагирующих веществ:
[NО] = 0,2; [О2] = 0,1; [NО2] = 0,1 моль/л.
Вычислить константу равновесия и первоначальную концентрацию окиси азота.
Решение.
Константа равновесия:
К = [NО2]2 / ([NО]2 * [О2]) = 0,12 / (0,22 * 0,1) = 2,5.
В начальный момент концентрация оксида азота (IV) была равна 0. В момент равновесия в одном литре системы образовалось 0,1 моль NO2. Из уравнения реакции видно, что на образование 0,1 моль NO2 затрачивается 0,1 моль NO. Т.о. начальная концентрация оксида азота (II) будет равна:
Со(NО) = ([NО]*V + [NО2]*V) / V = [NО] + [NО2] = 0,2 + 0,1 = 0,3 моль/л.
Задание.
Равновесие в системе CO(г) + H2O(г) = H2(г) + CO2(г) установилось при следующих концентрациях веществ, моль/л: [CO]= 1; [H2O] = 4; [H2] = [CO2] = 2. Вычислить равновесные концентрации, которые установились после повышения
концентрации CO в три раза. В каком направлении сместится равновесие?
Решение.
Определим константу равновесия.
K = [H2][CO2]/[CO][H2O] = 2*2/1*4 = 1
После повышения концентрации CO в три раза в начальный момент времени [CO]= 3 моль/л. По принципу Ле-Шателье равновесие сместится вправо, т.е. СО начнет расходоваться. Пусть его израсходовалось х моль, тогда по уравнению реакции столько же (х) израсходуется моль воды и столько же образуется моль водорода и СО2.
Отсюда:
K = (2+x)(2+x)/(3-x)(4-x) = 1
Решая, получаем: х = 0,73.
Откуда,
[CO]= 3 - 0,73 = 2,27;
[H2O] = 4 - 0,73 = 3,27;
[H2] = 2 + 0,73 = 2,73;
[CO2] = 2 + 0,73 = 2,73 моль/л.
9. Скорость химических реакций. Правило Вант-Гоффа. Закон действия масс.
Правило Вант-Гоффа:
При повышении температуры на каждые 10 градусов скорость реакции возрастает примерно в 2-4 раза.
v2 = v1*yΔt/10.
v - скорость реакции.
y (гамма) - температурный коэффициент скорости - число, характеризующее ускорение реакции при нагревании на 10 градусов.
Δt - разность температур.
Закон действия масс (ЗДМ):
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Например, для реакции aА + bВ = С, v = k*[A]a * [В]b,
k - константа скорости, [A]и [В] - концентрации реагирующих веществ, a и b - стехиометрические коэффициенты.
10.1. Зависимость скорости реакции от температуры.
Задание.
При 0 оС реакция, для которой температурный коэффициент равен 2, заканчивается за 120 сек.
Расчитайте, при какой температуре эта реакция закончится за 15 сек.?
Решение.
Скорость реакции возрастет в v2/v1 = 120/15 = 8 раз.
По уравнению Вант-Гоффа,
v2/v1 = yΔt/10.
8 = 2Δt/10, Δt/10 = 3, откуда разность температур Δt = 30 градусов.
t = 0 + Δt = 30 оС.
9.2., 9.2.1. Скорость и температурный коэффициент.
Задание 2.
За какое время закончится реакция при 30 оС, если при 10 градусах она заканчивется за 20 минут?
Температурный коэффициент равен 2.
Решение.
По уравнению Вант-Гоффа, скорость возрастет в
v2/v1 = yΔt/10 = 2 (30-10)/10 = 22 = 4 раза.
Реакция закончится за t = 20/4 = 5 минут.
Задание 2.1.
При 0 градусов Цельсия реакция заканчивается за 1 час 21 минуту, а при 40 оС за 1 минуту.
Определить температурный коэффициент реакции.
Решение.
1 час 21 минута равен 81 минутам. Отсюда, скорость возросла в v2/v1 = 81/1 = 81 раз.
Δt/10 = (40 - 0)/10 = 4.
v2/v1 = yΔt/10.
81 = y4.
y = 3.
9.3. Скорость и давление.
Задание.
Во сколько раз изменится скорость реакции 2СО(г.) + О2(г.) = 2СО2 при увеличении давления в 2 раза и неизменной температуре?
Решение.
Запишем закон действия масс для данной реакции.
w1 = k*[CO]2[O2].
Увеличение давления в 2 раза означает увеличение концентраций в 2 раза.
w2 = k*[2CO]2[2О2] = 8k*[CO]2[О2]
w2/w1 = 8k*[CO]2[О2]/k*[CO]2[О2] = 8 раз.
9.3.1.
Во сколько раз надо увеличить внешнее давление в системе, чтобы скорость реакции A(г) + 2В(г) - С(г) увеличилась в 125 раз?
Аналогично предыдущему примеру, запишем:
w1 = [A][В ]2
Пусть давление увеличилось в х раз. Тогда,
w2 = [xA][xВ]2 = x3[A][В ]2
w2/w1 = x3[A][В ]2 / [A][В ]2 = x3
По условию,
х3 = 125
х = 5
9.4. Скорость и концентрация.
Задание.
Во сколько раз уменьшится скорость реакции 2NO + O2 = 2NO2 при разбавлении смеси реагирующих газов в 3 раза?
Решение.
w1 = k*[NO]2[O2]
При разбавлении смеси реагирующих газов в 3 раза - в 3 раза падает концентрация.
w2 = k*[1/3]2[1/3] = (1/27)k*[NO]2[O2]
w2/w1 = 1/27.
То есть, уменьшится в 27 раз.
9.4.1
Задание.
Реакция идет по уравнению: А + 2B ↔ C; константа ее скорости при определенной температуре равна 0,4, а начальные концентрации составляли (моль/дм3): [А] =0,3 и [В]= 0,5. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/дм3 вещества А.
Решение.
Запишем кинетическое уравнение по Закону Действующих Масс.
v = k[A][В]2
Отсюда, в начальный момент времени v = 0,4*0,3*0,52 = 0,03
Когда прореагирует 0,1 моль/дм3 А, его концентрация станет [A]= 0,3 - 0,1 = 0,2
Концентрация В, по уравнению реакции, станет 0,5 - 0,1*2 = 0,3.
v = 0,4*0,2*0,32 = 0,0072.


 Получите свидетельство
Получите свидетельство Вход
Вход



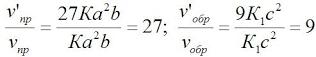
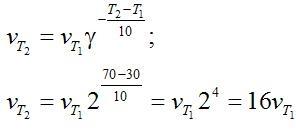
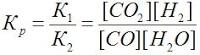
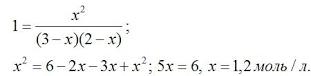









 Факторы, влияющие на скорость химической реакции (конспект) (81.34 КB)
Факторы, влияющие на скорость химической реакции (конспект) (81.34 КB)
 0
0 945
945 113
113 Нравится
0
Нравится
0




