Физика 11 класс профильный уровень.
Методическая разработка к уроку по физике по теме: Электролиз.
Цели урока:
Образовательные:
формировать такие качества знаний учащихся как системность, глубина, осознанность, гибкость межпредметных связей;
формировать способность понимания химических понятий, связей между ними и общими естественнонаучными понятиями;
учить узнавать физические и химические явления, применять знания из разных тем по физике и химии для решения задач, решать комбинированные задачи.
Развивающие:
развивать системное и творческое мышление учащихся, формировать их познавательную активность, самостоятельность и интерес к познанию природы;
преодолевать предметную инертность мышления и расширять кругозор учащихся.
Воспиттательные:
реализовывать комплексный подход к воспитанию;
повышать уровень политехнической направленности обучения.
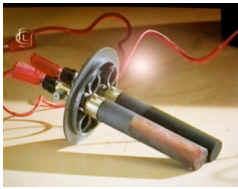
Оборудование: аппарат электролизер, гальванометр, источник постоянного электрического тока, соединительные провода.
Электролиз – совокупность процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Для осуществления электролиза к отрицательному полюсу внешнего источника тока присоединяют катод, а к положительному – анод и погружают их в электролит. При прохождении тока через электролит катионы под действием электрического поля движутся к катоду, а анионы – положительному электроду – аноду. Например, при электролизе расплава MgCl2 катионы магния, подойдя к катоду, взаимодействуют с приходящими по внешней цепи электронами, восстанавливаются:
К «-» Mg2+ + 2е- → Mg.
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются. При этом первичным процессом является окисление ионов хлора:
А «+» 2Cl- – 2е- 2Cl0 ,
а вторичным – связывание образующихся атомов хлора в молекулы 2Cl → Cl2.
Складывая уравнения электродных процессов, получим суммарное уравнение окислительно-восстановительной реакции, протекающей при электролизе расплава MgCl2:
Mg2+ + 2Cl- → Mg + Cl2.
Эта реакция не может протекать самопроизвольно, энергия необходимая для ее осуществления, поступает от внешнего источника тока. В ходе этой реакции электрическая энергия превращается в химическую.
Другими словами электролиз включает два процесса: миграцию реагирующих частиц под действием электрического поля к поверхности электрода и переход заряда с частицы на электрод или с электрода на частицу. Миграция ионов определяется их подвижностью и числами переноса. Процесс переноса нескольких электрических зарядов осуществляется, как правило, в виде последовательности одноэлектродных реакций, т.е. постадийно, с образованием промежуточных частиц (ионов или радикалов), которые некоторое время могут существовать на электроде в адсорбированном состоянии.
Скорости электродных реакций зависят от состава и концентрации электролита, материала электродов, электродного потенциала, температуры и гидродинамических условий. Мерой скорости служит плотность тока – это количество переносимых электрических зарядов через единицу площади поверхности электрода в единицу времени.
При рассмотрении электролиза водных растворов необходимо помнить, что кроме ионов электролита во всяком водном растворе есть еще ионы Н+ и ОН- - продукты диссоциации воды. В электрическом поле ионы Н+ перемещаются к катоду, а ионы ОН- к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. У анода может происходить разряд как анионов электролита, так и гидроксид ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальными затратами энергии.
Рассмотрим последовательность разряда ионов при электролизе водных растворов электролитов.
Рассмотрим электролиз раствора сульфата калия с графитовыми электродами:
K2SO4 → 2K+ + SO4 2-
(H2O)
«–» Катод ← К+ SO42- → Анод «+»
H2O H2O
φ0 K+ / K = -2,925В φ0Al+ / Al , следовательно, ионы К+ относятся 1-ой группе катионов и на катоде происходит выделение водорода:
К «-» 4Н2О +4е- → 4Н0 + 4ОН- – первичный процесс;
4Н → 2Н2 – вторичный процесс.
Анод из графита окислению не подвергаются. В растворе присутствуют ионы SO42- , которые также не будут подвергаться электрохимическому окислению. Происходит выделение кислорода:
А «+» 2Н2О – 4е- → 4Н+ – 2О- – первичный процесс;
2О → О2 – вторичный процесс.
На катоде выделится водород, а на аноде – кислород, следовательно происходит электрохимическое разложение воды. Вблизи катода образуется гидроксид калия, а вблизи анода – серная кислота.
Демонстрация электролиза водного раствора хлорида меди
Ученики наблюдают выделение чистой меди и газообразного хлора на электродах при прохождении постоянного тока через раствор.

а) уравнения электролитической диссоциации (образование ионов в растворе):
CuCl2 Cu2+ + 2Cl–
H2O = H+ + ОН–
б) восстановительные процессы на катоде (К–):
Cu2+ + 2e– = Cu0
в) окислительные процессы на аноде (А+):
2Сl– – 2e– = 2Cl0
г) суммарное уравнение электролиза:
CuCl2 + H2O = Сu + Cl2 + H2O
CuCl2 Сu2+ + 2Cl–
Из описанного выше видно, что прохождение электрического тока через электролиты сопровождается химическими превращениями вещества и выделением газообразного хлора на аноде и чистой меди – на катоде.
3) Ученик на доске под руководством учителя химии составляет уравнение электролиза водного раствора сульфата меди.
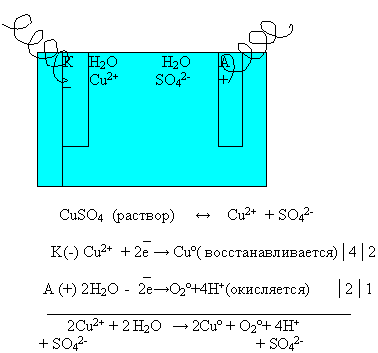
Или:
CuSO4 Cu2+ + SO2–4
H2O H+ + ОН–
б) К(–): Cu2+ + 2e– = Cuo (восстановление) | 2
в) A(+): 4ОН– – 4e– = O2 + 2H2O (окисление) | 1
Суммарное уравнение электролиза:
г) 2Cu SO4 + 2H2O = 2Сu + O2 + 2H2SO4
Законы электролиза
Связь между количеством выделившегося при электролизе вещества количеством прошедшего через электролит электричества выражается законами Фарадея.
Первый закон Фарадея: массы веществ, выделившиеся на электродах при электролизе, прямо пропорциональны количеству электричества прошедшего через электролит, т.е.
m = k · I · Δt,
где m – масса вещества, образовавшегося на электроде или у электрода, г.
k – электрохимический эквивалент вещества;
![]()
А – молярная масса вещества;
z – валентность;
F = 96487 Кл или F = 26,8 А/ч – постоянная Фарадея;
Δt – время проведения электролиза.
Второй закон Фарадея (закон эквивалентов для электрохимических реакций): одинаковые количества электричества выделяют на электродах при электролизе эквивалентные массы различных веществ:
![]() ,
,
где М – молярная масса данного вещества, образовавшегося после электролиза; I- сила тока, пропущенного через вещество или смесь веществ; Δt – время, в течении которого проводится электролиз; n –число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона, принявшего непосредственное участие в электролизе.
Отношение количества электричества (q), необходимого для выделения данной массы вещества, ко всему количеству прошедшего через электролит электричества (Q), называется выходом по току данного вещества и обычно выражается в процентах:
![]() или
или ![]()
Далее предлагается рассчитать, сколько времени будет продолжаться электролиз при силе тока I = 1A, 2A, 4А.
Из 1-го закона Фарадея: m = KI ![]()
![]() =
= ![]() = 26 . 103 c = 7,2 час.
= 26 . 103 c = 7,2 час.
При I = 2A ![]()
Учитель предлагает рассчитать расход электрической энергии.
A = I U t (кВт/час)
Далее ученикам, объединенным в малые группы (4 чел), предлагается решить по выбору пять комбинированных задач:
а) Сколько времени длилось никелирование, если на изделие осел слой никеля массой 1,8 г. Сила тока 2А. Составьте химическое уравнение электролиза.
б) Последовательно с электролитической ванной, заполненной солью никеля, включена ванна, которой находится соль хрома. После размыкания цепи в первой ванне выделилось 10 г никеля. Сколько хрома выделилось во второй ванне. Напишите уравнение электролиза.
в) Аэростат объемом 250 см3 заполняют водородом при температуре 27 oС и давлении 2 атм. Какой заряд надо пропустить при электролизе через слабый раствор серной кислоты, чтобы получить нужное количество водорода? Напишите химическое уравнение электролиза.
г) Для серебрения ложек ток 1,8А пропускался через раствор соли серебра в течение 5 ч. Катодом служит 12 ложек, каждая из которых имеет площадь поверхности 50 см3. Какой толщины слой серебра отложится на ложках? Каков расход электрической энергии, если напряжение на электролитической ванне равно 0,5В?
д) При электролизе раствора серной кислоты расходуется мощность 37Вт. Определите сопротивление электролита, если за время 50 мин выделяется 0,3 г водорода. Напишите химическое уравнение электролиза.
е) При электролизе водного раствора гидроксида калия с инертными электродами на катоде выделился молекулярный водород, объем которого при нормальных условиях равен 11,2 л. Какой объем кислорода выделится при этом на аноде?
ж) При электролизе водного раствора сульфата никеля (II) на катоде получили никель массой 177 г, выход которого составил 75%. Какой объем газа выделится при этом? Выход газа считать количественным.
ЭЛЕКТРОХИМИЧЕСКИЕ ЭКВИВАЛЕНТЫ, мг/К
Серебро 1,12
Хром 0,18
Алюминий 0,093
Никель 0,30
Кислород 0,085
Подведение итогов урока
Оценивание учащихся по решению расчетных задач.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Электролиз. Законы Фарадея для электролиза. (55.33 KB)
Электролиз. Законы Фарадея для электролиза. (55.33 KB)
 0
0 1347
1347 12
12 Нравится
0
Нравится
0



