Занятие №4.
Простые и сложные вещества.
Проверим правильности выполнения д/з.
Аr(S)=32;
Аr(O)=16;
n=Аr(S)/Аr(О)=32/16=2
Аr(S) в 2 раза больше Аr(O).
Аr(Fe)=56;
Аr(Н)=1;
n=Аr(Fe)/Аr(H)=56/1=56;
Аr(Fe) в 56 раз больше Аr(H).
Аr(P)=31;
Аr(C)=12;
n=Аr(P)/Аr(C)=31/12=2,6;
Аr(P) в 2,6 раз больше Аr(C).
Сегодня поговорим о простых и сложных веществах.
Если вещество состоит из атомов одного вида, то есть одного химического элемента, то оно называется простым.
Если вещество образовано несколькими элементами – оно сложное. Сложные вещества называют химическими соединениями.
Мы с тобой знаем много металлов: цинк, ртуть, свинец, медь, железо и т.д. Они являются простыми веществами, т.к. представляют собою совокупность атомов одного вида.
Знаем мы и такие вещества как вода H2O, сода NаНCO3, уксусная кислота CH3COOH. Это сложные вещества, так как они состоят из атомов разных химических элементов.
Есть еще известные тебе вещества: кислород O2, водород H2, сера, красный фосфор, графит. Они тоже простые по составу и являются неметаллами.
Делаем вывод: вещества бывают простыми и сложными, простые вещества делятся на металлы и неметаллы. Такую классификацию предложил еще в ХVIIIвеке А. Лавуазье.
Что нам известно о металлах?
Они твердые (кроме жидкой ртути), обладают металлическим блеском, электропроводны, теплопроводны, они ковкие, пластичные. Эти их сходные свойства зависят от их внутреннего строения, то есть кристаллической решетки. Кристаллические решетки металлов устроены следующим образом: в узлах кристаллических решеток находятся атомы и ионы этих металлов, а между ними свободно блуждают электроны, переходя от одного атома к другому.(Внимательно рассмотри рисунок 37 на стр. 55 учебника.)
Металлов известно более 80.

Неметаллов значительно меньше и они не имеют ярко-выраженных общих свойств. Неметаллы как бы проявляют яркую индивидуальность. Например, вещество бром – ярко-алая жидкость, легко превращающаяся в бурый пар, сера – твердое вещество желто-лимонного цвета, графит – твердое вещество серого цвета с характерным блеском (его ты видел в стержнях карандаша), кислород – бесцветный газ, поддерживающий горение и пригодный для дыхания.
Неметаллы заметно отличаются друг от друга.
Каково же строение неметаллов?
Часть из них состоит из атомов, соединенных друг с другом. Например, алмаз, графит, красный фосфор.
В инертных газах (гелии, неоне, аргоне, криптоне, ксеноне, радоне) атомы разъединены.
Другие неметаллы образуют молекулы. Например, кислород O2, водород H2, озон O3 и др. Поэтому они имеют молекулярное строение.
Обращаю твое внимание на два разных вещества: кислород O2 и озон O3. Оба они образованы одним и тем же химическим элементом №8, то есть Оксигеном. Не только Оксиген, но и другие элементы образуют по два и более простых веществ. Поэтому простых веществ в несколько раз больше, чем химических элементов.
Еще раз посмотрим на элементы, например, №25, №26, №29, №47, №79 в периодической системе химических элементов Д.И. Менделеева. В клеточке есть два названия. Например, Купрум и медь. Понимать это следует так: первое слово – это название химического элемента, а второе – название простого вещества, им образованного. Названия химических элементов пишем в предложении с большой буквы, а простых веществ – с маленькой.
Итак, подведем итог.
Далее подробнее поговорим о веществах сложных, то есть о химических соединениях.
Химических соединений в десятки тысяч раз больше, чем простых веществ. Химические соединения могут быть с молекулярным, атомным или ионным строением. Поэтому и свойства у них весьма разнообразны.
Вещества молекулярного строения представляют собой совокупность молекул. Например, вода, угарный и углекислый газы, сахар, крахмал, спирт, уксусная кислота и другие. Они в основном летучи, нередко имеют запах, у них низкие температуры кипения и плавления. Количество атомов в молекулах может быть от 2 штук до сотен и даже тысяч штук.
Некоторые вещества имеют атомное строение, то есть представляют собой совокупность атомов. Например, минерал кварц. Это, как правило, простые вещества. (Внимательно рассмотри рисунок 42 на стр.57 учебника.)
Существуют еще вещества ионного типа. К ним относятся поваренная соль, сода, мел, известь и другие. Эти вещества имеют кристаллическую структуру, состоящую из положительно и отрицательно заряженных ионов. Например, поваренная соль представляет собою кристалл, в узлах которого в шахматном порядке чередуются положительно заряженные ионы Натрия – и отрицательно заряженные ионы Хлора – .(Внимательно рассмотри рисунок 43 на стр.58 учебника.)
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



 Вещества
Вещества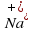 и отрицательно заряженные ионы Хлора –
и отрицательно заряженные ионы Хлора – 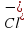 . (Внимательно рассмотри рисунок 43 на стр.58 учебника.)
. (Внимательно рассмотри рисунок 43 на стр.58 учебника.)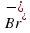 ,
, 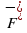 или сложным, как
или сложным, как 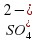 ,
, 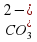 ,
, 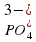 или
или 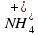 . Отрицательно заряженный ион называют анионом, положительно заряженный ион называют катионом.
. Отрицательно заряженный ион называют анионом, положительно заряженный ион называют катионом.








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 4) (34.07 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 4) (34.07 КB)
 0
0 451
451 16
16 Нравится
0
Нравится
0


