Проверка домашнего задания.
Упр. 106
а) 2Cu2O+O2=4CuO
Na2S+2HCl=2NaClS+H2S
б) 2Al+6HCl=2AlCl2+3H2
4HNO2=4NO2+O2+2H2O
Упр. 107
а) 2Cr(OH)3=Cr2O3+3H2O
2Na+2H2O =2NaOH+2NaOH+H2
б)LiH+ H2O = LiOH+H2
3Mg(OH)2+P2O5 =Mg3(PO4)2+3H2O
А сегодня мы с тобой обсудим тему “Элемент Оксиген. Простое вещество кислород”.
На предыдущих занятиях мы усвоили первоначальные понятия в химии. А теперь применим полученные знания при изучении отдельных химических элементов и их соединений. В курсе 7 класса программой предусмотрено изучение неметаллического элемента Оксигена и металлического элемента Феррума, а также простых веществ ими образованных, т.е. кислорода и железа. Итак, неметаллический элемент Оксиген и простое вещество, состоящее из атомов Оксигена, кислород. Если рассмотреть периодическую систему химических элементов Д.И. Менделеева, то можно обнаружить следующее:
- символ элемента – O;
- порядковый номер элемента – 8;
- Оксиген находится во 2-м периоде, в VI группе;
- относительная атомная масса элемента – 15,999≈ 16.
Так как номер элемента Оксигена равен 8, то в ядре его атома содержится 8 протонов. В ядре атома имеется (16–8=8) нейтронов. Оксиген образует два простых вещества, существующих в природе. Это кислород O2 и озон O3. При химических реакциях атом Оксигена легко присоединяет 2 электрона, превращаясь в ион О-2 . На нашей планете Оксиген самый распространенный элемент. Доля Оксигена в земной коре составляет 58%. Оксиген входит в состав многих органических соединений. В теле взрослого человека содержится примерно 65% Оксигена.
Важнейшее простое вещество Оксигена – это кислород. Это газ, необходимый для дыхания всего живого и поддерживающий горение. Формула кислорода О2. Молекулы О2 устойчивы, но под действием электрического разряда, ультрафиолетовых лучей и температуры более 2000ºС молекула распадается на атомы
О2→2О

Кислород является важнейшим компонентом воздуха. Его объемная доля в воздухе = 20,95 %, а массовая доля= 23,15%.
Кроме молекул О2 существует еще одна разновидность Оксигена. Это озон. Его молекула О3. Озон – газ, сильнотоксичный, с резким запахом, обесцвечивает природные красители. Однако он весьма неустойчив и легко разлагается на кислород по схеме:
2О3=3О2
Озон образует озоновый слой над поверхностью Земли, защищая ее от губительных ультрафиолетовых лучей. Озон образуется в воздухе во время грозовых разрядов.
Физические свойства О2: бесцветный газ, без вкуса и запаха, при охлаждении до
t= –183 Спревращается в голубую жидкость, при t= –219 С затвердевает, образуя синие кристаллы.
плохо растворяется в воде. Однако его достаточно в природных водоемах для дыхания рыб и других живых существ.
Кислород был открыт во второй половине XVIII века сразу несколькими учеными почти одновременно. Первым этот газ получил К.В. Шееле (шведский химик), через два года его открыл английский химик Дж. Пристли. В 1775г. французский химик А.Л. Лавуазье исследовал кислород и дал ему название.
В лаборатории кислород можно получить различными способами:
Из Гидраргирум(II) оксида при нагревании:
1. Из Гидраргирум(II) оксида при нагревании
2НgO →t2Нg+О2↑ (опыт токсичен)
2. Изкалийперманганата (марганцовки):
2KMnО4→tК2MnО4+MnO2+O2↑
3. Изкалий хлората (бертолетовой соли):
2KClO3→t,MnO22KCl+3O2↑
В данном опыте кроме нагревания используют небольшое количество Mn , который служит катализатором (ускорителем) этой реакции.
4. Из калийной или натриевой селитры:
2Na+NO3→t2NaNO2+O2↑
2KNO3→t2KNO2+O2↑
5. Из пероксида водорода (перекиси водорода):
2H2O2→2H2O+O2↑
6. При электролизе воды:
2H2O→эл.ток2H2↑+O2
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



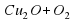 = 4CuO
= 4CuO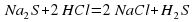
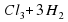
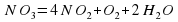
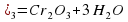
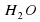 = 2NaOH +
= 2NaOH + 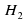
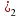 +
+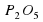 =
= 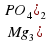 + 3
+ 3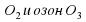 . При химических реакциях атом Оксигена легко присоединяет 2 электрона, превращаясь в ион
. При химических реакциях атом Оксигена легко присоединяет 2 электрона, превращаясь в ион 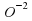 . На нашей планете Оксиген самый распространенный элемент. Доля Оксигена в земной коре составляет 58%. Оксиген входит в состав многих органических соединений. В теле взрослого человека содержится примерно 65% Оксигена.
. На нашей планете Оксиген самый распространенный элемент. Доля Оксигена в земной коре составляет 58%. Оксиген входит в состав многих органических соединений. В теле взрослого человека содержится примерно 65% Оксигена.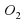 . Молекулы
. Молекулы 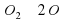
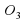 . Озон – газ, сильно токсичный, с резким запахом, обесцвечивает природные красители. Однако он весьма неустойчив и легко разлагается на кислород по схеме:
. Озон – газ, сильно токсичный, с резким запахом, обесцвечивает природные красители. Однако он весьма неустойчив и легко разлагается на кислород по схеме: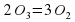 .
. С превращается в голубую жидкость, при t= –219
С превращается в голубую жидкость, при t= –219








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 12) (28.45 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 12) (28.45 КB)
 0
0 377
377 56
56 Нравится
0
Нравится
0


