Нам с тобой уже известно, что вещества могут реагировать друг с другом с образованием новых веществ за счет перегруппировки атомов, входящих в состав исходных веществ, и образуются новые вещества при химических реакциях.
Например, серавзаимодействует с кислородом с образованием сернистого газа.
Этот процесс можно записать словесно так:
сера + кислород ⇒ сернистый газ.
Можно использовать формулы веществ и тогда этот процесс можно будет записать так:
S+О2⇒SО2.
Это уже будет химическая схема реакции, поскольку в ней вместо названий веществ содержатся химические формулы.
Над стрелкой иногда можно увидеть →t или →p , или →hv, или →NaOH. t – означает температуру, p – давление, hv – квант света, NaOH – это формула вещества, при использовании которого протекает реакция. Возле в химической схеме нужно поставить ↑. Это означает, что SО2 – вещество газообразное. Если в ходе реакции образуется осадок, то мы справа возле соответствующей формулы ставим ↓.
Посмотрим еще раз на схему S+О2⇒SО. Мы видим, что до и после реакции были использованы атомы Сульфура и Оксигена. Причем их количество до реакции и после реакции одинаково. Получается, что все химические элементы во время реакции сохраняются. Атомы в ходе реакции никуда не исчезают и ниоткуда не появляются. Происходит лишь их перегруппировка в соответствии с законом сохранения массы веществ.
Закон сохранения массы веществбыл открыт в середине XVIII в. русским ученым М.В. Ломоносовым и независимо от него чуть позже французским ученымА.Л.Лавуазье.

Закон формулируется так: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Другими словами, если мы будем знать массу серы и массу кислорода, которые прореагировали между собой, то масса сернистого газа будет равна сумме их масс.
Задолго до открытия закона сохранения массы веществ в химии господствовала ошибочная теория о флогистоне. Многие ученые заметили, что при прокаливании (т.е. длительном нагревании) металлов масса их увеличивалась. Ученые считали, что “нечто” из огня присоединяется к металлам и приводит к увеличению их массы. Но если металл прокаливать в плотно закрытом сосуде, например, реторте, то масса при этом не меняется.
Ученые проводили опыты по прокаливанию металлов, чаще всего ртути. Помещали ртуть в сосуд. Взвешивали сосуд с ртутью до начала прокаливания и после. Масса сосуда с металлом увеличивалась. Считалось, что к металлу присоединяется флогистон.
Вот этот факт и объяснил М.В. Ломоносов. Масса металла в запаянной реторте не изменяется после длительного нагревания. А если этот металл прокаливать в открытом сосуде, то его масса увеличится. Теперь каждый школьник может объяснить, почему так происходит. Оказывается, что к металлу присоединяется определенная порция кислорода из воздуха, если у него есть доступ к металлу, а не флогистон, который в природе не существует. В закрытом сосуде масса прокаливаемого металла не меняется.
Рассмотрим пример. Известно, что между собой прореагировали железо и сера массой соответственно 56 г и 32 г. Определить массу продукта реакции FeS.
Fe + S = FeS
56г 32гxг
x=56г + 32г = 88г
Ответ: Масса FeS равна 88г.
В соответствии с законом сохранения массы веществ химики составляют уравнения химических реакций, но о них мы поговорим в следующий раз.
Домашнее задание на следующий раз: определить массу цинка, вступившего в реакцию с 64 граммами серы,если масса полученного сульфида цинка равна 194 грамма.

 Получите свидетельство
Получите свидетельство Вход
Вход



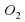
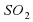 .
.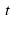 или
или 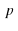 , или
, или 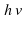 , или
, или 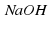 . t – означает температуру, p – давление,
. t – означает температуру, p – давление, 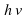 – квант света, NaOH – это формула вещества, при использовании которого протекает реакция. Возле
– квант света, NaOH – это формула вещества, при использовании которого протекает реакция. Возле 








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 10) (18.87 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 10) (18.87 КB)
 0
0 1711
1711 19
19 Нравится
0
Нравится
0


