
АЗОТ

НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии (смотри таблицу)
Природная форма
Оболочка Земли
Соли аммония и азотной кислоты
в составе нитратов почвы - 0,1%
литосфера, гидросфера
Азот - 4 x 10 23 по массе
атмосфера
Азот и аммиак вулканов - 1,9 x 10 -3 по массе
литосфера
Соединения в некоторых видах топлива (нефть, уголь)
литосфера
Нуклеиновые кислоты, белковые вещества - 0,3% по массе
биосфера
Строение и свойства атома
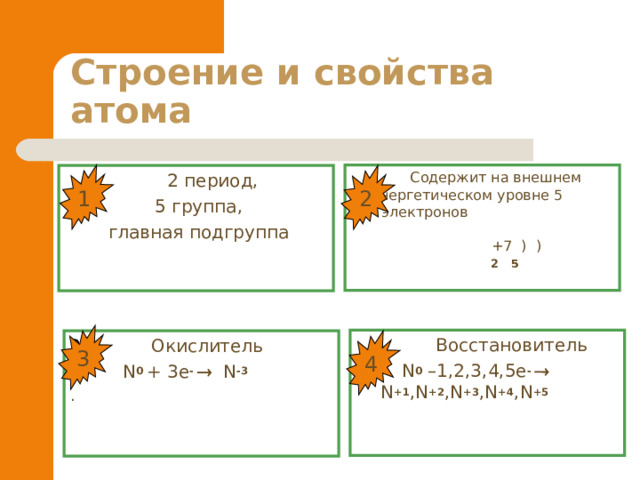
Содержит на внешнем энергетическом уровне 5 электронов +7 ) )
2 5
1
2
2 период,
5 группа ,
главная подгруппа
3
Восстановитель
N 0 –1,2,3,4,5e - N +1 ,N +2 ,N +3 ,N +4 ,N +5
- Окислитель
- N 0 + 3e - N -3
.
4
СТРОЕНИЕ МОЛЕКУЛЫ
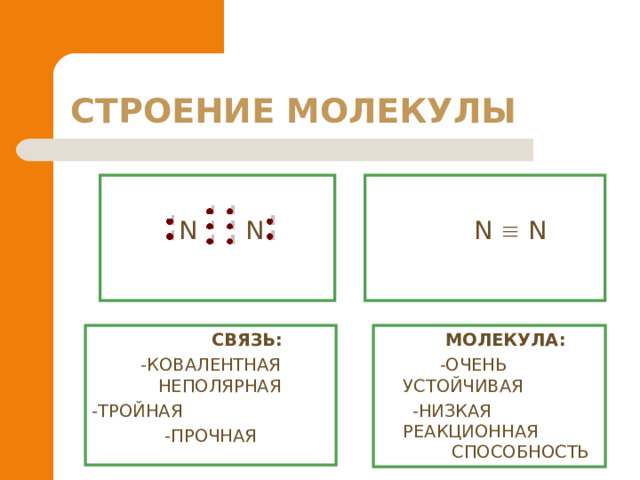
N N
N N
СВЯЗЬ :
-КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ
-ТРОЙНАЯ
-ПРОЧНАЯ
МОЛЕКУЛА :
-ОЧЕНЬ УСТОЙЧИВАЯ
-НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ

ФИЗИЧЕСКИЕ СВОЙСТВА
- Газ без цвета, запаха и вкуса
- Плохо растворим в воде
- Немного легче воздуха
- T º пл.= -210 º С
- Tº кип.= -196 º С

ХИМИЧЕСКИЕ СВОЙСТВА
- N 2 + O 2
- N 2 + H 2
- N 2 + Mg
ПРИ ОБЫЧНЫХ УСЛОВИЯХ ВЗАИ M ОДЕЙСТВУЕТ ТОЛЬКО С ЛИТИЕМ

ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ
Применение
- Получение аммиака и азотной кислоты;
- Создание инертной среды;
- Создание низких температур;
- Насыщение поверхности стали для повышения прочности;
- Жидкий Азот в медицине;
- Производство минеральных удобрений;
- Получение
- В промышленности – из жидкого воздуха;
- В лаборатории – разложением неустойчивых соединений азота

 Получите свидетельство
Получите свидетельство Вход
Вход












 "АЗОТ" презентация к уроку химии в 9 классе (294 KB)
"АЗОТ" презентация к уроку химии в 9 классе (294 KB)
 0
0 520
520 27
27 Нравится
0
Нравится
0


