Атомы металлов имеют ряд особенностей:
· На внешнем слое у них от одного до трёх электронов;
· У них сравнительно большие радиусы атомов;
· Атомы металлов имеют достаточное количество свободных орбиталей.

Например, у атома натрия один электрон на третьем энергетическом уровне. А на третьем энергетическом уровне всего девять орбиталей (одна эс, три пэ и пять дэ орбиталей).

Когда атомы металлов сближаются, то их свободные орбитали перекрываются и валентные электроны одного атома могут перемещаться на свободные орбитали другого атома. При этом, в кристалле металла постоянно идут два противоположных процесса: атом, который отдал электроны превращается в катион, а свободные электроны при этом, притягиваясь к положительным ионам металлов вновь превращают их в нейтральные атомы.
Поэтому в металлах постоянно идёт превращение атомов в ионы и наоборот, а частицы, из которых состоят кристаллы металла, называют атом-ионами.

Поэтому в узлах кристаллической решётки металлов находятся как нейтральные атомы, так и катионы металла. Образовавшиеся при этом электроны перемещаются внутри кристалла металла и являются общими для всех атомов и ионов металла, связывая их между собой.
Таким образом, металлическая связь – это химическая связь, между атомами в металлическом кристалле посредством обобществления валентных электронов.
Металлическая связь характерная для металлов и сплавов и объясняет ряд физических свойств металлов: ковкость, пластичность, тепло- и электропроводность металлов, металлический блеск.

Особенностью этой химической связи является то, что она не имеет направленности в пространстве, она является коллективной, как и ионная, потому что в ней принимают участие все атомы металла.

Сходство металлической связи с ковалентной заключается в том, что при её образовании электроны обобществляются, но в металлической связи эти электроны связывают все атомы металла в кристалле, а в ковалентной связи связываются только находящиеся рядом атомы.
Водородная связь осуществляется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Причем, чаще всего отрицательно заряженным атомом являются наиболее электроотрицательные элементы: фтор, кислород, азот, реже хлор и сера.

Схематично водородную связь показывают тремя точками. Образование водородной связи объясняется электростатическим взаимодействием между молекулами. При этом возникает донорно-акцэпторное взаимодействие свободной орбитали атома водорода и орбитали с неподелённой парой электронов электроотрицательного атома. Из-за этого, водородная связь обладает направленностью.

Благодаря водородной связи молекулы объединяются в ассоциаты, как, например, димеры уксусной кислоты.

Водородные связи также определяют кристаллическую структуру льда, в которой каждый атом кислорода связан с четырьмя атомами водорода – двумя ковалентными и двумя водородными связями.
Кристаллическая структура льда

Водородная связь объясняет такое алхимическое правило, как «подобное растворяется в подобном», когда возникают связи между молекулами растворителя и молекулами растворённого вещества. Вещества метиловый спирт, этанол, уксусная кислота, этиленгликоль, глицерин неограниченно растворимы в воде.
Водородная связь в молекуле аммиака обуславливает его возможность легко сжижаться и вновь переходить в газообразное состояние с поглощением теплоты. Поэтому аммиак используют как хладагент в холодильных установках.
Водородная связь слабее ковалентной, поэтому она характерна для веществ в твёрдом и жидком состояниях.
Некоторые аномальные свойства веществ объясняются наличием водородной связи. Например, высокие температуры кипения воды, фтороводорода и аммиака по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов, объясняются образованием ассоциатов за счёт водородных связей.

Водородная связь наиболее распространена в природе. Эта связь объясняет аномальные свойства воды, такие как высокие температуры кипения и плавления, высокую теплоёмкость и диэлектрическую проницаемость. Благодаря своей структуре лёд имеет меньшую плотность, чем жидкая вода, поэтому лёд находится на поверхности воды и глубокие водоёмы не промерзают до дна.

Светло-голубой цвет чистой воды и толстого льда также обусловлен водородными связями. Ещё водородная связь объясняет образование кристаллов в виде изморози и снежинок.
Водородная связь возникает и между атомами одной молекулы. Это так называемая внутримолекулярная водородная связь. Она возникает в молекулах органических веществ, которые имеют группы атомов: о-аш, эн-аш, эн-аш-два и другие.
Внутримолекулярная водородная связь

Водородная связь характерна для большинства органических соединений, например, для белков, нуклеиновых кислот. Вторичная структура молекулы ДНК объясняется наличием внутримолекулярной водородной связи. Благодаря ей полипептидная цепь закручена в спираль, и её витки удерживаются от раскручивания.

Но водородная связь непрочная, поэтому белки разрушаются – денатурируют. Денатурация может быть обратимой и необратимой.

Обратимая денатурация белков обусловлена влиянием механического воздействия. Например, многие работники шахт, дорожных служб, горняки, стекловары, металлурги, врачи-рентгенологи, работники химических производств постоянно подвергаются какому-то механическому воздействию. Поэтому для компенсации вредного воздействия условий труда на организм, им предоставляются определённые льготы.
Необратимую денатурацию вы можете наблюдать при варке яиц, мяса, рыбы и других белковых продуктов. Например, если к раствору куриного яйца прилить этилового спирта или соли тяжёлого металла, то можно будет наблюдать выпадение осадка вследствие денатурации белка. Аналогичным действие обладает и никотин, который воздействует на белковые молекулы.
Денатурацию белка вызывает этиловый спирт, соли тяжёлых металлов.

Таким образом, молекулы могут взаимодействовать между собой и это взаимодействие называется межмолекулярным.
Силы, которые обеспечивают это взаимодействие, называются ван-дэр-ваальсовыми, в честь голландского учёного Ван-дэр-Ваальса.
Межмолекулярное взаимодействие, как и химическая связь, имеет электростатическую природу.
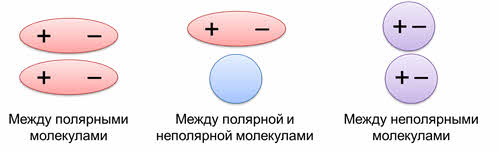
В молекуле возникают противоположные полюса: положительные, где электронная плотность понижена и отрицательные полюса, где электронная плотность повышена. Образовавшиеся полярные молекулы притягиваются друг к другу.
Это межмолекулярное взаимодействие может осуществляться между полярными молекулами, между полярными и неполярными молекулами, а также между неполярными молекулами.
Межмолекулярное взаимодействие объясняет переход вещества из газообразного в жидкое, а затем и в твёрдое. Межмолекулярное взаимодействие слабее, чем ковалентная связь, поэтому связи между молекулами непрочные и легко разрываются. Из-за этого, молекулярные вещества плавятся и кипят при низких температурах.
Энергия межмолекулярного взаимодействия зависит от полярности молекулы и её размера.

Чем сильнее межмолекулярное взаимодействие, тем выше у вещества температуры кипения и плавления. Например, кислород из-за более прочного межмолекулярного взаимодействия кипит при более высокой температуре, чем азот. Углеводороды с большей молярной массой кипят при более высокой температуре, чем низкомолекулярные углеводороды.
Межмолекулярные связи возникают между молекулами в молекулярной кристаллической решётке.
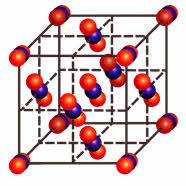
Например, молекулярные кристаллические решётки имеют: водород, азот, кислород, сера, йод, вода, углекислый газ, благородные газы и многие органические вещества.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления и кипения, небольшая твёрдость и лёгкая сжижаемость.
Нагревание некоторых молекулярных кристаллов, как йода, углекислого газа, приводит к переходу вещества из твёрдого состояния в газообразное, минуя жидкую фазу. Этот процесс называется возгонкой, или сублимацией.

Многие органические вещества вообще не плавятся, потому что прочность связей между молекулами в сумме оказывается выше прочности связей внутри молекулы.

Если попробовать расплавить такие вещества, как крахмал, цэллюлоза или вата, то они начнут разрушать раньше, чем плавиться.
Реакционная способность молекулярных веществ зависит от прочности внутримолекулярных связей, потому что при химическом взаимодействии разрываются внутримолекулярные связи. Парафин – непрочное вещество, связи между молекулами слабые, но это вещество химически устойчиво.
Таким образом, металлическая связь осуществляется за счёт обобществления электронов, межмолекулярное взаимодействие осуществляется между любыми молекулами и объясняет переход вещества из газообразного в жидкое, а затем в твёрдое. Водородная связь осуществляется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.

 Получите свидетельство
Получите свидетельство Вход
Вход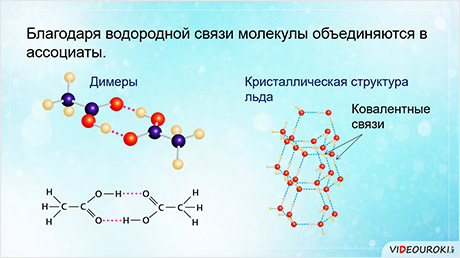




 8081
8081

