Положение металлов в Периодической системе, особенности строения их атомов, физические свойства.
Большинство химических элементов в Периодической системе относится к металлам, они располагаются по диагонали от бора к астату. К металлам относятся девяноста два химических элемента.
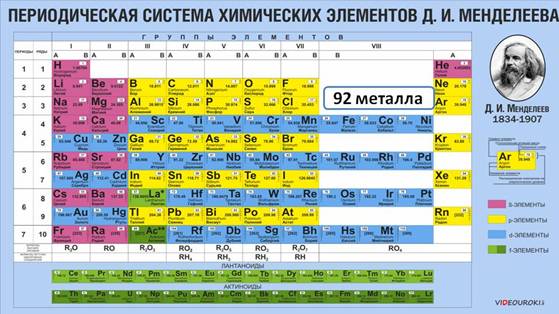
Каждый период (кроме первого) начинается металлом. Так, металлы IA группы называются щелочными металлами. К ним относятся: Li, Na, K, Rb, Cs, Fr. Своё название они получили благодаря соответствующим гидроксидам, которые называются щелочами, т.е. растворимыми в воде основаниями. Щелочные металлы имеют на внешнем энергетическом уровне только один электрон, который они легко отдают, при этом проявляют восстановительные свойства.
Ме0 – ē → Ме+
Причём восстановительные свойства в этой группе увеличиваются от лития к францию, как и радиусы атомов, поэтому растёт и способность к отдаче внешнего электрона. Химическая активность щелочных металлов по группе сверху вниз тоже увеличивается.
Металлы IIA группы также являются типичными металлами и сильными восстановителями, так как в реакциях они отдают два своих электрона.
Ме0 – 2ē → Ме2+
Кальций, стронций и барий называют щелочноземельными элементами, потому что их оксиды, которые раньше называли «землями» при растворении в воде образуют щёлочи.
К металлам относятся и элементы IIIA группы кроме бора. У этих металлов на внешнем энергетическом уровне находится три электрона, которые они отдают и превращаются в ионы.
Ме0 – 3ē → Ме3+
В IVA группе к металлам относятся германий, олово, свинец, в VA группе металлами являются сурьма и висмут, в VIA группе – полоний, а в VIIA и VIIIA группе все элементы являются неметаллами.
Элементы побочных подгрупп все являются металлами. Их отличительной особенностью является то, что на внешнем уровне у них обычно содержится один или два электрона, остальные валентные электроны располагаются на предвнешнем слое. К металлам относятся и лантаниды, и актиниды, которые обычно располагаются ниже основной таблицы.
Запомните:
· у металлов сравнительно большие радиусы атомов
· их внешние электроны значительно удалены от ядра и слабо с ним связаны
· Атомы металлов содержат на внешнем уровне от одного до трех электронов
· легко отдают электроны, превращаясь при этом в положительные ионы
· являются восстановителями
· Металлы не могут присоединять электроны.
Однако деление элементов на металлы и неметаллы условно.
Например, аллотропные модификации олова: так серое, или α-олово – неметалл, а белое, или β-олово – металл.

Такая модификация углерода, как алмаз – это неметалл, а графит имеет некоторые характерные свойства металлов.

Такие металлы, как цинк, хром, алюминий и другие – типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. А теллур и йод – типичные неметаллы, но обладают некоторыми свойствами, характерными для металлов.
Физические свойства металлов.
Для металлов характерна металлическая химическая связь. В узлах кристаллической решётки располагаются атомы и положительные ионы металлов, которые связаны благодаря обобществлению внешних электронов, которые принадлежат всему кристаллу.

Для всех металлов характерно твёрдое агрегатное состояние, исключение
составляет ртуть – она жидкая.

Для большинства металлов характерен белый или серый цвет, только золото окрашено в желтый цвет, а медь в желто-красный.


Au Cu
Во-первых, для металлов характерна пластичность, которая проявляется в их ковкости, то есть они способны изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия. Из-за этого, металлы способны расплющиваться от удара или вытягиваться в проволоку. Эти свойства используют кузнецы. При этом слои смещаются относительно друг друга, но связь сохраняется благодаря «свободным» электронам.





Наиболее пластичными являются золото, серебро, медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий.


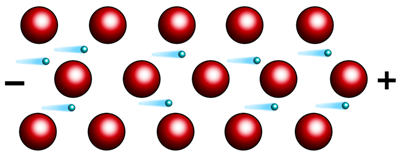
Второе свойство металлов – это электропроводность. Оно обусловлено присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются по действием электрического поля.

При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. А вот при охлаждении, электропроводность металлов усиливается, и близи абсолютного нуля переходят в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, а наименьшую – марганец, свинец, ртуть и вольфрам.
Наличие свободных электронов в металлах объясняет и такое их свойство, как электро- и теплопроводность. Лучшими проводниками электрического тока являются: серебро, медь, золото, алюминий.
Третье физическое свойство металлов – это теплопроводность, это свойство тоже связано с высокой подвижностью свободных электронов.
Четвёртое свойство – металлический блеск связано с отражение световых лучей. Металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и электроны начинают испускать свое излучение, которое мы воспринимаем как металлический блеск. Палладий, ртуть, серебро и медь лучше других отражают свет.

В порошкообразном состоянии большинство металлов теряет блеск, приобретая серую или чёрную окраску, но только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия изготавливают зеркала, в том числе и те, которые используются в прожекторах.


Самые твёрдые металлы – это металлы побочной подгруппы VIA группы. Например, хром по твёрдости напоминает алмаз. Наиболее твёрдыми ещё являются титан и молибден. Самые мягкие – щелочные металлы, например, натрий и калий легко режутся ножом.


По плотности различают легкие металлы, у которых плотность меньше 5 г/см3. К таким относятся щелочные и щелочноземельные металлы и алюминий. Из переходных металлов к ним относятся скандий, иттрий и титан. Они имеют большое значение в технике благодаря своей лёгкости и тугоплавкости.


Тяжелыми считаются металлы, у которых плотность больше 5 г/см3. Самым тяжелым является осмий, а самым лёгким – литий.

По температуре плавления металлы делятся на легкоплавкие, у которых эта температура меньше 1000 0С, и тугоплавкие, у которых она больше 1000 0С. Самым легкоплавким металлом является ртуть, а самым тугоплавким – вольфрам, из которого изготавливают нити накаливания для ламп. Кроме того, в конструкцию лампы входит ещё восемь металлов.

Лёгкие металлы, как правило, являются легкоплавкими, например, галлий может
плавиться уже на ладони руки, а тяжёлые металлы, напротив, являются
тугоплавкими.
Ряд государств, приняло решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например, галогенные, люминесцентные и светодиодные. Галогенная лампа – это тоже лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или йода).

Люминесцентные лампы – это лампы дневного света, но они содержат ртуть, поэтому нуждаются в особом способе утилизации.

Светодиодные лампы – самые экономичные и долговечные (срок работы до 100 тыс. ч), но и самые дорогие из ламп.

В технике металлы делятся на чёрные – это железо и его сплавы и цветные – это все остальные.


Золото, серебро и платину, и некоторые другие металлы относят к драгоценным металлам.

Таким образом, следует запомнить, что большинство элементов в Периодической системе относятся к металлам, для металлов характерна металлическая кристаллическая решётка и металлическая химическая связь, которая обуславливает такие физические свойства металлов, как твёрдость, металлический блеск, ковкость и пластичность, тепло и – электропроводность. У металлов на внешнем энергетическом уровне от 1 до 3 электронов, поэтому они отдают свои электроны и проявляют восстановительные свойства.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 17215
17215

