«Учитесь у вчера, живите сегодня,
надейтесь на завтра. Главное —
не прекращать задавать вопросы...
Никогда не теряйте священной
любознательности»
Альберт Эйнштейн
В данной теме разговор пойдёт о протонно-нейтронной модели ядра атома. Выясним физический смысл зарядового и массового чисел. А также узнаем, что такое изотопы.
Ранее говорилось о том, что атом любого химического элемента состоит из ядра, вокруг которого движутся электроны. При этом атом в целом электрически нейтрален.
После создания ядерной модели атома вопрос о составе атомного ядра стал одним из основных в ядерной физике. Из чего состоит атомное ядро? Какие силы удерживают составные части ядра возле друг друга? Какие превращения ядер возможны?
Ответы на эти вопросы физика смогла дать только по мере накопления сведений о различных свойствах ядер, в особенности сведений о заряде и массе ядра.
В 1913 году Эрнест Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав атомных ядер всех химических элементов, является ядро атома водорода. Основанием для такого предположения послужил ряд появившихся к тому времени фактов, полученных опытным путем. В частности, было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз (т. е. кратны ей).
В 1919 г. Резерфорд поставил опыт по исследованию взаимодействия a-частиц с ядрами атомов азота. В этом опыте a-частица, летящая с огромной скоростью, при попадании в ядро атома азота выбивала из него какую-то частицу. По предположению Резерфорда, этой частицей было ядро атома водорода, которое Резерфорд назвал протоном (от греческого слова протос — первый). Но поскольку наблюдение этих частиц велось методом сцинтилляций, то нельзя было точно определить, какая именно частица вылетала из ядра атома азота.
Удостовериться в том, что из ядра атома действительно вылетал протон, удалось только несколько лет спустя, когда реакция взаимодействия a-частиц с ядром атома азота была проведена в камере Вильсона.

На фотографии видны расходящиеся веером прямые линии. Это следы a-частиц, которые пролетели сквозь пространство камеры, не испытав соударений с ядрами атомов азота. Но след одной a-частицы раздваивается, образуя так называемую «вилку». Это означает, что в точке раздвоения трека произошло взаимодействие a-частицы с ядром атома азота, в результате чего образовались ядра атомов кислорода и водорода. То, что образуются именно эти ядра, было выяснено по характеру искривления треков при помещении камеры Вильсона в магнитное поле.
Рассмотрим, как записывают реакцию взаимодействия ядра азота с a-частицами с образованием ядер кислорода и водорода.
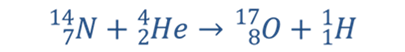
Где
символом 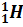 обозначен
протон, т. е. ядро атома водорода, с массой,
приблизительно равной 1 атомной единице массы и положительным зарядом, равным
элементарному (т. е. модулю заряда электрона). Для обозначения протона
используют также символ
обозначен
протон, т. е. ядро атома водорода, с массой,
приблизительно равной 1 атомной единице массы и положительным зарядом, равным
элементарному (т. е. модулю заряда электрона). Для обозначения протона
используют также символ 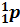 .
.
В дальнейшем было исследовано взаимодействие a-частиц с ядрами атомов других элементов: бора, натрия, алюминия, магния и многих других. В результате выяснилось, что из всех этих ядер a-частицы выбивали протоны. Это давало основания полагать, что протоны входят в состав ядер атомов всех химических элементов.
Открытие протона не давало полного ответа на вопрос о том, из каких частиц состоят ядра атомов. Если считать, что атомные ядра состоят только из протонов, то возникает противоречие. Покажем на примере ядра атома бериллия, в чем заключается это противоречие.
Допустим, что ядро бериллия состоит только из протонов. Поскольку заряд каждого протона равен одному элементарному заряду, то число протонов в ядре должно быть равно зарядовому числу, в данном случае четырем. Но если бы ядро бериллия действительно состояло только из четырех протонов, то его масса была бы приблизительно равна 4 атомные единицы массы. Однако это противоречит опытным данным, согласно которым масса ядра атома бериллия приблизительно равна 9 атомным единицам массы. Таким образом, становится ясно, что в ядра атомов помимо протонов входят еще какие-то частицы.
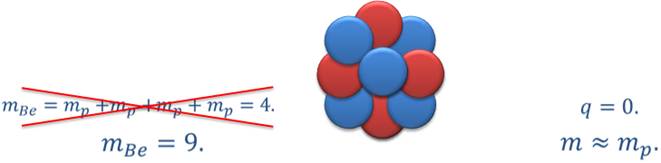
В связи с этим в 1920 г. Резерфордом было высказано предположение о существовании электрически нейтральной частицы с массой, приблизительно равной массе протона.
В начале 30-х гг. XX века немецкие физики Вальтер Бjте и Герберт Бекер заметили, что два легких элемента — литий и бериллий — не испускают протонов под действием a-частиц. Они также обнаружили, что при этой реакции возникает новое неизвестное излучение. Это излучение не могли задержать самые мощные экраны, полностью поглощавшие проникающие гамма-лучи.
Изучением нового вида излучения занялся английский физик Джеймс Чедвик. Он доказал, что излучение возникающее в реакции с бериллием, может выбивать из парафина протоны, а также ядра гелия из атомов лития, бериллия, бора и т.д.
В 1932 году Чедвик с помощью опытов, проведенных в камере Вильсона, доказал, что бериллиевое излучение представляет собой поток электрически нейтральных частиц, масса которых приблизительно равна массе протона. Отсутствие у исследуемых частиц электрического заряда следовало, в частности, из того, что они не отклонялись ни в электрическом, ни в магнитном поле. А массу частиц удалось оценить по их взаимодействию с другими частицами.
Эти
частицы были названы нейтронами. Нейтрон принято
обозначать символом 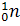 .
Точные измерения показали, что масса нейтрона чуть больше массы протона. Во
многих случаях массу нейтрона (как и массу протона) считают равной 1 атомной
единице массы. Поэтому вверху перед символом нейтрона ставят единицу. Ноль
внизу означает отсутствие электрического заряда.
.
Точные измерения показали, что масса нейтрона чуть больше массы протона. Во
многих случаях массу нейтрона (как и массу протона) считают равной 1 атомной
единице массы. Поэтому вверху перед символом нейтрона ставят единицу. Ноль
внизу означает отсутствие электрического заряда.
Открытие нейтрона дало толчок к пониманию того, как устроены ядра атомов. В том же 1932 году, когда был открыт нейтрон, советским физиком Дмитрием Дмитриевичем Иваненко и немецким физиком Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядер, справедливость которой была впоследствии подтверждена экспериментально.
По этой теории все ядра состоят из двух видов частиц — протонов и нейтронов. Протоны и нейтроны называются нуклонами (от латинского нуклеус — ядро).
Общее число нуклонов в ядре называется массовым числом и обозначается буквой А.
Массовое число ставится вверху перед буквенным обозначением химического элемента. Так, например, для азота массовое число равно 14, для фтора—19.
Массовое число численно равно массе ядра, выраженной в атомных единицах массы и округленной до целых чисел (поскольку масса каждого нуклона примерно равна одной атомной единице массы).
Число протонов в ядре называется зарядовым числом и обозначается буквой Z. Например, для азота зарядовое число равно 7, для фтора—9. Как видно из приведенных примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Заряд каждого протона равен элементарному электрическому заряду. Поэтому зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах. Для каждого химического элемента зарядовое число равно порядковому номеру в таблице Менделеева.
Так как атом в целом электрически нейтрален, то зарядовое число определяет одновременно и число электронов в атоме.
Ядро любого химического элемента в общем виде обозначается так:
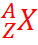
Число нейтронов в ядре обычно обозначают буквой N. Поскольку массовое число представляет собой общее число протонов и нейтронов в ядре, то число нейтронов можно определить как разность между массовым числом и зарядовым.

На основе протонно-нейтронной модели строения атомных ядер было дано объяснение интересным экспериментальным фактам, открытым в первые два десятилетия XX века.
В это время многие ученые занимались исследованием свойств радиоактивных элементов. При изучении радиоактивных превращений было установлено, что существуют химические элементы, атомы которых обладают одинаковыми химическими свойствами, но распадаются по-разному.Отделить эти атомы друг от друга было невозможно никакими химическими методами. В 1911 году Фредерик Содди предложил называть такие разновидности атомов одного и того же химического элемента изотопами (что по-гречески означает «равноместные»), так как по своим химическим свойствам они должны быть помещены в одну и ту же клетку таблицы Менделеева.
При исследованиях, проведенных с помощью масс спектрографов, было установлено, что изотопы одного и того же химического элемента обладают различной массой, причем массы изотопов лишь незначительно отличаются от целых чисел.
Так, например, было найдено несколько разновидностей атомов урана: с массами ядер, приблизительно равными 234, 235, 238 и 239 атомных единиц массы. Причем все эти атомы обладали одинаковыми химическими свойствами. Они одинаковым образом вступали в химические реакции, образуя одни и те же соединения.

Наличие одних и тех же химических свойств означает, что все эти атомы имеют одинаковое число электронов в электронной оболочке, а значит, и одинаковые заряды ядер.
Следовательно, изотопами являются атомы с одинаковым зарядовым числом, но различными массовыми числами.
Благодаря созданию протонно-нейтронной модели ядра (т. е. примерно через два десятилетия после открытия изотопов), удалось объяснить, почему атомные ядра с одним и тем же зарядом обладают разными массами. Очевидно, ядра атомов изотопов содержат одинаковое число протонов, но различное число нейтронов. Поясним это на примере изотопов водорода.
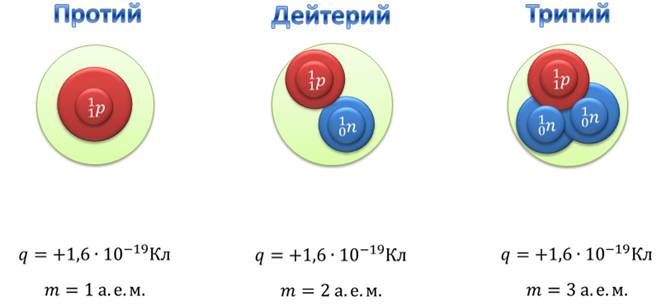
Существует три изотопа водорода: протий, дейтерий и тритий. Ядро изотопа протия вообще не имеет нейтронов — оно представляет собой один протон. Соответственно его заряд равен элементарному электрическому заряду, а масса приблизительно равна 1 атомной единице массы. В состав ядра дейтерия входят две частицы: протон и нейтрон. Поэтому масса дейтерия приблизительно равна двум атомным единицам массы. Ядро трития состоит из трех частиц: одного протона и двух нейтронов. Поэтому масса трития приблизительно равна трём атомным единицам массы.
В настоящее время известно, что изотопы имеются у всех химических элементов. Например, у урана имеется 26 изотопов, у технеция — 34, у прометия — 38.
Различаются изотопы стабильные, сохраняющиеся неизменными сколь угодно долго, и нестабильные, которые со временем превращаются в ядра других химических элементов.
Существование изотопов является причиной того, что относительные атомные массы большинства химических элементов в таблице Д. И. Менделеева выражены дробным числом. Поскольку химические элементы обычно состоят из смеси нескольких изотопов, то приходится указывать среднее значение массы ядер атомов всех изотопов данного элемента. А это среднее значение чаще всего оказывается дробным числом. Например, у хлора два стабильных изотопа с атомными массами 35 и 37, относительное содержание которых 75 и 25%. Поэтому, среднее значение массы атома элемента хлораравно 35,5 атомных единиц массы.
Основные выводы:
– После открытия протона и нейтрона советским физиком Дмитрием Дмитриевичем Иваненко и немецким физиком Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядер, согласно которой все ядра химических элементов состоят из двух видов частиц — протонов и нейтронов.
– Протоны и нейтроны называются нуклонами.
– Общее число нуклонов в ядре называется массовым числом.
– Массовое число численно равно массе ядра, выраженной в атомных единицах массы и округленной до целых чисел.
– Число протонов в ядре называется зарядовым числом.
– Зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах.
– Изотопы — это разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 7503
7503

