Химические реакции. Скорость химической реакции
Что же такое химическая реакция? Представьте, химическая реакция (от лат. реакция – противодействие, отпор) – это какое-то ответное действие веществ на воздействие других веществ и физических факторов: температуры, давления, излучения и т.д. При химических реакциях обязательно разрушаются одни химические связи и возникают новые, поэтому из одних веществ образуются новые.
Химические реакции протекают как внутри нас, так и в окружающем мире.

Давайте вспомним, какие же мы знаем признаки классификации химических реакций.
По числу и составу исходных веществ и продуктов, реакции делятся на:
· реакции соединения
· разложения
· замещения
· обмена
К реакциям соединения относятся реакции, в результате которых из двух или нескольких простых или сложных веществ образуется одно сложное.
Например, в реакции магния с кислородом образуется оксид магния. Эта реакция сопровождаются выделением света и тепла. Поэтому её ещё называют реакцией горения.

2Mg + O2 = 2MgO
В реакцию соединения могут вступать и два сложных вещества с образованием одного сложного. Например, в реакции двух сложных веществ оксида кальция с водой образуется новое сложное вещество – гидроксид кальция.

СаО + Н2О = Са(ОН)2
К реакциям разложения относятся реакции, в результате которых из одного сложного вещества образуется два или более новых веществ.
Например, реакция разложения оксида ртути (II). В результате этой реакции образуется ртуть и кислород. Или, например, при разложении воды в электролизёре образуется кислород и водород.

2HgO = 2Hg + O2


2Н2О = 2Н2 + О2
К реакциям замещения относятся реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе, при этом образуется новое простое и новое сложное вещество.
К реакциям замещения относятся реакции взаимодействия металлов с кислотами и металлов с солями. Так, в реакции цинка с серной кислотой образуется новое сложное вещество – сульфат цинка и выделяется газ водород (новое простое вещество).

Zn + H2SO4 = ZnSO4 + H2↑
Или, как в реакции меди с раствором нитрата серебра (I) атомы меди замещают атомы серебра в сложном веществе, и образуется новое сложное вещество – нитрат меди (II) и новое простое – серебро.
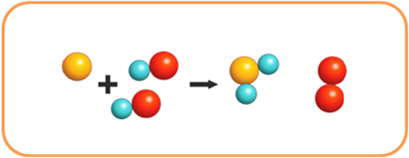
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
В реакциях обмена обязательно участвуют два сложных вещества, которые обмениваются своими составными частями.
Так, в реакции сульфата натрия с хлоридом бария образуется две новые соли – хлорид натрия и сульфат бария.

Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
По признаку выделения теплоты реакции делятся на:
· экзотермические
· эндотермические
Если реакции протекают с выделением теплоты, то такие реакции называются экзотермическими
Если реакции протекает с поглощением теплоты, то их называют эндотермическими.
К экзотермическим реакциям относится реакция горения магния, а реакция разложения ртути является эндотермической.
2Mg + O2 = 2MgO + Q
2HgO = 2Hg + O2 – Q
По признаку обратимости реакции делятся на:
· обратимые
· необратимые
Обратимые реакции всегда протекают одновременно в двух противоположных направлениях, как реакция получения аммиака их двух простых веществ – азота и водорода. В этих реакциях вместо знака равенства ставится знак обратимости.
N2 + 3H2 ↔ 2NH3
Необратимые реакции идут до конца, т.е. в результате этих реакций образуется газ, осадок или слабый электролит. Например, в реакции соляной кислоты и карбоната калия образуется углекислый газ и вода, т.е. реакция прошла до конца.
2HCl + K2CO3 = 2KCl + CO2↑ + H2O
По признаку участия катализатора реакции делятся на:
· каталитические
· некаталитические
Каталитические реакции – это реакции, протекающие с участием катализатора. Например, реакция получения оксида серы (VI) из оксида серы (IV) является каталитической, т.к. необходимым условием её протекания является наличие катализатора оксида ванадия (V).

По признаку изменения степени окисления реакции делятся на:
· реакции, протекающие без изменения степени окисления
· реакции, протекающие с изменением степени окисления, или окислительно-восстановительные
Так, реакция разложения гидроксида меди (II) на оксид меди (II) и воду протекает без изменения степени окисления. Ни один элемент, в этой реакции, не изменил свою степень окисления.
А реакция взаимодействия цинка с серной кислотой является окислительно-восстановительной, т.к. цинк изменяет степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Цинк является восстановителем, а водород окислителем.

По агрегатному состоянию реагирующих веществ, реакции делятся на:
· гомогенные
· гетерогенные
Гомо, означает одинаковый, поэтому в гомогенных реакциях вещества находятся в одинаковом агрегатном состоянии, т.е. только в жидком или газообразном.
Так, в реакции соляной кислоты и гидроксида натрия оба вещества находятся в жидком состоянии, поэтому эта гомогенная реакция.
HCl(р-р) + NaOH(р-р) = NaCl(р-р) + H2O
Гетеро, означает разный, поэтому в этих реакциях вещества находятся в разных агрегатных состояниях.
Так, например, реакция горения серы является гетерегенной, т.к. вступающая в реакцию сера является твёрдым веществом, а кислород – газообразным.
S(тв.) + O2(г.) = SO2(г)
Попробуем провести эксперимент. Поместим железный гвоздь в раствор сульфата меди (II). И что же наблюдаем? Через некоторое время на той части гвоздя, которая была помещена в раствор осела медь, раствор тоже поменял свою окраску с голубой на, жёлтую.

CuSO4(р-р) + Fe(тв.) = FeSO4(р-р) + Cu↓
Охарактеризуем эту реакцию по всем признакам.
1. реакция замещения, потому что из исходного сложного вещества (сульфата меди (II)) и исходного простого (железа) образуется новое сложное (сульфат железа (II)) и новое простое вещество (медь).
2. реакция необратимая. Она протекает только в одном направлении (между левой и правой частью уравнения стоит знак равенства).
3. реакция экзотермическая, т.к. протекает с выделением незначительного количества теплоты, ведь в опыте не требуется нагревание.
4. реакция окислительно-восстановительная, потому что медь и железо изменили свои степени окисления: медь с +2 до 0, железо с 0 до +2, медь является окислителем, а железо восстановителем.

5. реакция гетерогенная. Она протекает между твёрдым веществом и раствором.

6. Реакция является некаталитической, т.к. катализатор не участвует в этой реакции.
Однако для того чтобы прошла химическая реакция, реагирующие частицы должны столкнуться друг с другом. Но не всегда это столкновение приводит к их взаимодействию. Для этого, частицы должны быть достаточно активными, т.е. обладать таким запасом энергии, который приводит к ослаблению химических связей, а потом и к разрыву их.
Например, у нас вступают в реакцию вещество А и вещество Б. На оси ординат отложена энергия. Для того чтобы у нас образовалось вещество В, исходные вещества А и Б должны преодолеть энергетический барьер. На вершине этой кривой – переходное состояние, т.е. здесь нет уже веществ А и Б, но и ещё не образовалось вещество В. Это состояние существует очень короткое время, после чего образуется вещество В и выделяется энергия.

Теперь мы плавно можем перейти к изучению и скорости химической реакции. Если энергия активации мала, то скорость реакции будет высокой, но если энергия активации велика, то реакции будут протекать медленно.

Известно, что некоторые химические реакции протекают очень быстро. Например, если добавить раствор нитрата серебра к раствору хлорида натрия, то практически мгновенно выпадает белый творожистый осадок, или если к раствору карбоната калия добавить соляной кислоты, то сразу же вы увидим выделение пузырьков газа, с огромной скоростью протекают реакции, сопровождающиеся взрывом.

Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой пленкой. Такие реакции, как рост сталактитов и сталагмитов в пещерах, разрушение статуй под действием кислотных дождей, протекают очень медленно.

Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой – миллионы лет. Почему так? Термодинамика ответить на этот вопрос бессильна: в этой теории не учитывается время скорости химических реакций, которую изучает химическая кинетика. Более того, химическая кинетика дает ключ к управлению реакций.
Что же такое скорость?
Например, Бальзак прочитывал 200 страниц за полчаса

Наполеон читал со скоростью две тысячи слов в минуту, т.е. 12.000 знаков.

Археолог Р. Шлиман путём тренировок добился того, что очередной иностранный язык выучивал за 6-8 недель.

Ураган движется со скоростью 125 миль в час.

Как определить скорость, а в частности скорость химической реакции? Количественной характеристикой быстроты протекания химической реакции является скорость химической реакции, которую обозначают латинской буквой υ.
Скорость химической реакции определяется изменением концентрации исходных веществ или продуктов реакции в единицу времени.

От чего же зависит сама скорость химической реакции?
· она зависит от природы реагирующих веществ. Сейчас мы это докажем. Нальём в две пробирки 1-2 мл соляной кислоты, в одну поместим гранулу цинка, а во вторую кусочек железа такого же размера. Понаблюдаем, что же происходит? В первой пробирке реакция протекает быстрее, чем во второй, это видно по интенсивности выделения водорода. Почему? Да потому, что цинк более активный металл, чем железо и реакция буде протекать быстрее с цинком, чем с железом. То есть природа металла оказывает влияние на скорость этой реакции.
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
А теперь поместим в две пробирки по грануле цинка и прильём в первую пробирку соляной кислоты, во вторую – уксусной кислоты, но эти кислоты будут одинаковой концентрации. Проследим за изменениями. В первой пробирке скорость реакции гораздо выше, чем во второй. Значит, природа кислоты тоже оказывает влияние на скорость реакции. Т.к. интенсивность выделения водорода в первой реакции больше, значит, и кислота там более сильная, чем во второй пробирке.
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2CH3COOH = (CH3COO)2Zn + H2↑
· скорость реакции зависит и от концентрации реагирующих веществ. Нальём в три пробирки разное количество соляной кислоты: в первую – 3мл, во втору – 2 мл, а в третью – 1 мл. Затем во вторую пробирку добавим 1 мл воды, а в третью – 2 мл. Получается, что объём жидкости в трёх пробирках у нас одинаковый. А концентрация кислоты? Подумайте? Затем добавим в каждую пробирку по грануле цинка и посмотрим, что будет происходить. Интенсивнее всего водород выделяется в первой пробирке, во второй – менее интенсивно, а в третьей – меньше всего наблюдается выделение водорода. Получается, что концентрация кислоты в первой пробирке была больше всего, а меньше всего в третьей. Следовательно, чем выше концентрация веществ, тем и больше скорость взаимодействия между ними.

· Третьим фактором, влияющим на скорость реакции, является площадь соприкосновения реагирующих веществ. Нальём в две пробирке равное количество соляной кислоты, в первую пробирку поместим кусочек мрамора, а во вторую – мраморную крошку. И что же наблюдаем? Во второй пробирке реакция прошла гораздо быстрее, чем в первой. Ведь площадь соприкосновения во второй пробирке гораздо больше, чем в первой. Поэтому, чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции.

Из повседневного опыта вы знаете, что быстрее сгорит 1 кг стружек, чем 1 кг цельной древесины. Когда вы разжигаете костёр, то наверняка, подкладываете под дрова мелкие щепки, а под них скомканную бумагу. При тушении пожаров, наоборот, уменьшают площадь соприкосновения горящих предметов с воздухом.

А на производстве используют так называемый кипящий слой, т.е. измельчают твёрдое вещество до состояния пыли, затем через него снизу пропускают второе вещество, чаще газообразное, когда оно проходит через мелкораздробленный слой, то создает эффект кипения. Этот метод используют при производстве серной кислоты и нефтепродуктов.


Можно самим смоделировать «кипящий слой». Для этого на кольцо лабораторного штатива закрепим кусочек сетчатой ткани. Насыплем на неё 1-2 столовые ложки манной крупы. А снизу будем продувать воздух с помощью резиновой груши. У нас вами тоже получается эффект кипения.
· Четвёртым фактором, который влияет на скорость химической реакции, является температура. В химическое взаимодействие вступают только активные частиц, а при повышении температуры количество этих активных частиц значительно увеличивается, т.к. нагревание сообщает частицам необходимую энергию активации. Поэтому, естественно, что чем выше температура, тем больше скорость реакции.

Я.Х. Вант-Гофф сформулировал правило: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в 2-4 раза. Эта величина называется температурным коэффициентом (γ).

Поэтому на производстве используются высокотемпературные химические процессы: при выплавке чугуна и стали, варке стекла и мыла, производстве бумаги и нефтепродуктов и др.




Попробуем это доказать с помощью лабораторного опыта. Если, насыпать в две пробирки одинаковое количество чёрного порошка оксида меди (II), и прилить в каждую 3-4 мл раствора серной кислоты. Затем первую пробирку поставить в стакан с горячей водой, а вторую нагреть на пламени спиртовки, то очевидно, что реакция во второй пробирке пойдёт гораздо быстрее, чем в первой, ведь температура выше во втором случае. Таким образом, мы доказали с вами, что, чем выше температура, тем больше скорость реакции.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O

· Пятым фактором, от которого зависит скорость реакции, являются катализаторы, но о них вы узнаете чуть позже.

· Кроме этого, такой фактор, как изменение давления влияет на скорость только тех реакций, в которых участвуют газообразные вещества. При увеличении давления уменьшается объём газов, что ведёт к увеличению концентрации газов, а следовательно и увеличению скорости реакции.


 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 17073
17073

