«Другого ничего в природе нет….
Ни здесь, ни там – в космических глубинах.
Все: от песчинок малых до планет
из элементов состоит единых»
Степан Щипачёв
Ранее изучалось строение атома. С помощью опытов Резерфорда, было установлено, что почти вся масса и весь положительный заряд атома сосредоточены в атомном ядре, вокруг которого вращаются отрицательно заряженные электроны. После этого открытия возникал резонный вопрос: а из чего состоит ядро? Ещё в 1913 году, Резерфорд предположил, что в состав любого атомного ядра входит ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента была в целое число раз больше массы ядра атома водорода. Это дало основание рассматривать ядро атома водорода как элементарную частицу. Такая частица была названа протоном.
В 1919 году Резерфорд провел следующий опыт: он обстреливал ядро атома азота a-частицами. При попадании a-частицы в ядро азота, образовались два совершенно новых ядра: по предварительным оценкам, это были ядра атомов кислорода и водорода.

Однако полной уверенности в этом не было до тех пор, пока эксперимент не был повторен в камере Вильсона. На фотографии видны расходящиеся прямые линии – это следы a-частиц, которые не испытали соударений с ядрами атомов азота.

Тем не менее, на фотографии ясно видно, что след одной a-частицы раздваивается. Это говорит о том, что именно эта a-частица столкнулась с ядром атома азота. По характеру искривления треков было установлено (на этот раз точно), что образовавшиеся ядра действительно являются ядрами атомов кислорода и водорода. Таким образом, Резерфордом фактически была получена первая искусственная ядерная реакция.

В
уравнении, описывающем данную реакцию, символом  ,
обозначено ядро атома водорода, масса которого составляет приблизительно одну
атомную единицу массы (1 а.е.м.),
а заряд равен модулю элементарного заряда. Ядро атома водорода также
обозначается символом
,
обозначено ядро атома водорода, масса которого составляет приблизительно одну
атомную единицу массы (1 а.е.м.),
а заряд равен модулю элементарного заряда. Ядро атома водорода также
обозначается символом  (то
есть символом протона, поскольку это одно и то же). Впоследствии были проведены
подобные эксперименты и с другими элементами, такими как натрий, алюминий,
магний и многими другими. Из всех этих ядер a-частицы
выбивали протоны, что подтверждало гипотезу Резерфорда.
(то
есть символом протона, поскольку это одно и то же). Впоследствии были проведены
подобные эксперименты и с другими элементами, такими как натрий, алюминий,
магний и многими другими. Из всех этих ядер a-частицы
выбивали протоны, что подтверждало гипотезу Резерфорда.
Тем
не менее, очень скоро стало ясно, что ядра не состоят только из протонов.
Дело в том, что это противоречило опытным данным. Для примера возьмем ядро
бериллия, заряд которого равен четырем элементарным зарядам  .
Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро
состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м.
В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно,
в ядро входят еще какие-то частицы, причем не
обладающие электрическим зарядом. Именно на основании
этого, в 1929 году Резерфорд высказал предположение о существовании электрически
нейтральной частицы, масса которой приблизительно равна массе протона.
.
Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро
состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м.
В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно,
в ядро входят еще какие-то частицы, причем не
обладающие электрическим зарядом. Именно на основании
этого, в 1929 году Резерфорд высказал предположение о существовании электрически
нейтральной частицы, масса которой приблизительно равна массе протона.
В 1930 году Вальтер Боте и его студент Герберт Беккер обнаружили следующее: при бомбардировке a-частицами ядра атома бериллия, из ядра исходит какое-то неизвестное излучение. Сначала было выдвинуто предположение о том, что это гамма-лучи, поскольку они имели высокую проникающую способность и никак не отклонялись в магнитном поле. Однако, от этой идеи пришлось отказаться, поскольку данное излучение обладало слишком большой энергией для гамма-лучей. В 1932 году изучением нового излучения занялся ученик Резерфорда - Джеймс Чедвик.

Он
доказал, что неизвестное излучение – это на самом деле поток нейтральных
частиц, масса которых приблизительно равна массе протона. Эту массу удалось
определить по характеру взаимодействия с другими частицами. То, что частица
электрически нейтральна, следовало из того, что она не отклонялась ни в
электрическом, ни в магнитном поле. Такую частицу назвали нейтроном.
Итак, нейтрон обозначается символом  (поскольку
не имеет заряда и обладает массой приблизительно равной 1 а.е.м.).
Впоследствии точные измерения показали, что масса нейтрона чуть больше массы
протона.
(поскольку
не имеет заряда и обладает массой приблизительно равной 1 а.е.м.).
Впоследствии точные измерения показали, что масса нейтрона чуть больше массы
протона.
Практически сразу после открытия нейтрона физиками Дмитрием Иваненко и Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядра.

Работая независимо друг от друга, они пришли к выводу, что ядра атомов всех элементов состоят из двух видов частиц: протонов и нейтронов. Эти частицы стали называть нуклонами. Общее число нуклонов в ядре называется массовым числом (поскольку это число определяет массу ядра). Массовое число обозначается буквой А. Число протонов в ядре называется зарядовым числом (поскольку это число определяет заряд ядра). Зарядовое число обозначается буквой Z. Нетрудно догадаться, что число нейтронов в ядре равно разности общего числа нуклонов и числа протонов. То есть, чтобы найти число нейтронов, нужно из массового числа вычесть зарядовое число. Это число обозначается буквой N.
Итак, в общем случае, ядро любого химического элемента обозначается следующим образом:

где Х – это символ элемента, Z – зарядовое число и А – массовое число. Еще раз уточним, что массовое число равно массе, выраженной в атомных единицах и округленной до целых. Зарядовое число равно заряду, выраженному в единицах элементарного электрического заряда. Для примера рассмотрим ядро натрия.

В таблице Менделеева, натрий имеет порядковый номер 11 – это и есть зарядовое число. Значит, в ядре натрия содержится 11 протонов. Поскольку атом в целом электрически нейтрален, можно заключить, что в атоме содержится 11 электронов. В таблице Менделеева также указана масса натрия – 23. Значит, в ядре натрия содержится 12 нейтронов. Итак, чтобы определить количество протонов, нейтронов и электронов в атоме, нужно сделать следующее:
– Посмотреть в таблице Менделеева порядковый номер интересующего вас элемента. Таким образом, определяетс зарядовое число – то есть число протонов и число электронов.
– Посмотреть массу этого элемента в таблице Менделеева и округлить её до целых (она почти всегда очень близка к целому числу). Таким образом, определяется массовое число, то есть общее число нуклонов. Для нахождения числа нейтронов, нужно из массового числа вычесть зарядовое число.
Необходимо отметить, что существуют атомы, которые ничем не отличаются друг от друга по своим химическим свойствам, но обладают различным массовым числом. Впервые, на существование таких атомов обратил внимание Фредерик Содди, который работал вместе с Резерфордом. Содди предложил называть такие атомы изотопами. С помощью опытов было установлено, что изотопы одинаково вступают в химические реакции и образуют одинаковые соединения. Это говорило о том, что число электронов в электронных оболочках (а, значит, и заряд ядра) у изотопов одинаковы. Стало быть, в ядрах изотопов содержалось различное число нейтронов.
На сегодняшний день найдены изотопы всех химических элементов. Например, водород имеет три изотопа: протий, дейтерий и тритий.
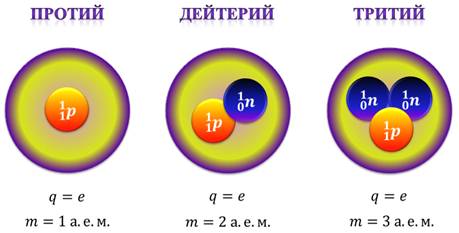
Ядро протия состоит только из одного протона (это самый распространенный изотоп водорода). То есть, заряд ядра протия равен элементарному заряду, а масса равна одной атомной единице. Ядро дейтерия включает в себя один протон и один нейтрон. Таким образом, заряд ядра дейтерия тоже равен элементарному, но масса уже равна двум атомным единицам. Наконец, ядро трития содержит один протон и два нейтрона. Заряд ядра трития опять-таки равен элементарному заряду, а вот масса равна трем массовым единицам.
Другие химические элементы могут иметь значительно больше изотопов: например у урана их насчитывается 26. Наиболее распространенные изотопы урана – это уран 235 и уран 238 (поскольку зарядовое число изотопов одинаковое, имеет смысл упоминать только массовое число, чтобы понять, о каком изотопе идет речь).

Надо сказать, что некоторые изотопы могут являться радиоактивными. В связи с этим, изотопы делятся на стабильные и нестабильные. Стабильные изотопы сохраняются неизменными сколь угодно долго, а нестабильные изотопы со временем превращаются в другие химические элементы в результате радиоактивного распада.
Именно из-за существования изотопов, для большинства элементов в таблице Менделеева указана дробная масса. Дело в том, что эта масса вычисляется как средняя масса всех изотопов с учетом степени распространения каждого изотопа. Например, как мы уже убедились, водород имеет три изотопа с массовыми числами один, два и три. Но протий распространен гораздо больше: его содержание в природе составляет почти 99,99%. Поэтому в таблице Менделеева масса водорода практически равна единице.
Возникает важнейший вопрос: как же ядра многих изотопов остаются стабильными? Что удерживает нуклоны в ядре? Ведь между положительно заряженными протонами должны возникать силы электростатического отталкивания. Силы, удерживающие протоны и нейтроны в ядре называются ядерными силами. Нетрудно догадаться, что раз протоны не разлетаются в разные стороны, значит, ядерные силы значительно мощнее, чем электростатические силы. Но ядерные силы действуют на очень малом расстоянии, то есть в пределах атомного ядра. Эти силы фундаментально отличаются от гравитационного или электромагнитного взаимодействия и относятся к сильному взаимодействию, о котором упоминалось в девятом и десятом классах. Также к свойствам ядерных сил можно отнести то, что они не являются центральными (то есть не действуют вдоль прямой, соединяющей частицы). Кроме того, ядерные силы не зависят от величины заряда частиц (поскольку они действуют и на незаряженные частицы – нейтроны).
Основные выводы:
– После открытия протона и нейтрона была предложена протонно-нейтронная модель ядра.
– Согласно этой модели все ядра атомов состоят из протонов и нейтронов. Частицы, входящие в состав ядра назвали нуклонами.
– Общее число нуклонов в ядре называется массовым числом, а число протонов в ядре называется зарядовым числом.
– Массовое число А численно равно массе ядра данного химического элемента, выраженной в атомных единицах массы и округленной до целого.
– Зарядовое число Z численно равно заряду ядра, выраженному в единицах элементарного электрического заряда.
– Число нейтронов в ядре определяется как разность массового и зарядового чисел.

– В результате исследований было открыто существование разновидностей каких-либо химических элементов, которые обладали одинаковыми химическими свойствами, но имели различную массу. Такие разновидности назвали изотопами.
– Ядерные силы – это силы, удерживающие нуклоны в ядре в течение длительного времени. Тем не менее, ядерные силы не распространяются за пределы атомных ядер.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 11505
11505

