У органических кислот своя классификация. По типу углеводородного радикала различают предельные карбоновые кислоты, у которых све связи сигма-типа, например, пропановая кислота, или масляная; непредельные, у которых есть кратные связи, например, акриловая, или пропэновая кислота; и ароматические карбоновые кислоты, у которых есть ароматическое кольцо: например, бензойная кислота.
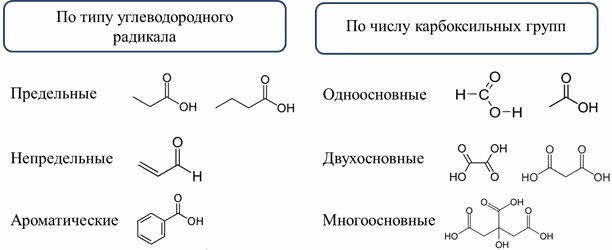
По числу карбоксильных групп различают одноосновные карбоновые кислоты, у которых одна карбоксильная группа, например, муравьиная, уксусная кислота; двухосновные, у которых две карбоксильные группы, например, щавелевая, малоновая кислота; и многоосновные кислоты, у которых несколько карбоксильных групп, например, лимонная кислота.
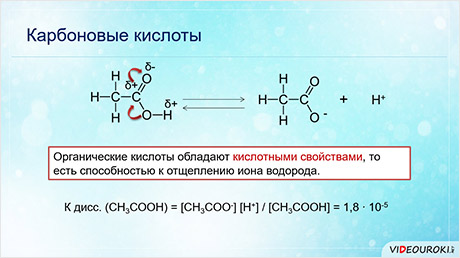
Органические кислоты, как и неорганические, обладают кислотными свойствами, то есть способностью к отщеплению иона водорода.
Карбоновые кислоты – слабые электролиты. Так, константа диссоциации уксусной кислоты: одна целая восемь десятых на десять в минус пятой степени.


От чего же зависит сила карбоновой кислоты?
Во-первых, от строения. То есть чем больше положительный заряд на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет. Наличие углеводородных радикалов с карбоксильной группой уменьшает способность кислоты диссоциировать, поэтому и сила кислоты будет уменьшаться.
Так, в ряду от муравьиной до два-два-диметил-пропановой кислоты сила кислот будет уменьшаться.

То есть самой сильной кислотой будет муравьиная, или метановая кислота, у которой и самая высокая константа диссоциации.
Введение электроноакцэпторных заместителей увеличивает положительный заряд на томе водорода, а значит, и силу кислоты.
Например, в ряду от уксусной до трихлор-уксусной кислоты сила кислот будет увеличиваться, так как увеличивается число электроноакцэпторного заместителя – хлора.

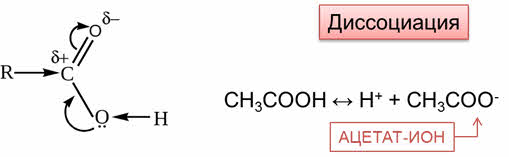
Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Из-за смещения электронной плотности от гидроксильной группы к сильно поляризованной карбонильной группе молекулы карбоновых кислот способны к электролитической диссоциации.
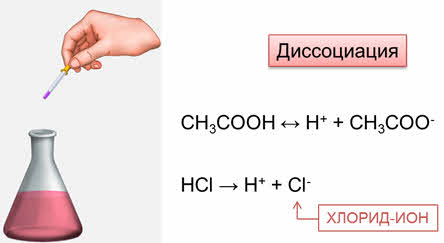
Так, при диссоциации уксусной кисоты образуется ион водорода и ацэтат-ион.
Неорганические кислоты в растворе также диссоциируют с образованием ионов водорода и изменяют окраску индикаторов. При диссоциации соляной кислоты образуются ионы водорода и хлорид-ионы.
Органические и неорганические кислоты реагируют с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода.
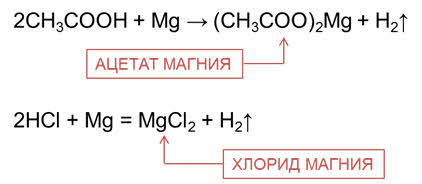
Например, в реакции уксусной кислоты с магнием образуется соль – ацэтат магния и выделяется газ – водород, в реакции соляной кислоты с магнием образуется соль – хлорид магния и газ водород.

Органические и неорганические кислоты реагируют с основными и амфотэрными оксидами.
В реакции уксусной кислоты с основным оксидом – оксидом меди два, образуется соль – ацэтат меди два и вода; в реакции соляной кислоты с оксидом меди два образуется соль – хлорид меди два и вода.


В реакции уксусной кислоты с амфотэрным оксидом – оксидом алюминия образуется соль – ацэтат алюминия и вода; в реакции соляной кислоты с оксидом алюминия образуется хлорид алюминия и вода.


Органические и неорганические кислоты взаимодействуют с основаниями. Эти реакции являются реакциями нейтрализации.
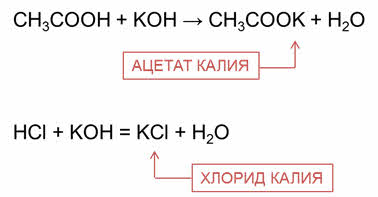
Так, в реакции уксусной кислоты с гидроксидом калия образуется соль – ацэтат калия и вода, в реакции соляной кислоты с гидроксидом калия образуется соль – хлорид калия и вода.
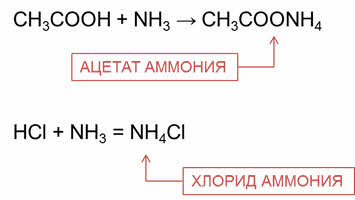
Органические и неорганические кислоты реагируют с аммиаком с образованием солей аммония.
Например, в реакции уксусной кислоты с аммиаком образуется соль – ацэтат аммония; в реакции соляной кислоты с аммиаком образуется соль – хлорид аммония.
Органические и неорганические кислоты реагируют с солями слабых кислот.
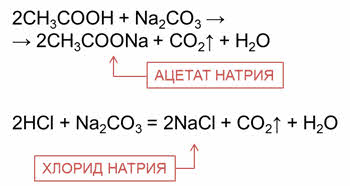
Так, в реакции уксусной кислоты с карбонатом натрия образуется соль – ацэтат натрия, углекислый газ и вода; в реакции соляной кислоты с карбонатом натрия образуется соль – хлорид натрия, углекислый газ и вода.
Таким образом, химические свойства органических кислот обусловлены в основном наличием в молекуле карбоксильной группы. Общие свойства органических и неорганических кислот проявляются в реакциях с основаниями, некоторыми активными металлами, основными и амфотэрными оксидами, солями более слабых кислот.

 Получите свидетельство
Получите свидетельство Вход
Вход




 6572
6572

